SCIENCE ADVANCES 29 Jul 2022 Vol 8, Issue 30 DOI: 10.1126/sciadv.abn7702
RESEARCH ARTICLE CELL BIOLOGY
Longer metaphase and fewer chromosome segregation errors in modern human than Neanderthal brain development (現代人の脳形成では、ネアンデルタール人よりも分裂中期が長く、染色体分離のエラーが少ない)
FELIPE MORA-BERMÚDEZ, SVANTE PÄÄBO et al.
Max Planck Institute of Molecular Cell Biology and Genetics, Dresden, Germany. (MPI-CBG)
Max Planck Institute for Evolutionary Anthropology, Leipzig, Germany. (マックス・プランク進化人類学研究所)
Okinawa Institute of Science and Technology, Onna-son 904-0495, Japan. (沖縄科学技術大学院大学)
Abstract
Since the ancestors of modern humans separated from those of Neanderthals, around 100 amino acid substitutions spread to essentially all modern humans. The biological significance of these changes is largely unknown. Here, we examine all six such amino acid substitutions in three proteins known to have key roles in kinetochore function and chromosome segregation and to be highly expressed in the stem cells of the developing neocortex. When we introduce these modern human-specific substitutions in mice, three substitutions in two of these proteins, KIF18a and KNL1, cause metaphase prolongation and fewer chromosome segregation errors in apical progenitors of the developing neocortex. Conversely, the ancestral substitutions cause shorter metaphase length and more chromosome segregation errors in human brain organoids, similar to what we find in chimpanzee organoids. These results imply that the fidelity of chromosome segregation during neocortex development improved in modern humans after their divergence from Neanderthals.
現代人の祖先がネアンデルタール人と別れて以来、約100種類のアミノ酸の置換が、基本的にすべての現代人に広まった。これらのアミノ酸置換の生物学的意義はほとんどわかっていない。ここでは、キネトコア(動原体)機能と染色体分離に重要な役割を持ち、発達中の新皮質の幹細胞で高発現していることが知られている3つのタンパク質について、そのような6つのアミノ酸置換をすべて検討した。現代人特有の置換をマウスに導入すると、これらのタンパク質のうちKIF18aとKNL1(Kinetochore scaffold 1)の3つの置換により、発達中の新皮質の未分化型前駆細胞(apical progenitor)においてメタフェース(分裂中期)の延長と染色体分離エラーの減少が引き起こされることがわかった。逆に、祖先型のアミノ酸置換は、チンパンジーのオルガノイドで見られるのと同様に、ヒトの脳オルガノイドで中期の長さを短くし、より多くの染色体分離エラーを引き起こします。これらの結果は、現代人がネアンデルタール人と分岐した後、新皮質形成時の染色体分離の忠実性が向上したことを示唆している。

Summary
大脳新皮質は哺乳類に特有で、感覚と運動を制御する。ヒトの進化の過程で、大脳新皮質は劇的に大きくなった。このことは、人間の認知能力の発達に関連していると広く考えられている。新皮質のサイズアップにつながる定量的な変化としては、例えば、新皮質の幹細胞や前駆細胞の増殖能力や数が増加し、その結果、神経細胞やマクログリア細胞(アストロサイト)が生成されるようになることが挙げられる。しかし、新皮質の大きさの増加に伴って生じたと思われる、ヒトの進化における新皮質の発達の質的変化については、比較的知られていない。しかし、FOXP2 やSRGAP2C という遺伝子に影響を与える置換や重複は、シナプス形成や結合性に影響を与え、結果としてマウスモデルで学習能力が向上することが示されている。
脳内オルガノイドは、神経前駆細胞、特に脳室帯の神経前駆細胞の有用な組織モデルである。我々は以前、人工多能性幹細胞(iPSC)由来の脳オルガノイドを用いて、ヒト、チンパンジー、オランウータンの新皮質幹細胞および前駆細胞の分裂挙動を比較した。その結果、脳室を構成する細胞であり、発達中の新皮質にある他のすべての神経細胞の起源となるヒトの増殖性頂端前駆細胞(apical progenitor; AP)は、チンパンジーやオランウータンのAPに比べて分裂中期の時間が約50%長いことが分かりました。分裂中期は、有糸分裂において、染色体の分離と2つの娘細胞への均等な分配を開始するための準備を最終的に行う段階である。したがって、分裂中期の長さの違いは、AP分裂中の染色体分離の忠実性がヒトと類人猿で異なり、新皮質の発達と機能に影響を及ぼす可能性があることを提起している。
我々は、新皮質の胚軸に高発現しているKIF18a(別名キネシン8)、KNL1(別名CASC5)、SPAG5(別名アストリン)の3つのタンパク質が、有糸分裂の主軸、キネトコア(動原体)、染色体分離機能に関わることに着目し、その役割を明らかにした。キネトコア(動原体)は、染色体セントロメアとキネトコア微小管の結合を仲介する複雑な3次元(3D)多タンパク質構造である(20-22)。キネトコアの重要な役割は、染色体が赤道面で正しく整列したときに染色体分離の開始を制御する紡錘体組立チェックポイント(SAC)機能を促進することである。この3つのタンパク質は、現生人類には存在するが、類人猿やネアンデルタール人、デニソワ人、すなわち約50万年前に現生人類につながる進化系統から分離したいわゆる古人類には基本的に存在しないアミノ酸置換を持つことから、際立っている。このため、これらの置換がもたらす機能的影響は、現代人に特有のものであると考えられる。
KIF18aはキネシンのモータータンパク質で、染色体の正しい位置と動原体微小管への付着、および有糸分裂紡錘体内での両配向の制御に関与している。KNL1は現代人特有の2つのアミノ酸置換を持ち、外側キネトコアの一部で、キネトコアと微小管の接着に必要である。また、BubR1やMad1などのSACの主要タンパク質の主なドッキング部位でもあり、そのため染色体の整列と分離に重要である。SPAG5は現代人特有の3つのアミノ酸置換を持つ微小管関連タンパク質で、キネトコアに集められ、キネトコアの微小管への付着の安定性に重要である。
我々は、ゲノム編集によって現代人のKIF18aおよびKNL1置換を導入したマウスの胚新皮質におけるAPは、より長いメタフェースを示し、より多くのSAC陽性キネトコアを示し、染色体の誤分離が少ないことを示している。逆に、KIF18aおよびKNL1の祖先変異体を持つヒト胚性幹細胞を用いて大脳オルガノイドを作製した実験では、APにおいてメタフェースの短縮、SAC陽性キネトコアの減少、染色体分離不全が多く観察された。これらのデータを総合すると、KIF18aとKNL1の3つのアミノ酸置換により、現代人のAPでは古代のヒトや類人猿に比べて染色体遺伝エラーが少ないことが示唆された。
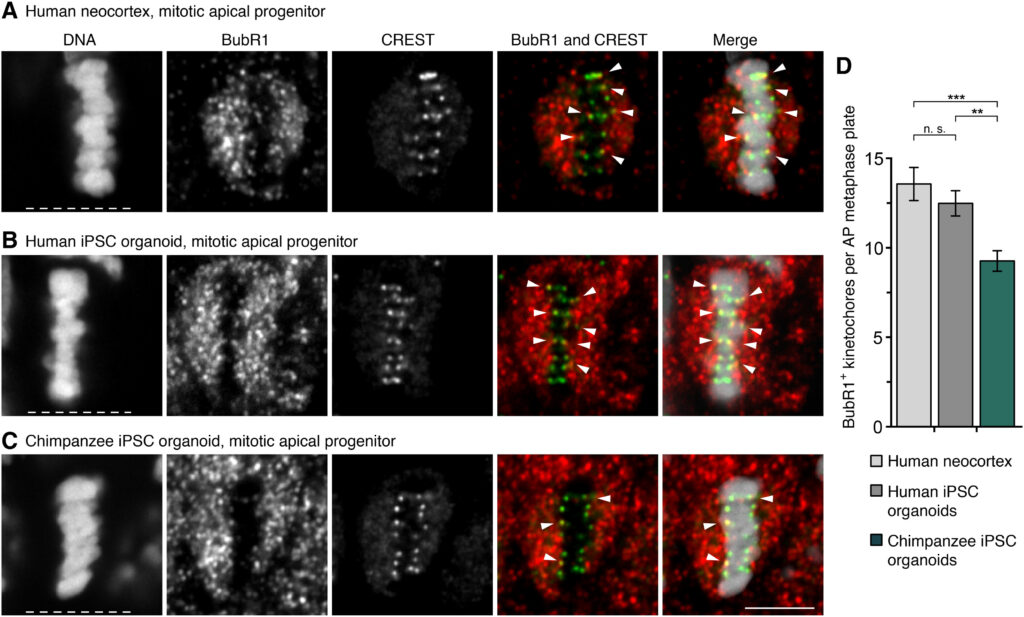
(A to C) APs in metaphase stained with DAPI (4′,6-diamidino-2-phenylindole) and immunostained for the SAC marker BubR1 (red in merges) and the kinetochore marker CREST (green in merges). Arrowheads indicate overlap of BubR1 and CREST immunoreactivity within the metaphase plate. (A) GW12 human neocortex; (B) day 30 human iPSC-derived cerebral organoid; and (C) day 30 chimpanzee iPSC-derived cerebral organoid. White dashed lines, ventricular surface. Scale bar, 5 μm. (D) Quantification of kinetochores positive for BubR1 per AP metaphase plate, for the tissues in (A) to (C) (GW11 to GW12, days 30 to 32). Data are the means ± SEM of ≥41 APs from ≥3 independent experiments each, with 3 neocortex samples and ≥5 organoids each. Brackets with **P < 0.01; ***P < 0.001; n. s., nonsignificant (Kruskal-Wallis test with Dunn’s multiple comparisons correction).
Discussion
KNL1とKIF18aの現代人特有のアミノ酸置換は、より多くのキネトコアがSACの構成要素と結合し、有糸分裂APにおける遅発染色体や染色体断片が少なくなることは注目される。したがって、これらの置換は、新皮質発生中のAPにおいて、より高い精度の染色体分離をもたらすと思われる。このことは、重大な結果をもたらす可能性がある。この発生の初期段階において、APは対称的な増殖分裂を行い、APプールの大きさを増大させる。したがって、この段階でAPに生じたいかなる染色体分離エラーもAPの増殖によって増幅され、異常な染色体数を持つAPが増えることになる。大脳皮質神経発生の初期にAPが非対称分裂に移行すると、染色体異常はその子孫、すなわち基底前駆細胞、皮質ニューロン、マクログリア細胞に伝達される可能性がある。したがって、染色体異常のあるAPから派生した放射状ユニット、ひいてはそのユニットを含む皮質カラムは、機能的に影響を受ける可能性がある。脳における神経細胞の異数性の割合は、文献上、非常に異なっていることが報告されている。しかし、ここで見られる遅発性染色体の割合は、最近の研究でヒトの脳について報告された異数性の割合と一致することに注目したい。また、間違った分離はアポトーシスを引き起こし、前駆細胞や彼らが生成したはずの放射状ユニットを失わせるかもしれない。いずれの場合も、例えば興奮性錐体細胞とその多数の接続や投射など、影響を受けた放射状単位を持つ新皮質領域全体の機能に影響を及ぼす可能性がある。さらに、染色体分離の欠陥が残っていると、核組織の乱れ、小核の発生の増加、および遺伝子発現の不均衡のために、様々な多面的な影響を及ぼす可能性がある。これらの影響は、例えば自閉症スペクトラム障害に関与している可能性のある体細胞点突然変異の影響よりも深い傾向にあるのかもしれない。今回のデータは、現代人がネアンデルタール人、デニソワ人、類人猿よりも染色体異常の有害な影響を受ける確率が低いことを示唆している。現代人に特徴的な形質に対するこれらの影響の重要性については、さらなる研究が必要である。
〇参考文献
https://www.frontiersin.org/articles/10.3389/fnins.2022.878950/full
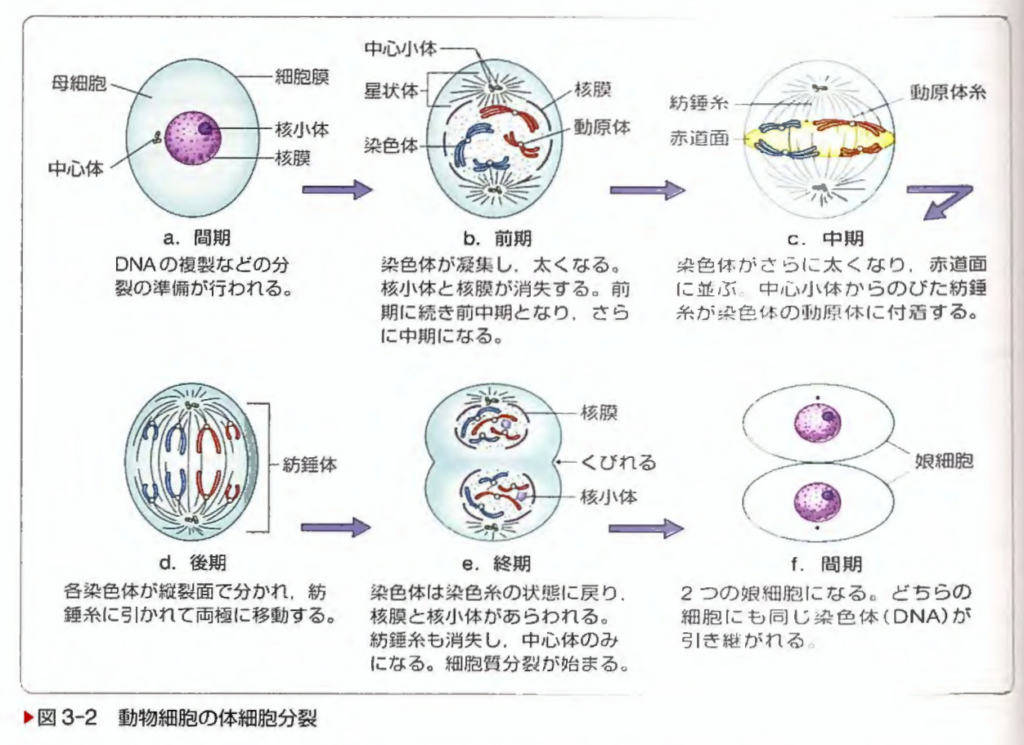
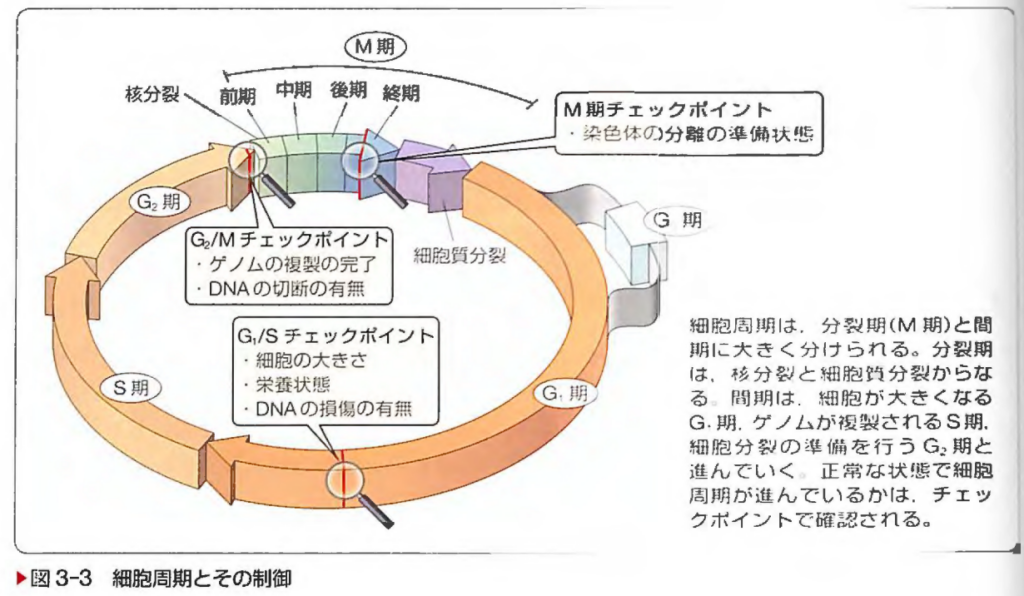
系統看護学講座-基礎分野 生物学 第10版

“Journal Club (August 12, 2022)” への1件のフィードバック