Nature Neuroscience (2022) Article Published: 22 August 2022
Preconfigured dynamics in the hippocampus are guided by embryonic birthdate and rate of neurogenesis (海馬の事前設定されたダイナミクスは、胚の生年月日と神経新生速度によって導かれる)
Roman Huszár, Yunchang Zhang, Heike Blockus & György Buzsáki
- Neuroscience Institute, New York University, New York, NY, USA
- Center for Neural Science, New York University, New York, NY, USA
- Department of Neurology, Langone Medical Center, New York, NY, USA
ギョルグ・ブザーキ(1949年11月24日 ハンガリーのカポスヴァール生まれ)は、ニューヨーク大学医学部神経科学のビグス教授である。1974年にハンガリーのペーチ大学で医学博士を取得し、Endre Grastyánの指導の下、神経科学の博士号を取得した。ブザーキの主な関心は「neural syntax」、すなわち、認知機能を支える多数の脳内リズムによって神経情報の分節化がどのように組織化されるかということである。ブザーキは海馬のシータ波、ガンマ波、シャープ波とそれに付随する高速振動の細胞・シナプス基盤、それらの相互関係、行動や睡眠との関係を明らかにした。シリコンチップを用いた大規模記録法や、動物と患者の両方に使用される有機的でコンフォータブルな電極システムであるニューログリッドなど、数多くの技術革新のパイオニアである。(Wikipediaより)
Abstract
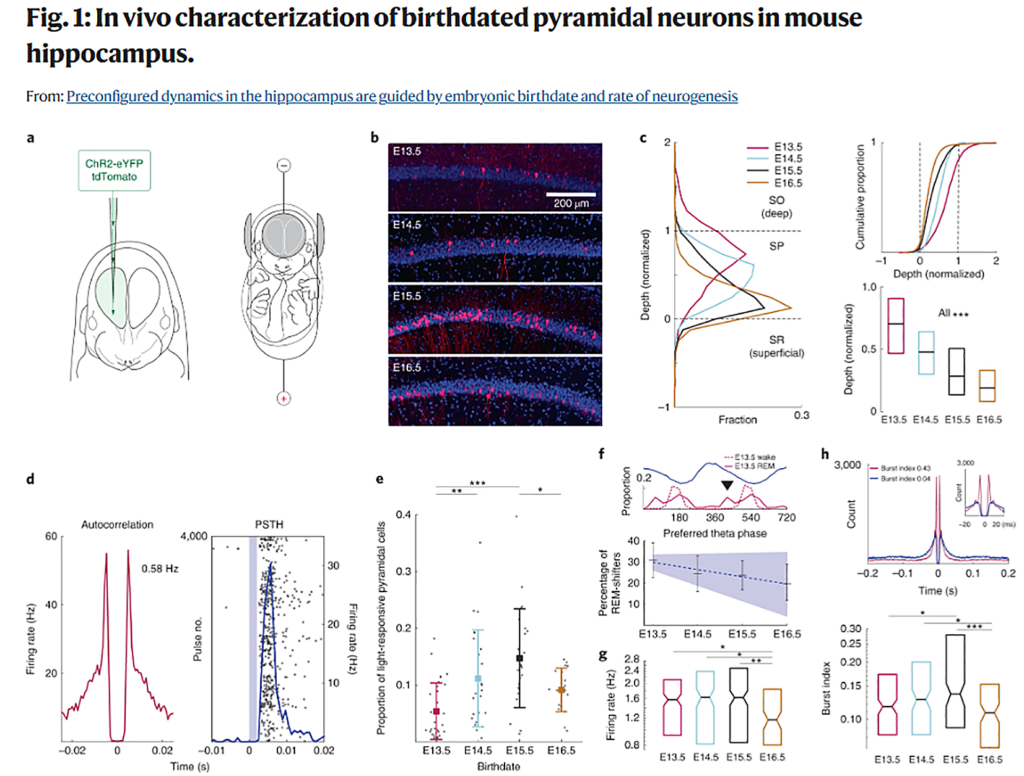
The incorporation of new information into the hippocampal network is likely to be constrained by its innate architecture and internally generated activity patterns. However, the origin, organization and consequences of such patterns remain poorly understood. In the present study we show that hippocampal network dynamics are affected by sequential neurogenesis. We birthdated CA1 pyramidal neurons with in utero electroporation over 4 embryonic days, encompassing the peak of hippocampal neurogenesis, and compared their functional features in freely moving adult mice. Neurons of the same birthdate displayed distinct connectivity, coactivity across brain states and assembly dynamics. Same-birthdate neurons exhibited overlapping spatial representations, which were maintained across different environments. Overall, the wiring and functional features of CA1 pyramidal neurons reflected a combination of birthdate and the rate of neurogenesis. These observations demonstrate that sequential neurogenesis during embryonic development shapes the preconfigured forms of adult network dynamics.
海馬ネットワークへの新しい情報の取り込みは、その生来の構造と内部で生成される活動パターンに制約される可能性が高い。しかし、そのようなパターンの起源、構成、結果については、まだ十分に理解されていない。本研究では、海馬ネットワークのダイナミクスが連続的なニューロン新生に影響されることを示した。海馬のニューロン新生のピークを含む胚4日間にわたり、子宮内エレクトロポレーション(電気穿孔)法によりCA1錐体ニューロンをラベルし、自由に活動している成体マウスでその機能的特徴を比較検討した。同じ生年月日の神経細胞は、異なる結合性、脳内状態間の共働性、集合ダイナミクスを示した。同じ生年月日の神経細胞は重複した空間表現を示し、それは異なる環境下でも維持された。CA1錐体細胞の配線と機能的特徴は、全体として生年月日とニューロン新生速度の組み合わせに反映されることがわかった。これらの結果は、胚発生中の連続的なニューロン新生が、成体のネットワークダイナミクスの事前設定された形を形成していることを示すものである。
〇胎生期のマウス海馬ニューロン新生を経時的に観察している。誕生日が同じ神経細胞は、成体脳内でもお互い結合し、協調して機能するようになる。 成体脳のネットワークダイナミクスが、胚発生中の連続的なニューロン新生によって事前に決まっていることを示す。
Discussion
我々は、胚発生中の連続的な神経新生が、成体海馬の活動パターンの機能的特徴に影響を与えることを示す。同じ誕生日の錐体細胞は、SPW-Rsとシータ波で強い相関を示した。行動時、SBD(same-birthdate)ニューロンは解剖学的近接性に依存した重複した場所野を示し、異なる環境下で一緒に再マッピングする傾向があった。SBDニューロンは細胞集合体に結合し、その発現頻度は一緒に生まれたニューロンのプールサイズに比例した。我々の計算モデルは、SBDニューロン間のペアワイズ相関が神経発生のベル型波と相互作用して、我々のデータで観察されたような多様な集合体発現率を生み出すことを示唆している。SBD錐体細胞の生理的・行動的相関が類似していることのメカニズムとして、同じ局所介在ニューロンへの収束が考えられる。海馬の錐体細胞に共通する発生段階での起源は、成体脳における単一ニューロンおよび集団発火の特徴を制約し、予測する微小回路配置を偏らせるという仮説が成り立つ。
In summary, we suggest that the radial topography and heterogeneity of functional features within the CA1 pyramidal layer results from a combination of neuronal birthdate and the rate of neurogenesis. These rules may generalize to other cortical networks.
CA1錐体層内の法線方向のトポグラフィーと機能的特徴の不均一性は、ニューロンの生年月日とニューロン新生の速度の組み合わせに起因することが示唆された。これらの法則は、他の皮質ネットワークにも一般化できるかもしれない。
