Glia RESEARCH ARTICLE
Microglial angiotensin type 2 receptors mediate sex-specific expression of inflammatory cytokines independently of circulating estrogen (アンジオテンシンⅡタイプ2受容体は、ミクログリアにおけるサイトカイン発現の性差を、血中エストロゲンとは独立に制御する)
Pablo Garrido-Gil, Maria A. Pedrosa,Maria Garcia-Garrote, Ana Pequeño-Valtierra,Jorge Rodríguez-Castro, Daniel García-Souto, Ana I. Rodríguez-Pérez, Jose L. Labandeira-Garcia
First published: 09 August 2022 https://doi.org/10.1002/glia.24255
Laboratory of Cellular and Molecular Neurobiology of Parkinson’s disease, Research Center for Research in Molecular Medicine and Chronic Diseases (CIMUS), Department of Morphological Sciences, IDIS, University of Santiago de Compostela, Santiago de Compostela (サンティアゴ・デ・コンポステーラ大学), Spain
Networking Research Center on Neurodegenerative Diseases (CiberNed), Madrid, Spain
Pablo Garrido-Gil and Maria A. Pedrosa contributed equally to experiments.
Funding information: Consellería de Cultura, Educación e Ordenación Universitaria, Xunta de Galicia, Grant/Award Numbers: XUGA, ED431C 2018/10, ED431G/05; Instituto de Salud Carlos III, Grant/Award Numbers: PI20/00385, RD16/0011/0016, CIBERNED; Secretaría de Estado de Investigación, Desarrollo e Innovación, Grant/Award Number: RTI2018-098830-B-I00; Regional European Development Fund (FEDER)
Abstract
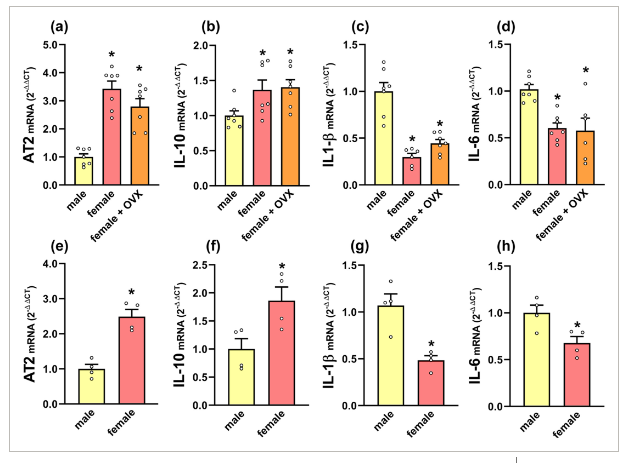
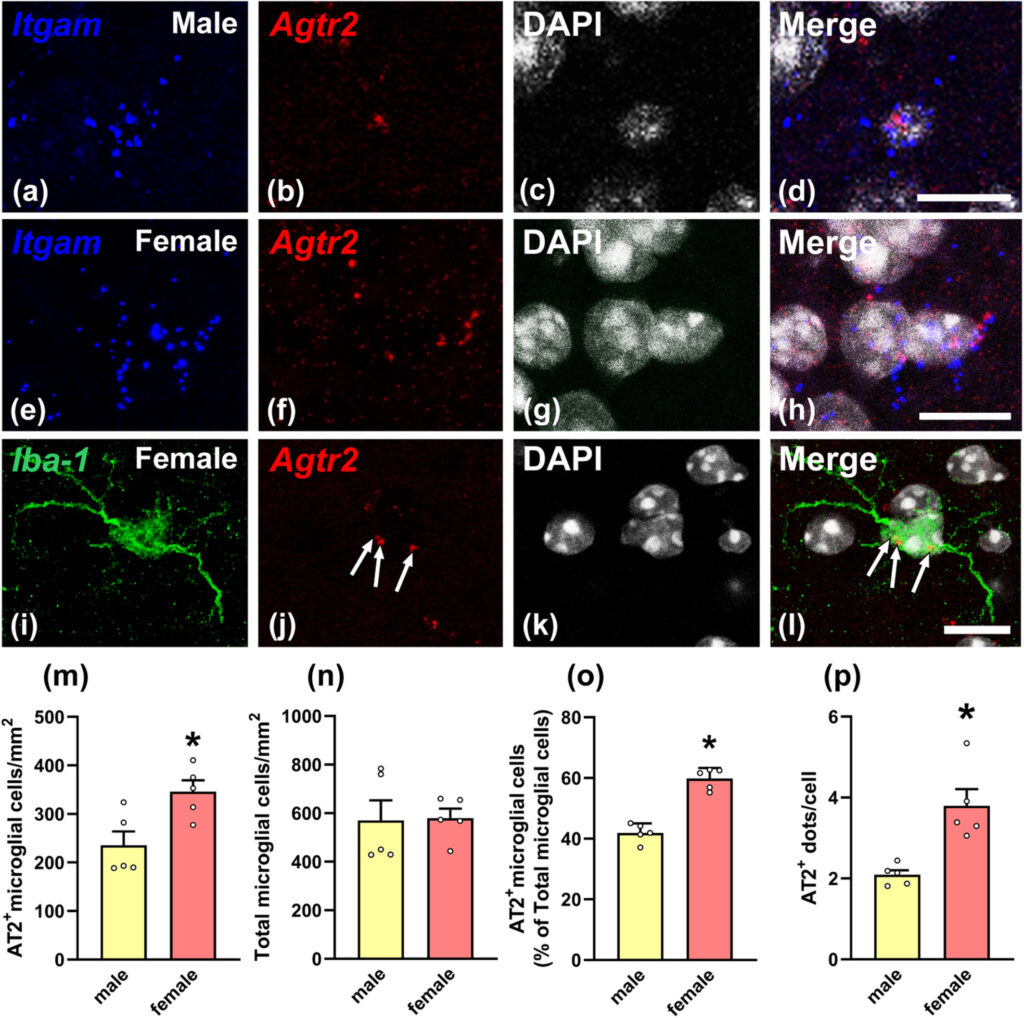
There are sex differences in microglia, which can maintain sex-related gene expression and functional differences in the absence of circulating sex steroids. The angiotensin type 2 (AT2) receptors mediate anti-inflammatory actions in different tissues, including brain. In mice, we performed RT-PCR analysis of microglia isolated from adult brains and RNA scope in situ hybridization from males, females, ovariectomized females, orchiectomized males and brain masculinized females. We also compared wild type and AT2 knockout mice. The expression of AT2 receptors in microglial cells showed sex differences with much higher AT2 mRNA expression in females than in males, and this was not dependent on circulating gonadal hormones, as observed using ovariectomized females, brain masculinized females and orchiectomized males. These results suggest genomic reasons, possibly related to sex chromosome complement, for sex differences in AT2 expression in microglia, as the AT2 receptor gene is located in the X chromosome. Furthermore, sex differences in expression of AT2 receptors were associated to sex differences in microglial expression of key anti-inflammatory cytokines such as interleukin-10 and pro-inflammatory cytokines such as interleukin-1β and interleukin-6. In conclusion, sex differences in microglial AT2 receptor expression appear as a major factor contributing to sex differences in the neuroinflammatory responses beyond the effects of circulating steroids.
ミクログリアには性差があり、循環性のステロイドがない場合でも、性に関連した遺伝子発現や機能的な差異を維持することができる。アンジオテンシン2型(AT2)受容体は、脳を含むさまざまな組織で抗炎症作用を媒介する。マウスでは、成体脳から単離したミクログリアのRT-PCR解析、雄、雌、卵巣摘出雌、睾丸摘出雄、脳男性化化雌(brain masculinized females)のRNA scope in situ hybridizationを実施した。また、野生型とAT2ノックアウトマウスの比較も行った。ミクログリアにおけるAT2受容体の発現は性差を示し、雌では雄よりもAT2 mRNAの発現が非常に高く、これは卵巣摘出雌、脳内男性化雌、睾丸摘出雄を用いて観察したように循環性性腺ホルモンに依存しないことが明らかになった。これらの結果は、AT2受容体遺伝子がX染色体に存在することから、ミクログリアにおけるAT2発現の性差が、おそらく性染色体の遺伝子補正に関連したゲノム上の理由であることを示唆している。さらに、AT2受容体の発現の性差は、インターロイキン-10などの主要な抗炎症性サイトカインとインターロイキン-1βやインターロイキン-6などの炎症性サイトカインのミクログリア発現の性差に関連していた。結論として、ミクログリアAT2受容体発現の性差は、循環ステロイドの影響を超えて、神経炎症反応の性差に寄与する主要な因子であると考えられる。
Discussion
健常マウス脳から分離したミクログリアにおいて、AT2受容体の発現を確認したが、その発現は雄で雌よりはるかに低く、雌の卵巣摘出、睾丸摘出、脳の男性化もこの差に有意な影響を与えなかった。組織切片においても、RNA scope in situ hybridizationを用いて健常脳のミクログリアにおけるAT2受容体の存在を確認したが、これは免疫組織化学を用いたこれまでの研究(Garrido-Gilら、2013;Joglarら、2009)と一致するものであった。しかしながら、AT2受容体は、他の研究においてミクログリアにおいて見出されなかった(de Kloetら、2016)、または健常ミクログリアにおいてin vivoで検出されず、神経炎症プロセスにおいて発現が上昇することが示唆された(Jacksonら、2018)。AT2に対する市販の抗体の特異性も、いくつかの研究によって疑問視されている(Hafko et al.、2013)。これらの不一致は、おそらくmodifyされた動物モデル、雄のげっ歯類、AT2受容体に対する感度が異なる方法の使用によるものである。
結論として、今回の結果は、性差が神経炎症に関連するプロセスの結果に影響を与える可能性があること、そしてミクログリアAT2発現の性差が主要な役割を果たすことを確認するものである。この結果はマウスのミクログリアを用いたものであるが、治療上の決定をする際に患者の性差を無視することはできないことをさらに示唆している。神経炎症反応の性差は、ホルモンと環境因子によって相乗的に調節される可能性がある。しかし、かなりの数の免疫関連遺伝子がX染色体にあり、スケープ遺伝子の数はネズミよりもヒトの方がはるかに多いことが知られている。このことが神経炎症反応の性差に影響している可能性があり、ミクログリアAT2受容体の場合もそうかもしれません。神経炎症、特にミクログリア機能の性差におけるX染色体遺伝子とY染色体遺伝子のメカニズムや役割を理解するために、さらなる研究が必要である。
cfda33077c7dbe87606f0d1df9d7b974 f38a673b4d2cf917c6834d3eb981f533系統看護学講座 専門基礎分野 解剖生理学 人体の構造と機能①より抜粋
論文紹介:YKさん(体育専門学群4年) *聴衆が理解しやすいようにアレンジされた論文紹介でした!
