SCIENCE 9 Sep 2022 Vol 377, Issue 6611
RESEARCH ARTICLE NEURODEVELOPMENT
Human TKTL1 implies greater neurogenesis in frontal neocortex of modern humans than Neanderthals (ヒトTKTL1は、ネアンデルタール人よりも現代人の前頭新皮質の神経新生が大きいことを示唆している)
Anneline Pinson 1, Lei Xing # 1, Takashi Namba # 1, Nereo Kalebic # 1, Jula Peters 1, Christina Eugster Oegema 1, Sofia Traikov 1, Katrin Reppe 1, Stephan Riesenberg 2, Tomislav Maricic 2, Razvan Derihaci 3, Pauline Wimberger 3, Svante Pääbo 2, Wieland B Huttner 1
Affiliations
1Max Planck Institute of Molecular Cell Biology and Genetics, 01307 Dresden, Germany. (マックスプランク分子細胞生物学・遺伝学研究所)
2Max Planck Institute for Evolutionary Anthropology, 04103 Leipzig, Germany.
3Technische Universität Dresden, Universitätsklinikum Carl Gustav Carus, Klinik und Poliklinik für Frauenheilkunde und Geburtshilfe, 01307 Dresden, Germany.
#contributed equally
難波 隆志 先生は、ヘルシンキ大学の研究所HiLIFEのNeuroscience CenterでPIをしている。神経化学 海外だより~独立編~ 北の国から2021
スバンテ・ペーボ 先生は、エストニア系スウェーデン人の遺伝学者で、進化遺伝学の分野を専門としている。古遺伝学の創始者の一人であり、ネアンデルタール人のゲノムの研究に大きく貢献した。1997年より、ドイツ・ライプチヒのマックス・プランク進化人類学研究所の遺伝学部門の創設責任者を務めている。また、日本の沖縄科学技術大学院大学教授でもある。2022年、「絶滅したヒト科動物のゲノムと人類の進化に関する発見」でノーベル生理学・医学賞を受賞した。
Neanderthal brain development
Neanderthal brains were similar in size to those of modern humans but differed in shape. What we cannot tell from fossils is how Neanderthal brains might have differed in function or organization of brain layers such as the neocortex. Pinson et al. have now analyzed the effect of a single amino acid change in the transketolase-like 1 (TKTL1) protein on production of basal radial glia, the workhorses that generate much of the neocortex (see the Perspective by Malgrange and Nguyen). Modern humans differ from apes and Neanderthals by this single amino acid change. When placed in organoids or overexpressed in nonhuman brains, the human variant of TKTL1 drove more generation of neuroprogenitors than did the archaic variant. The authors suggest that the modern human has more neocortex to work with than the ancient Neanderthal did.
ネアンデルタール人の脳は、現代人の脳と大きさは似ているが、形が異なっている。しかし、化石からは、ネアンデルタール人の脳の機能や大脳新皮質などの脳層がどのように異なっていたかを知ることはできない。Pinsonたちは、トランスケトラーゼ様タンパク質1(transketolase like 1; TKTL1)のアミノ酸1個の変化が、大脳新皮質の大部分を形成する主力細胞である基底放射状グリアの産生に及ぼす影響を解析した。現代人は、このたった一つのアミノ酸の変化により、類人猿やネアンデルタール人と異なっている。オルガノイドに導入したり、ヒト以外の霊長類の脳で過剰発現させると、TKTL1のヒト変異体は、古代の変異体よりも神経前駆細胞の発生を促進した。著者らは、現代人は古代のネアンデルタール人よりも多くの新皮質をもっていることを示唆している。
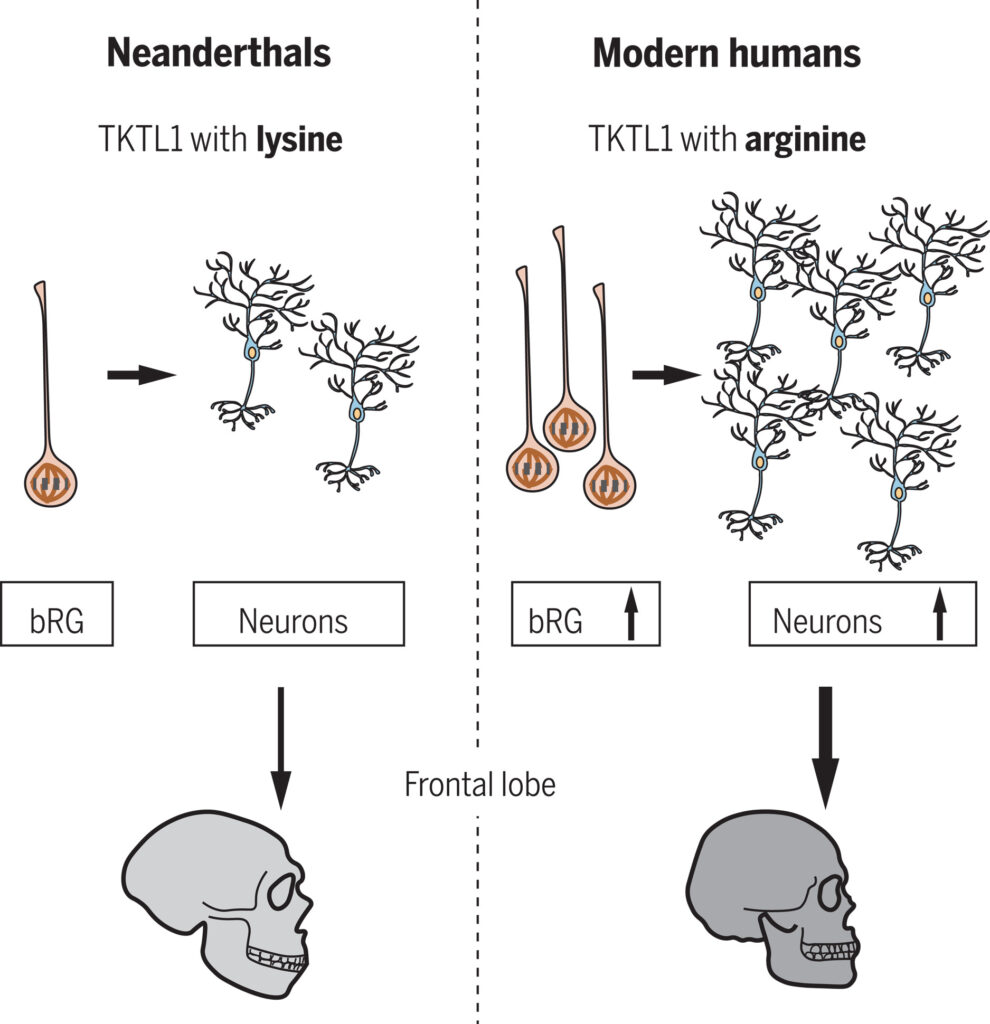
The single lysine-to-arginine substitution in modern human TKTL1 leads to greater bRG numbers than in Neanderthals. These bRG in turn generate more neocortical neurons in modern humans. Because TKTL1 expression in fetal human neocortex is particularly high in the developing frontal lobe, these findings imply that the frontal lobe of modern humans contains more neurons than that of Neanderthals. https://www.science.org/doi/10.1126/science.abl6422
TKTL1とヒト大脳皮質の神経新生 現代人のTKTL1では、リジンからアルギニンへの単一置換によって、bRG (basal radial glia; 基底放射状グリア)*の数がネアンデルタール人よりも多くなっている。これらのbRGは、現代人においてより多くの新皮質のニューロンを生成する。ヒト胎児の新皮質におけるTKTL1の発現は、発達中の前頭葉で特に高いので、これらの知見は、現代人の前頭葉がネアンデルタール人の前頭葉よりも多くのニューロンを含んでいることを示唆している。
*outer radial glia(oRG)はその名のとおり,VZよりも外層のSVZに存在する,放射状に長い突起を持った別のタイプの神経前駆細胞である.basal radial glia(bRG)とも呼ばれるこの細胞は、特にヒト,サルやフェレットなど脳回を有し複雑な大脳組織構造を持つ生物種の発生期の脳には豊富に存在し,厚い増殖帯を形成している。(川口, 2020)
oRGStructured Abstract
INTRODUCTION
The evolutionary expansion of the neocortex and the concomitant increase in neuron production are considered to be a basis for the increase in cognitive abilities that occurred during human evolution. Endocast analyses reveal that the endocranial volume of modern humans and Neanderthals was similar, suggesting similar brain and neocortex size. But whether similar neocortex size implies similar neocortical neuron production remains unclear.
RATIONALE
Transketolase-like 1 (TKTL1) is a gene from the transketolase family that in fetal human neocortex is preferentially expressed in the two classes of neuroprogenitors, the apical progenitors in the ventricular zone and the basal progenitors in the subventricular zone. The latter class of neuroprogenitors comprises two major types, the basal intermediate progenitors (bIPs) and the basal radial glia (bRG, also called outer radial glia). bRG exhibit cellular processes that promote their ability to self-amplify, and are the neuroprogenitor type considered to be a driver of the increase in cortical neuron production, which is a hallmark of the evolution of the human neocortex. Reflecting their cell polarity, bRG undergo repeated asymmetric divisions that self-renew the bRG and generate one neuron each. Thereby, bRG generate more neurons over time than the other type of neuron-generating basal neuroprogenitors, the process-lacking bIPs whose neurogenic divisions are symmetric self-consuming. TKTL1 is one of the few proteins with a single amino acid substitution found in essentially all present-day humans but absent from extinct archaic humans, the Neanderthals and Denisovans, and other primates. This human-specific amino acid substitution in TKTL1 is a lysine in apes and archaic humans but an arginine in modern humans. We therefore investigated (i) whether TKTL1 has a role in neocortex development and affects neuroprogenitor numbers and (ii) whether both archaic TKTL1 (aTKTL1) and modern human TKTL1 (hTKTL1) exert similar effects on neuroprogenitors during neocortex development.
RESULTS
When expressed in mouse embryo neocortex, which lacks TKTL1 expression, hTKTL1 increased the abundance of bRG without affecting that of bIPs and that of apical progenitors. The effect of TKTL1 on bRG abundance was limited to hTKTL1; aTKTL1, which differs only by one amino acid, was unable to increase bRG abundance. The greater bRG abundance upon hTKTL1 expression resulted in an increase in cortical neuron production over time, specifically of the late-born upper-layer neurons rather than of the early-born deep-layer neurons. In the folded (gyrencephalic) developing ferret neocortex, hTKTL1 expression increased not only bRG abundance but also the proportion of bRG with multiple processes, a hallmark of bRG that can self-amplify. As a consequence of this effect, gyrus size increased.
In fetal human neocortex, hTKTL1 was essential to maintain the full number of bRG, as CRISPR-Cas9–mediated hTKTL1 knockout in fetal human neocortical tissue reduced this number. To further demonstrate the relevance of this effect, we converted hTKTL1 to the Neanderthal variant aTKTL1 in human embryonic stem cells and generated minibrain structures called cerebral organoids. The aTKTL1-expressing organoids contained fewer bRG and neurons, hence the human-specific lysine-to-arginine substitution in hTKTL1 is essential for maintaining the full number of bRG and neurons in this human brain model. In fetal human neocortex, hTKTL1 expression in neuroprogenitors increased during the course of neurogenesis and was particularly high in the developing frontal lobe as compared to the developing occipital lobe.
As to its mechanism of action, hTKTL1 increased bRG abundance via two metabolic pathways, the pentose phosphate pathway (PPP) followed by fatty acid synthesis. Inhibition of the PPP or of fatty acid synthesis, using a variety of specific inhibitors, completely suppressed the hTKTL1-induced increase in bRG abundance in embryonic mouse neocortex and reduced bRG numbers in fetal human neocortical tissue. This metabolic action of hTKTL1, but not aTKTL1, in bRG resulted in an increase in the concentration of acetyl–coenzyme A, the critical metabolite for fatty acid synthesis. Our data suggest that hTKTL1, but not aTKTL1, promotes the synthesis of membrane lipids containing a certain type of fatty acid that are required for the outgrowth of bRG processes and hence for the increase in bRG abundance.
CONCLUSION
In light of our finding that TKTL1 expression in fetal human neocortex is particularly high in the developing frontal lobe, our study implies that because of the single amino acid–based activity of hTKTL1, neocortical neurogenesis in modern humans was and is greater than it was in Neanderthals, in particular in the frontal lobe.
Structured Abstract
〇はじめに
新皮質の進化的拡大とそれに伴うニューロン産生量の増加は、ヒトの進化過程で生じた認知能力の向上の基礎となると考えられている。頭蓋のエンドキャストを用いた解析の結果、現代人とネアンデルタール人の頭蓋内容積はほぼ同じであり、脳と新皮質の大きさが似ていることが示唆されている。しかし、新皮質の大きさが似ていることが、新皮質のニューロンの生産量が似ていることを意味するのかどうかについては、まだ不明である。
〇解説
トランスケトラーゼ様1(TKTL1)はトランスケトラーゼファミリーに属する遺伝子で、ヒト胎児新皮質では、脳室帯の頂端前駆細胞(the apical progenitors)と脳室下帯の底端前駆細胞(The basal progenitors)の2種類の神経前駆細胞に優先的に発現していることが分かっている。後者の神経前駆細胞は、基底部中間前駆細胞(bIPs)と基底部放射状グリア(bRG、外側放射状グリアとも呼ばれる)の2種類からなる。bRGは自己増殖能力を促進する細胞プロセスを持ち、ヒト新皮質の進化の特徴である皮質ニューロン生産の増加を促進すると考えられる神経前駆細胞のタイプである。bRGは、その細胞極性を反映して、非対称分裂を繰り返し、自己複製を行い、それぞれ1個のニューロンを生成する。そのため、bRGは、他のニューロン生成基底細胞であるbIPs(ニューロン生成分裂が対称的な自己消費型)よりも多くのニューロンを生成することができる。TKTL1は、基本的にすべての現生人類に見られるが、絶滅した古人類、ネアンデルタール人やデニソワ人、その他の霊長類には見られない、1つのアミノ酸置換を持つ数少ないタンパク質の1つである。TKTL1におけるこのヒト特異的なアミノ酸置換は、類人猿と古人類ではリジンであるが、現代人ではアルギニンである。そこで、(i)TKTL1が新皮質発生に関与し、神経前駆細胞の数に影響を与えるかどうか、(ii)古代のTKTL1(aTKTL1)と現代人のTKTL1(hTKTL1)が新皮質の発生過程で神経前駆細胞に同様の影響を与えるかどうかを検討した。
〇結果
TKTL1が発現していないマウス胚の新皮質で発現させると、hTKTL1はbIPや頂膜前駆細胞の発現量に影響を与えることなく、bRGの発現量を増加させた。bRGの存在量に対するTKTL1の効果はhTKTL1に限られ、アミノ酸が1つしか違わないaTKTL1はbRGの存在量を増加させることができなかった。hTKTL1の発現によりbRGの存在量が増加すると、皮質ニューロンの産生量が経時的に増加し、特に早期に生まれた深層ニューロンではなく、後期に生まれた上層ニューロンの産生量が増加することが明らかになった。フェレットの大脳新皮質では、hTKTL1を発現させると、bRGの量が増加するだけでなく、自己増幅できるbRGの特徴である複数の突起を持つbRGの割合が増加した。この効果の結果として、回サイズが増加した。
ヒト胎児新皮質では、CRISPR-Cas9を介したhTKTL1ノックアウトにより、bRGの数が減少したため、hTKTL1はbRGの数を維持するために不可欠であった。この効果の関連性をさらに示すために、ヒト胚性幹細胞でhTKTL1をネアンデルタール人の変異型であるaTKTL1に変換し、大脳オルガノイドと呼ばれるミニ脳構造体を作製した。aTKTL1を発現するオルガノイドはbRGとニューロンの数が少なかった。したがって、hTKTL1のリジンからアルギニンへの置換は、このヒト脳モデルにおいてbRGとニューロンの数を十分に維持するために必須であることが判明した。ヒト胎児大脳新皮質では、神経前駆細胞におけるhTKTL1の発現が神経発生の過程で増加し、特に後頭葉に比べ発達中の前頭葉で高発現していることが確認された。
hTKTL1の作用機序としては、ペントースリン酸経路(PPP)、脂肪酸合成の2つの代謝経路を経由してbRG量を増加させることがわかった。様々な特異的阻害剤を用いてPPPまたは脂肪酸合成を阻害すると、胚性マウス新皮質におけるhTKTL1によるbRG量の増加は完全に抑制され、ヒト胎児新皮質組織ではbRG数が減少した。aTKTL1ではなくhTKTL1のbRGにおけるこの代謝作用は、脂肪酸合成に重要な代謝物であるアセチル・コエンザイムAの濃度を増加させる結果となった。このデータは、aTKTL1ではなくhTKTL1が、bRGプロセスの伸長、ひいてはbRGの存在量の増加に必要な、ある種の脂肪酸を含む膜脂質の合成を促進することを示唆する。
〇結論
ヒト胎児新皮質におけるTKTL1の発現は、発達中の前頭葉において特に高いという我々の発見に照らして、我々の研究は、hTKTL1の単一アミノ酸に基づく活性のために、現代人の新皮質神経新生は、特に前頭葉において、ネアンデルタール人のそれよりも大きかったし、現在も大きいことを示唆するものであった。
〇Scaling brain neurogenesis across evolution
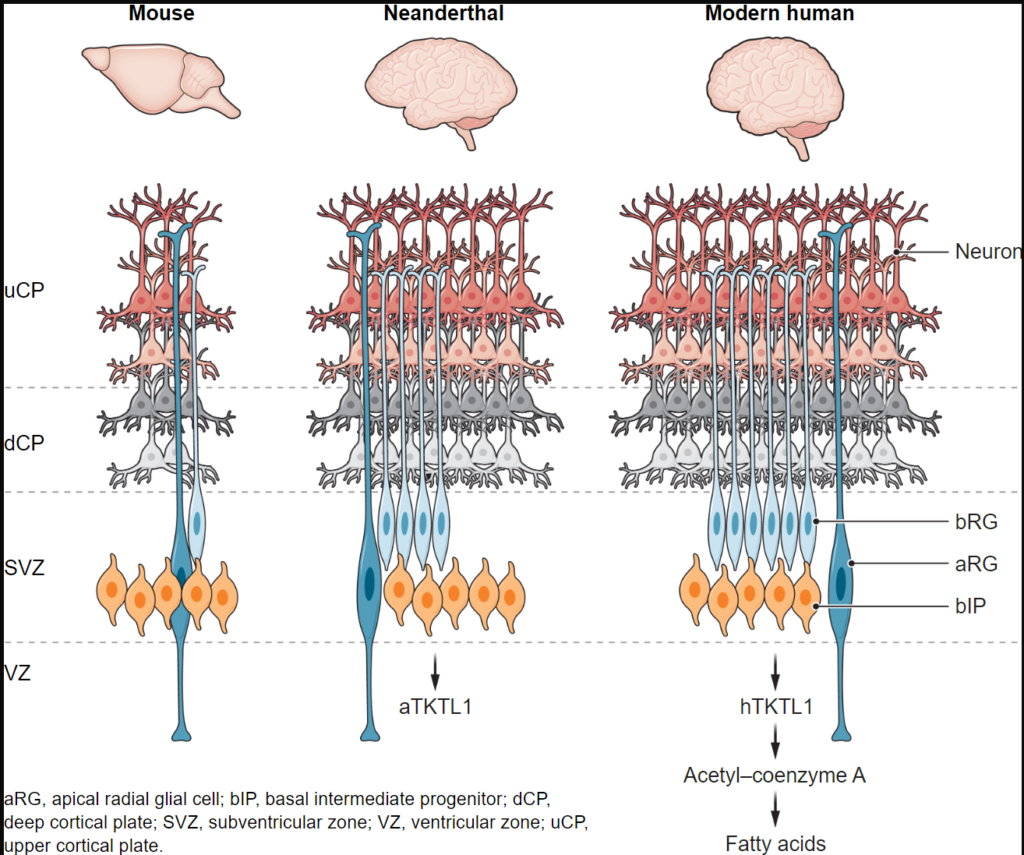
トランスケトラーゼ様タンパク質1(TKTL1)のLysからArgへの単一置換は、現代人(hTKTL1)ではネアンデルタール人(aTKTL1)と比較して、基底放射状グリア細胞(bRG)の代謝を変化させることが明らかになった。hTKTL1変異体の発現により、bRGの数が増加し、皮質上層の神経細胞集団が増加する。このことは、現代人の認知能力の向上に寄与していると考えられる。
参考文献
〇現生人類の脳に優位性を与えた可能性のある遺伝子変異を発見 Nature ダイジェスト Vol. 19 No. 12 | doi : 10.1038/ndigest.2022.221210
https://www3.nhk.or.jp/news/html/20221215/k10013921441000.html

Journal Club (December 9, 2022)
“現生人類の脳に優位性を与えた可能性のある遺伝子変異とは?” への1件のフィードバック