Neuron. 2023 Dec 11:S0896-6273(23)00895-4. doi: 10.1016/j.neuron.2023.11.021
Available online 14 December 2023
Layer 6b controls brain state via apical dendrites and the higher-order thalamocortical system (第6b層は頂端樹状突起と高次視床皮質系を介して脳の状態を制御する)
Timothy Adam Zolnik 1, Anna Bronec 2, Annemarie Ross 2, Marcel Staab 2, Robert N S Sachdev 2, Zoltán Molnár 3, Britta Johanna Eickholt 4, Matthew Evan Larkum 5
Affiliations
- 1Department of Biochemistry, Charité Universitätsmedizin Berlin, Berlin 10117, Germany; Department of Biology, Humboldt Universität zu Berlin, Berlin 10117, Germany. Electronic address: timothy.zolnik@charite.de.
- 2Department of Biology, Humboldt Universität zu Berlin, Berlin 10117, Germany.
- 3Department of Biochemistry, Charité Universitätsmedizin Berlin, Berlin 10117, Germany; Department of Physiology, Anatomy, and Genetics, University of Oxford, Parks Road, Sherrington Building, Oxford OX1 3PT, UK.
- 4Department of Biochemistry, Charité Universitätsmedizin Berlin, Berlin 10117, Germany.
- 5Department of Biology, Humboldt Universität zu Berlin, Berlin 10117, Germany. Electronic address: matthew.larkum@hu-berlin.de.
Abstract
The deepest layer of the cortex (layer 6b [L6b]) contains relatively few neurons, but it is the only cortical layer responsive to the potent wake-promoting neuropeptide orexin/hypocretin. Can these few neurons significantly influence brain state? Here, we show that L6b-photoactivation causes a surprisingly robust enhancement of attention-associated high-gamma oscillations and population spiking while abolishing slow waves in sleep-deprived mice. To explain this powerful impact on brain state, we investigated L6b’s synaptic output using optogenetics, electrophysiology, and monoCaTChR ex vivo. We found powerful output in the higher-order thalamus and apical dendrites of L5 pyramidal neurons, via L1a and L5a, as well as in superior colliculus and L6 interneurons. L6b subpopulations with distinct morphologies and short- and long-term plasticities project to these diverse targets. The L1a-targeting subpopulation triggered powerful NMDA-receptor-dependent spikes that elicited burst firing in L5. We conclude that orexin/hypocretin-activated cortical neurons form a multifaceted, fine-tuned circuit for the sustained control of the higher-order thalamocortical system.
大脳皮質の最深層(第6b層[L6b])は比較的少数のニューロンを含むが、強力な覚醒促進神経ペプチドであるオレキシン/ヒポクレチンに反応する唯一の皮質層である。この数少ないニューロンが、脳の状態に大きな影響を与えることができるのだろうか?ここでわれわれは、睡眠不足のマウスにおいて、L6bの光活性化が、注意に関連する高ガンマ振動と集団スパイクを驚くほど強力に増強する一方で、徐波を消失させることを示す。脳の状態に対するこの強力な影響を説明するために、我々はオプトジェネティクス、電気生理学、monoCaTChR ex vivoを用いてL6bのシナプス出力を調べた。その結果、L1aとL5aを経由して、高次視床とL5錐体ニューロンの先端樹状突起に、また上丘とL6介在ニューロンに強力な出力があることがわかった。L6b亜集団は、異なる形態と短期および長期の可塑性をもって、これらの多様な標的へ投射する。L1aを標的とする亜集団は、L5でバースト発火を誘発する強力なNMDA受容体依存性スパイクを引き起こした。オレキシン/ヒポクレチン活性化皮質ニューロンは、高次視床皮質系を持続的に制御するための、多面的で微調整された回路を形成していると結論した。
Keywords: apical dendrite; arousal; attention; corticothalamic projections; gamma oscillations; layer 6b; narcolepsy; orexin/hypocretin; subplate; thalamus.
Introduction
第6b層(L6b)は最も深い皮質ニューロンを有し、脳の覚醒システム、注意、脳の状態を制御する重要な神経ペプチドであるオレキシン1(ヒポクレチン2,3としても知られる)に反応する唯一の皮質層としてユニークである。視床下部のオレキシン作動性ニューロンの活性化は覚醒を強力に促進し、一方、これらのニューロンの抑制は深い睡眠を促進する9,10。注目すべきことに、オレキシンはドーパミン、アセチルコリン、ノルアドレナリンを放出する脳内の他の覚醒促進系の主要な調節因子である11,12。
17,18特に、これらのニューロンが脳の状態において果たす役割については未知のままであり、L6bがどのニューロンやネットワークを標的としているのかもわかっていない。L6bの神経支配は、成熟した脳では実質的に視床からの入力を受けず、代わりに強力な皮質内フィードバックによって駆動されるという点でユニークである19。
最近の研究では、L6bニューロンは高次視床(HoT)23に投射し、マウスのHoTにおけるウィスカー誘発活動を増強することが示されている24。解剖学的な観点からすると、L6bはHoT25が標的とする皮質層と同様の皮質層を標的としているように見えるにもかかわらず、視床自体からの入力を実質的に受けていないため、このことは特に興味深い。このことから、L6bはHoTの機能と重複しながらも、もっぱら皮質内フィードバックによって駆動されているという仮説が導かれる。
L6bは認知処理においても重要な役割を果たしている可能性がある。例えば、嗅内皮質のL6bニューロンは海馬に投射し、空間コーディングと記憶に関与している26。また、L6bと不安との行動学的関連や、睡眠紡錘におけるL6bの役割も報告されている27,28。
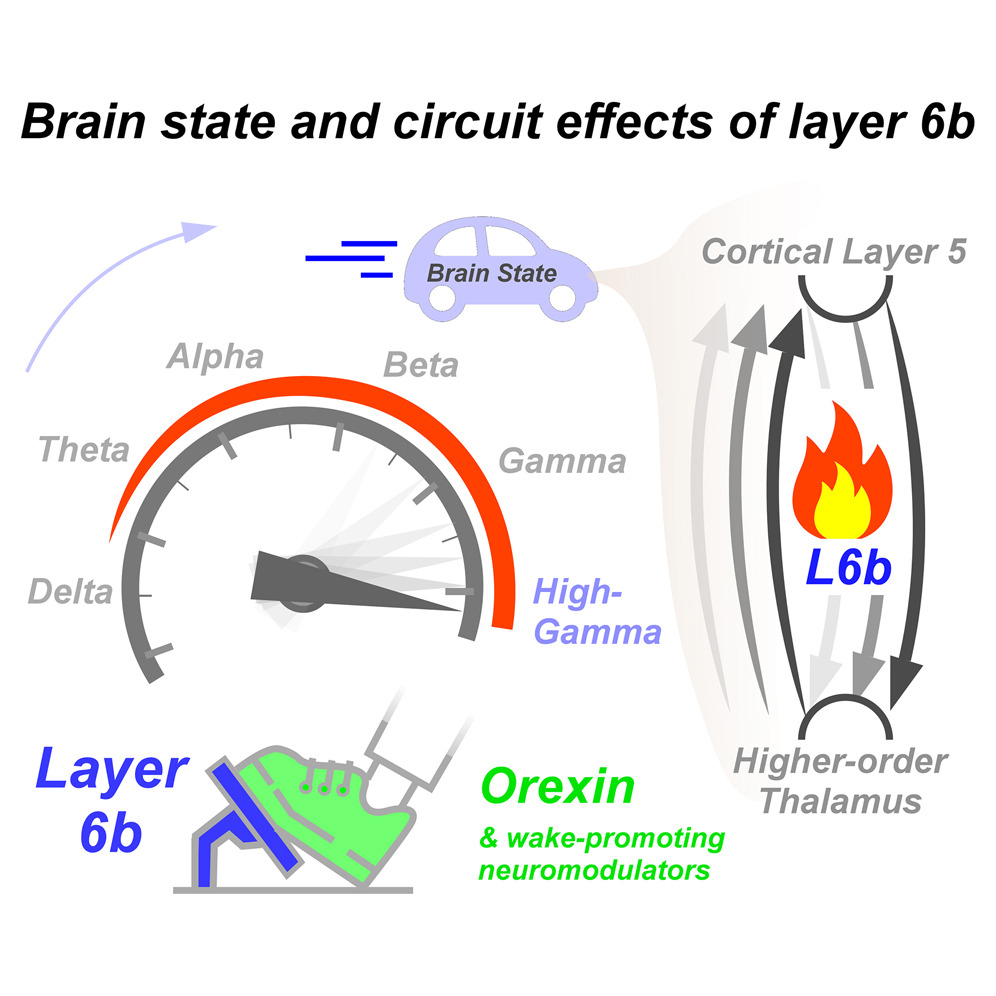
本研究は、L6bの機能的出力と脳状態への影響に焦点を当てたZolnikらによる研究19のフォローアップである。我々の発見は、L6bが皮質回路を形成し、L5とHoTの間の皮質-視床-皮質(CTC)ループを選択的に支配し、強力に興奮させることを示している。L6bの光活性化は、その個体数が比較的少ないにもかかわらず35、大脳皮質の持続的なスパイキングと覚醒様振動を数倍に増加させ、徐波を消失させ、高ガンマを増加させる。L6bは、視床皮質機能の理解における重要な「ミッシングリンク」である可能性があり、今回の発見は、脳の状態制御、認知、神経機能障害に関する新たな知見を提供するものである。
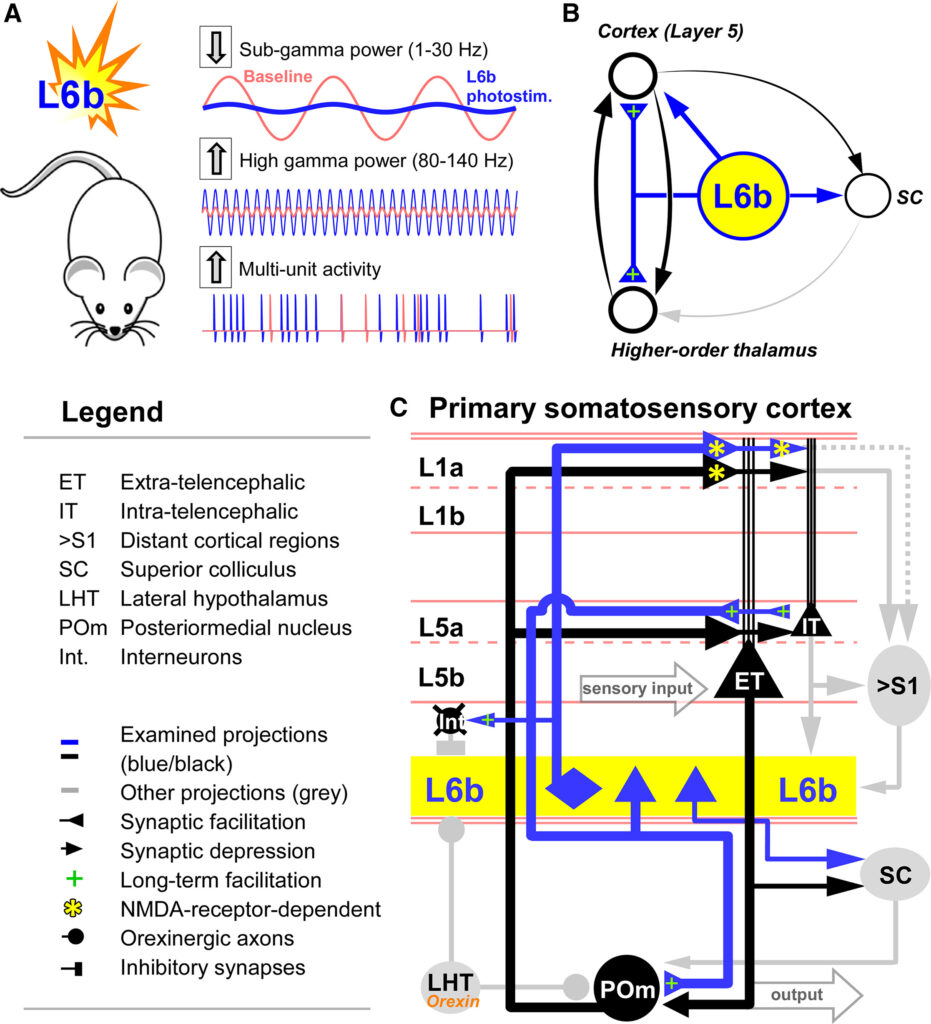
(A)睡眠不足マウスでオレキシン感受性L6b-Drd1ニューロンを光活性化すると、低速振動が消失し、高速振動とマルチユニットスパイクが亢進する。
(B)L6b出力の簡略回路図。
(C)一次体性感覚系におけるL6b投射(青線)の詳細な構造と生理学。太い黒線は高次皮質-視床-皮質ループの回路を示す。
Discussion
この研究は、L6bへの入力を調べた我々の以前の研究19に続くもので、L6bの機能的出力と脳の状態への影響を明らかにするものである。どちらの研究も、L6bニューロンの亜集団にCre-リコンビナーゼを発現させるDrd1a-Cre株とCtgf-dgCre株を利用した19,23,26。
L6bの機能的出力を調べるには、L6bを構成するものの作業定義が必要である。残念なことに、大脳皮質のほとんどの層と同様、マウスにおけるL6aとL6bの境界は明確でない18。しかし、げっ歯類の研究では通常、L6bはL6の下部約30%に含まれると考えられている。この定義によれば、Drd1-Creニューロンの3/4以上とCtgf-Creニューロンのすべてが白質の100μm以内にあり、残りはL6a深部の錐体ニューロンのまばらな集団からなる65。L6b-Drd1ニューロンおよびL6a-Drd1下位ニューロンを、L6a錐体ニューロンとは異なる同種のグループと考えた理由は2つある66。
L6b投射のシナプス生理を調べるために、我々はチャネルロドプシン支援回路マッピング技術50とL6bトランスジェニック系統を併用し、L6b出力の機能解剖を初めて包括的に調べることができた。これらのアプローチでは、L6bのいくつかの投射の全体的な強度と有病率が過小評価されている可能性が高い。例えば、トランスジェニック系統はL6bニューロンのサブセットのみを標識しており、チャネルロドプシンを用いた刺激によるシナプス前活動の発生は、同期したシナプス出力を生み出す。一方、これらのアプローチは、L6bの出力を単離するのにも有効であった。ペア記録や電気刺激といった他のアプローチでは、このような出力はかなり限られてしまう。
L6bオレキシン感受性ニューロンは高次視床皮質系を制御する
L5-ET錐体型ニューロンとHoTニューロンはそれぞれ、知覚、睡眠覚醒調節、注意、意識に関連する高次CTCループのノード68,69を構成している4,5,6,68,70,71,72。
本研究では、L6bが高次CTCループを特異的に標的としていることがわかった(図2、3、4、5、6)。L6bのCTCループへの投射は位相幾何学的であり(図6)、L6bの特定のセクターが特定のCTCループと会合していることが示唆された。興味深いことに、CTCループからL6bへの直接的な出力がないことから19、L6bはループからの直接的なフィードバックを欠いた、視床皮質系の一方向的な活性化因子として機能していることが示唆された。このことは、L6b-Drd1ニューロンがオレキシンに対して非常に感受性が高く(図1Aおよび1B)、2つの主要なサブ回路を持ち、それぞれがユニークなシナプス出力を発現していることを考えると、特に興味深い。
最初の主要なL6bサブ回路は、多様な形状の非錐体型ニューロン群である(図2E2)。これらのニューロンは、並行投射がL1aで終端しているため、特に珍しい(図2C2)。さらに、これらの投射は完全にNMDA受容体に依存しており(図4B、S4C、S4D)、L5-ETタフト樹状突起においてNMDA受容体依存性の樹状突起スパイク73を引き起こし、これがソーマにおけるナトリウム活動電位のバーストにつながる(図4B)。
L1aを投射するL6b-Drd1ニューロンと同様に、L6b-CtgfニューロンもL1のタフト樹状突起のNMDA受容体を介して情報伝達を行う(図S4D)。多くのL6b-Drd1ニューロンはCtgfを免疫標識しており、19,23はL1a投射Drd1-CreニューロンはCtgfニューロンである可能性を示唆している。L1a投射L6bニューロンはNMDA受容体を介してCTCループの活動を形成し、皮質出力と記憶に重要な役割を果たしている可能性がある。
第2の主要なL6bサブ回路は、L5aとHoTに投射する錐体ニューロン群である(図2C1と2E1。) L5aでは、これらのニューロンはL5-ETニューロンの斜め樹状突起とL5-ITニューロンの基底樹状突起を標的としているようである(図S4B)。この部分回路からの出力は非常に可塑的で、視床とL5の両方で短期および長期の促進を表現する(図4F-4H、5D、5F)。これらの特性は、L5錐体ニューロンへのシナプス入力としては異例である76,77,78。したがって、この集団はCTCループの両ノードを標的としており、持続的興奮に理想的なシナプス特性を発現している。
L6bオレキシン感受性ニューロンは脳の状態を制御する
オレキシン感受性L6bニューロンの影響力は謎のままである。一方では、強力な覚醒促進神経ペプチドであるオレキシンの影響を受けるが、他方では、皮質ニューロンの中では比較的小さな集団である。我々は、L6bニューロンが、その数の少なさにもかかわらず、皮質の状態に驚くほど強力な影響を与えることを発見した。
まず、L6b-Drd1ニューロンを光刺激すると、サブガンマパワー(1-30 Hz)の劇的な抑制と、ハイガンマパワー(80-140 Hz)の深く特異的な増加の両方が起こり、ガンマパワー(30-80 Hz)には比較的影響が少ないことがわかった(図1C-1F)。L6bの活性化はデルタとシータの振動を最も強く抑制した(抑制のピークは約5Hz)。光刺激に伴うひげの動きも観察されたが(データは示さず)、徐波睡眠様振動中のL6bの活性化が、一般的な覚醒や逆説的な覚醒様睡眠を引き起こすかどうかを検証するには、さらなる調査が必要である。注目すべきことに、マウスは光刺激を止めた直後から急速に睡眠または睡眠様状態に戻った。光刺激が止まると、緩徐振動のパワーはほぼ直ちにベースラインに戻ったからである(図1D、1E、S1C、S1D)。
L6bによる緩徐振動の妨害は、高次の視床皮質系を強力に直接興奮させることに起因している可能性が高い。このことは、いくつかの観察結果から支持される。睡眠遮断後の回復睡眠など、深い睡眠中の緩徐振動は、L5錐体ニューロンや視床から直接生じると考えられており79,80,81,82,83、HoTの活性化や損傷は緩徐振動の崩壊を引き起こす。
L6bによる高速振動の強力な増強には、L6における局所的な興奮抑制ループが関与している可能性がある。また、L6bと先端樹状突起のHoT神経との間の動的相互作用も、高速振動の別の発生源になるかもしれない89,90。
次に、L6bの光刺激によって、スパイクがダイナミックに数倍増加することがわかった。特に注目すべきは、光刺激中にL5とL2/3のスパイキングが着実に増加したことである(図1G、S1E-S1G)。L6bが活性化している間(少なくとも3秒まで)、大脳皮質ではスパイクが増加したままであった。このような反応は、POm/L5aを投射するL6b-Drd1亜集団からCTCループへの強力な促進作用の結果であると考えられる。
CTCループにおける持続的な活動91は、おそらく活動を減衰させうるメカニズム(急速に減衰するシナプス(図4E、4F、5B、5D、S4G)45,92,93,94(ただし、Miller-Hansen and Sherman62とViaene et al.95を参照)に対して働かなければならない。 実際、L6bの光刺激停止後、皮質のスパイクはすぐに低下し(図1H、イベント3)、ベースラインレベルを下回ったが、これはおそらくこれらの抑制機構が一時的に継続したためであろう。したがって、L6bは場合によってはCTCループの活性を維持するのに重要であるか、あるいは要求が高いときにはCTCループを「オーバードライブ」させる可能性さえある。
第3に、S1におけるL6bの光活性化は、非局所的に伝播することがわかった(図1I、1J、S1J、S1K)。特に前頭皮質では、サブガンマパワーが抑制され、ガンマパワーとハイガンマパワーとスパイクが増加した(図1J、S1J、S1K)。L6bは長距離投射ニューロン、すなわちL5-ETとHoTニューロンを直接標的としており、これがこれらの非局所的効果の重要な理由と考えられる(L6bからの長距離軸索の直接活性化も寄与している可能性がある29,101)。
この点で、L6bは高次の視床皮質系への影響を介して、脳内の長距離コミュニケーションを支えるのに理想的なのかもしれない。95,102。HoT(およびL5-ET)の興奮性を高めることで、L6bはこの間接的な経路を効果的に開くことができる。関連して、L6bによって興奮したL5-ITニューロン(図4D、4F-4H)は、皮質-皮質間の直接伝達を促進する可能性がある。さらに、L5-ITニューロンはL6bへの強力な長距離入力を提供することから、L6b-L6bの長距離相互作用を仲介する可能性もある19。これらを総合すると、L6bは長距離伝達のトップダウン伝導体として機能し、遠く離れた皮質領域全体の活動を高め、調整するのかもしれない。
L6b、神経機能障害、認知機能
L6bは、脳の上行性覚醒系を興奮させ、脳の状態を安定化させる覚醒促進神経ペプチドであるオレキシン1に対して強固に反応するという点で、皮質層の中でもユニークである12,103,104。興味深いことに、L6bは、すべてではないにせよ、他のほとんどの覚醒促進神経調節物質13,14,15によって活性化される。したがって、L6bは上行性覚醒系の頂点である。
ナルコレプシーは、脳内のオレキシンの喪失8によって起こるため、L6bに特に大きな影響を与えると考えられる。L6bの活性を高め、維持するオレキシンが得られなくなると、高次のCTCループの活性が低下または不安定化し、脳の状態、認知、覚醒に影響を及ぼす可能性が高い。
高次CTCループを一方向に制御するL6bは、認知において特別な役割を担っているのかもしれない。例えば、L6bによって強く増強される高ガンマ振動(図1D-1F)は、ヒトやげっ歯類において、注意の集中に関連している105。さらにL6bは、注意を促すコリン作動性入力108,109によって活性化され、感覚知覚において重要な役割を果たすL5錐体ニューロンの頂端樹状突起(図4)を興奮させた59,110。111。対照的に、L6bもまたコリン作動性入力に よって強く興奮する15,16。したがってL6bは、知覚と注意に関連する2つの主要なネットワーク、CTCループの2つのノードであるHoTとL5-ETニューロンを特異的に興奮させることになる6,112。
CTCループの活動は、覚醒を促進するニューロモジュレーターによって直接的に支えられていると考えられるが、これらのメカニズムは一般に空間的・時間的に非特異的である113。一方、L6bは密なトポグラフィー的結合を形成し、高速イオノトロピック受容体を駆動することで、特定のループを迅速に制御する。
推測の域を出ないが、L6bは次のような方法で感覚刺激に対する注意をサポートする可能性がある: L5-ETニューロンは、視床の一次ニューロンからリレー された感覚入力を介して、感覚情報がCTCループに入る 入り口になる114。非錐体型L6bサブ回路は、タフト樹状突起のNMDA受容体活性化を通じて、文脈理解のために、活性化されたCTCループに記憶の痕跡を埋め込む。
https://www.sciencedirect.com/science/article/pii/S2211124720302059
Cell Reports Volume 30, Issue 10, 10 March 2020, Pages 3492-3505.e5
Layer 6b Is Driven by Intracortical Long-Range Projection Neurons (第6b層は皮質内の長距離投射ニューロンによって駆動される)
自閉症スペクトラム障害におけるsubplateニューロン(6b層ニューロン)の過剰
ニューロン間の長距離結合の障害は、脳のコミュニケーションに変化をもたらす。自閉症スペクトラム障害(ASD)では、脳の結合性に変化が生じることが報告されているが、その根底にある微小解剖学的メカニズムはよくわかっていない。
ひとつの可能性として、結合性の変化は、胎児期に神経細胞の結合を確立するのに役立つ脳の皮質下板の変化と関連している可能性があることが、新しい研究によって示唆された1。
胎児期の発達において、皮質サブプレートは、長距離皮質結合の形成と安定化に重要な役割を果たす数多くの神経細胞タイプを生み出す。大人になると、亜板ニューロンの大部分は死滅するが、一部は維持される。
過去に行われた死後脳組織の研究では、統合失調症やけいれん発作の患者では亜板ニューロンが増加していることが示されており2,3、これらの状態では、脳が非典型的に早期発達状態に維持されている可能性が示唆されている。カリフォルニア大学デービス校のThomas Avino教授とネバダ大学リノ校のJeffrey Hutsler教授の研究により、ASDでは神経定型者に比べて亜板ニューロンが増加していることが証明された。
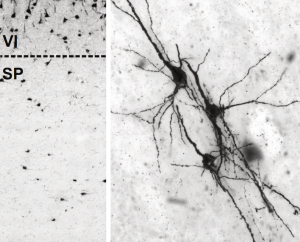
左:ASD症例のニューロンプロファイル。破線は大脳皮質(VI層)と白質/サブプレート領域(SP)のおおよその境界を示している。予想外に多くの神経細胞プロファイルが亜板領域に存在する。右: ASD症例の白質ニューロン。この画像では、多極性/多形性のサブプレートニューロンタイプがいくつか示されている。
この研究を実施するために、研究者らは、自閉症組織プログラム(現Autism BrainNet)、ハーバード大学脳組織リソースセンター、メリーランド大学脳組織バンク、Autism BrainNet、マイアミ大学脳基金バンクに寄贈された、ASD患者11人と神経健常者12人の脳組織の神経細胞染色と形態学的特性解析を行った。
以前の研究では、灰白質と白質間の明確な分離の欠如を示すことで、ASDにおける亜板崩壊の可能性を示すいくつかの証拠が示されていた4。今回の研究では、ASDと神経健常者の脳において、亜板のいくつかの特定領域内の神経細胞タイプをより系統的に比較した。
その結果、亜板内のニューロン数が全体的に増加していることと、亜板細胞の種類にASDの有無による違いがあることが示された。亜板内の特定の細胞タイプの比率は、脳の発達の過程で変化することが知られているため、この定量的な比較は、自閉症では亜板が発達の早い段階で維持されていることを示す証拠となる。
本研究は、自閉症患者における脳の亜板領域の変化を初めて示した。サブプレートは脳のさまざまな部位間の接続の確立に関与していることから、研究者らは、この部位の変化がASDの発達過程における脳の配線の変化に関与している可能性があると仮定している。しかし、今回の研究では、組織の利用可能性に制約があったため、脳の一部の領域の評価にとどまった。
この現象が広範にみられるのか、あるいはASDの脳の特定の領域が脳板下障害の影響を受けやすいのか受けにくいのかを理解するためには、より多くの死後脳へのアクセスを必要とする、さらなる皮質領域の特性解析が必要である。さらなるデータによってこれらの結果が確認されれば、亜板組織の崩壊につながる因子がASDの原因を理解する上で重要であることが証明されるかもしれない。

“Journal Club (February 18, 2024)” への2件のフィードバック