Cell Volume 155, Issue 5, 21 November 2013, Pages 997-1007
Coexpression Networks Implicate Human Midfetal Deep Cortical Projection Neurons in the Pathogenesis of Autism (自閉症には、ヒト胚発生期中期の皮質深層投射ニューロンで共発現している遺伝子ネットワークが関与している)
A. Jeremy Willsey 12, Stephan J. Sanders 12, Mingfeng Li 34, Shan Dong 15, Andrew T. Tebbenkamp 34, Rebecca A. Muhle 146, Steven K. Reilly 1, Leon Lin 7, Sofia Fertuzinhos 34, Jeremy A. Miller 8, Michael T. Murtha 9, Candace Bichsel 34, Wei Niu 146, Justin Cotney 1, A. Gulhan Ercan-Sencicek 69, Jake Gockley 1, Abha R. Gupta 610, Wenqi Han 34, Xin He 11, Ellen J. Hoffman 69…Matthew W. State 126916
1Program in Neurobehavioral Genetics, Semel Institute, David Geffen School of Medicine, University of California, Los Angeles, Los Angeles, CA 90095, USA2Interdepartmental Program in Neuroscience, University of California, Los Angeles, Los Angeles, CA 90095, USA3Department of Human Genetics, David Geffen School of Medicine, University of California, Los Angeles, Los Angeles, CA 90095, USA4Center for Autism Treatment and Research, Semel Institute, David Geffen School of Medicine, University of California, Los Angeles, Los Angeles, CA 90095, USA5Program in Neurogenetics, Department of Neurology, David Geffen School of Medicine, University of California, Los Angeles, Los Angeles, CA 90095, USA6Department of Biostatistics, University of California, Los Angeles, Los Angeles, CA 90095, USA
Highlights
- •Exome sequencing identifies a novel ASD gene, Ankyrin 2, neuronal (ANK2)
- •Data from developing human brain are used for coexpression analyses of nine ASD genes
- •ASD genes converge in midfetal frontal cortex deep projection neurons
- •Approach clarifies when, where, and in what cell type to study specific ASD mutations
ハイライト
- ハイライト
- エクソーム配列決定により、新規ASD遺伝子Ankyrin 2, neuronal (ANK2)が同定された。
- ASD遺伝子9種の共発現解析に、発達中のヒト脳のデータを使用
- ASD遺伝子は胎児中期の前頭葉皮質深部投射ニューロンで収束する
- 特定のASD変異をいつ、どこで、どの細胞タイプで研究すべきかが明らかになった。
Summary
Autism spectrum disorder (ASD) is a complex developmental syndrome of unknown etiology. Recent studies employing exome- and genome-wide sequencing have identified nine high-confidence ASD (hcASD) genes. Working from the hypothesis that ASD-associated mutations in these biologically pleiotropic genes will disrupt intersecting developmental processes to contribute to a common phenotype, we have attempted to identify time periods, brain regions, and cell types in which these genes converge. We have constructed coexpression networks based on the hcASD “seed” genes, leveraging a rich expression data set encompassing multiple human brain regions across human development and into adulthood. By assessing enrichment of an independent set of probable ASD (pASD) genes, derived from the same sequencing studies, we demonstrate a key point of convergence in midfetal layer 5/6 cortical projection neurons. This approach informs when, where, and in what cell types mutations in these specific genes may be productively studied to clarify ASD pathophysiology.
自閉症スペクトラム障害(ASD)は、原因不明の複雑な発達症候群である。エクソームおよびゲノムワイドシークエンシングを用いた最近の研究により、9つの確信度の高いASD(hcASD)遺伝子が同定された。これらの生物学的に多面的な遺伝子のASD関連変異は、交差する発達過程を破壊し、共通の表現型に寄与するという仮説に基づき、これらの遺伝子が収束する時期、脳領域、細胞型を同定することを試みた。我々は、ヒトの発生から成人に至るまで、ヒトの複数の脳領域を網羅する豊富な発現データセットを活用して、hcASDの「種」遺伝子に基づく共発現ネットワークを構築した。同じシーケンス研究から得られたASDの可能性が高い(pASD)遺伝子の独立したセットの濃縮を評価することで、胎児期の第5/6層皮質投射ニューロンにおける収束のキーポイントを実証した。このアプローチにより、ASDの病態生理を明らかにするために、いつ、どこで、どのような細胞型において、これらの特定の遺伝子の変異を研究することが有益であるかがわかる。
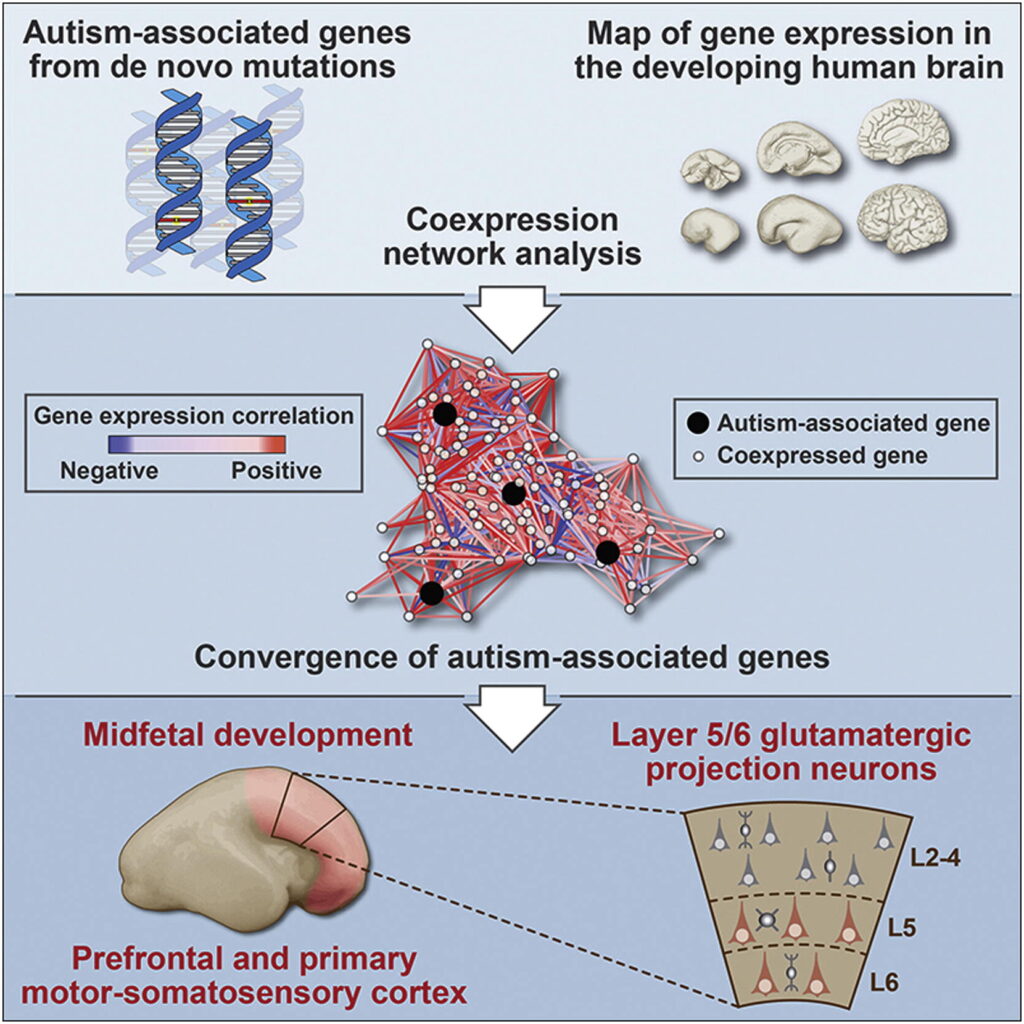
Introducion
自閉症スペクトラム障害(ASDs)は、相互的な社会的相互作用の障害によって定義され、多くの場合、言語発達の異常、反復行動や興味の制限を伴う。遺伝的にも表現型的にもかなり多様性があるため、この症候群の生物学的基盤を明らかにしようとする努力は複雑であった。しかし、現在ASDの遺伝学とゲノミクスにおいて大きな変化が起こりつつある。この症候群に寄与する共通の遺伝的変異を同定するゲノムワイドな努力はまだ再現性のある結果には至っていないが(State and Levitt, 2011)、稀なde novo変異の重要な寄与が同定された(Jamain et al、 2007)とハイスループットシークエンシング技術との組み合わせにより、近年、ASDにおいて比較的大きな生物学的効果を持つde novo機能喪失(LoF)変異が系統的に発見されるようになった(Iossifov et al.、2012、Kong et al.、2012、Neale et al.、2012、O’Roak et al.、2011、O’Roak et al.、2012a、O’Roak et al.、2012b、Sanders et al.、2012)。その結果、関連遺伝子は過去1年半の間に著しく増加し、ASD家族のさらなるコホートの塩基配列が決定されるにつれて、この数は着実に増え続けることが予測される(Buxbaum et al.) さらに、最近の進歩によりASDのゲノム構造がさらに明らかになりつつある。これまでのところ、de novo点突然変異は罹患者の約15%に寄与していると推定されているが、これらの突然変異によってもたらされる遺伝子座の不均一性の推定だけでも、すでに数百から1,000を超える遺伝子に及んでいる(He et al., 2013, Iossifov et al., 2012, Sanders et al., 2012)。
ヒトの表現型に強く関連する希少コード変異を持つ遺伝子の増加は、トランスレーショナル・ニューロサイエンスに前例のない機会をもたらしている。同時に、異常な遺伝子座の不均一性と生物学的pleiotropyの組み合わせは、ASDの病態生理を解明する上でかなりの障害となっている。その障害には、同定されたリスク変異を脳のいつ、どこで調べればよいのかがわからない中で、ある遺伝子について生産的な機能研究をデザインするという課題がある。今日までに発見された遺伝子の多くが、発達中の複数の時点で複数の生物学的過程に関与しているという事実を考えると、この問題は特に関連している。さらに、同じ遺伝子に同一の変異があっても、精神医学的・神経学的症候が大きく異なることがある(Malhotra and Sebat, 2012)。したがって、ASDにつながることが知られている疾患関連変異群の時空間的な収束を決定することは、ASDという表現型に特異的に関連する機能的障害を特定するための第一歩として、特に有用であると考えられる。
このことを念頭に置いて、我々は、ASDに関連する特定の変異群がヒトの脳の発達過程において、いつ、どの脳領域で、どの細胞型で収束するのかという重要な疑問に取り組むことにした。この問いを追求するために、我々は遺伝子共発現ネットワーク解析に「ボトムアップ」アプローチをとり、最初は、複数のde novo LoF変異を持ち、それによってASDとの関連性を示す最も強い証拠を示す9つの「シード」遺伝子だけに焦点を当てた。これらの9つの “high-confidence “ASD(hcASD)遺伝子に焦点を当てることで、関連性のエビデンスが大きく異なる入力遺伝子に基づくネットワーク解析に伴うノイズを最小化することを目指した。さらに、入力遺伝子を “仮説に基づかない “エクソームおよびゲノムワイドシークエンシングによってのみ同定されたものに限定し、含めるための一貫した統計的閾値を設定することで、部分的には生物学的妥当性に基づいて同定されたかもしれない入力遺伝子を用いてメカニズムを明らかにする試みに伴うかもしれない交絡を最小限に抑えた。
これら9つのシード遺伝子を評価するために、ネットワークを構築するための基盤として、発達中のヒトの脳から得られた、空間的・時間的に豊富なmRNA発現データを使用した。この選択は、いくつかの重要な考慮事項に基づいている。第一に、通常発達中のヒトの脳におけるASD関連遺伝子の発現軌跡を解析することで、ASDで異常をきたす正常な生物学的メカニズムについての洞察を得ることができること(State and Sestan, 2012)、第二に、相関性の高い遺伝子発現は、共有された機能および/または制御を反映している可能性が高いこと、第三に、そしておそらく最も重要なこととして、ヒトの脳のトランスクリプトームの特徴づけにおける最近の研究は、発達中に起こる空間的・時間的ダイナミズムを強調し、この次元性を利用する能力を提供していること(Kang et al、 2011). このようなタイプのデータは、タンパク質間相互作用や遺伝子発生学データベースではまだ利用できない。
空間的、時間的に定義された共発現ネットワーク間の収束点を探索するために、単一のde novo LoF変異を持ち、hcASDシード遺伝子をもたらしたものと同じ研究から得られたASDの可能性が高い(pASD)遺伝子の第2の、重複しないセットに依存した。この組み入れ基準も同様に、選択バイアスやバッチ効果を最小化し、このインプットセット全体でASDとの関連について比較的均一な独立したエビデンスを提供するようにデザインされた。
我々の解析では、hcASDとpASDのリスク遺伝子のインプットセットが、ヒトの胎児中期の前頭前野と一次運動-体性感覚皮質(PFC-MSC)の第5層と第6層のグルタミン酸作動性投射ニューロンにおいて収束していることを示す、強固で統計的に有意な証拠を同定した。ASDの根底には広範な遺伝的・表現的異質性があり、本研究で検討したリスク遺伝子はごく一部であることを考えると、これはこのような収束点の一つに過ぎない可能性が高い。それにもかかわらず、ここで示された解析的アプローチは、LoF変異を持つ特定のASD遺伝子の生産的な機能研究に関連する重要な変数を明らかにし、遺伝子発見からASD生物学の実用的理解への重要なステップを提供するものである。
0a1ac3a692398c0754e2791cfb3bda1b-2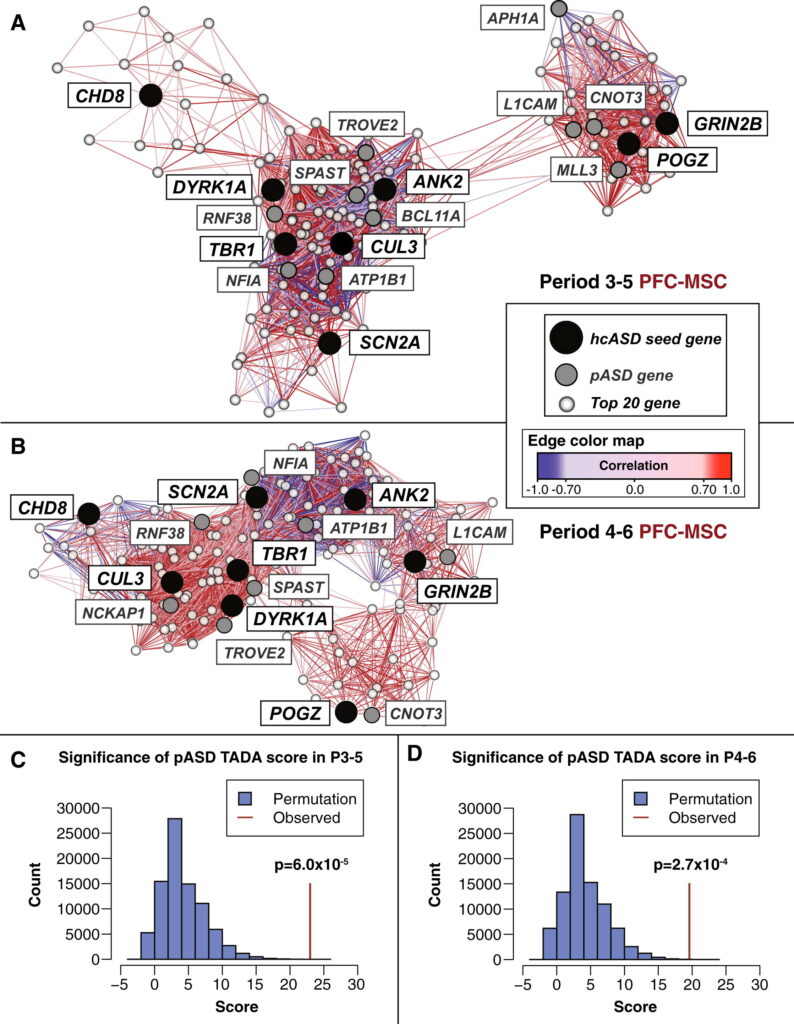
(AおよびB)第3-5期(A)および第4-6期(B)の共発現ネットワークは、エッジの重みとして相関を用い、Cytoscapeのforce-directed layout機能を使って表示されている(Cline et al., 2007)。遺伝子共発現解析は、各hcASD遺伝子と最も相関の高い20遺伝子を対象とした。hcASDシード遺伝子は黒で、ネットワーク内で同定されたpASD遺伝子は灰色で、pASD遺伝子ではない共発現上位20遺伝子は白である。線(エッジ)は共発現相関≧0.7を反映し、陰影は相関の強さを表す;正の相関は赤;負の相関は青。
(CとD) (A)と(B)のネットワーク内で濃縮されたpASD遺伝子は、真のASD遺伝子である確率が最も高いものを表している。TADAスコアは、各遺伝子のASD関連確率を推定するために、de novo変異データとトリオからの遺伝バリアントデータ、希少バリアント症例対照データ、変異率の推定値を組み合わせたものである(He et al.) ヒストグラムは、期間3-5(C)および期間4-6(D)のネットワークにおけるTADAスコアの組み合わせを評価する並べ替え検定(各10万反復)の結果を示しており、観測されたスコアは赤の縦線で示されており、非常に有意である(それぞれp = 6.0 × 10-5およびp = 2.7 × 10-4)。
Discussion
ASDを含む一般的な精神神経疾患に対する遺伝的関与の複雑さは、トランスレーショナル・ニューロサイエンスに十分な課題を投げかけている。具体的には、ASDに関連する特定の変異や変異群を、いつ、どこで、どのような細胞タイプで研究すれば、関連する病態生理学的メカニズムを特定できるのだろうか?
ASDには1,000以上の遺伝子が関与している可能性があることを示唆する最近の研究(He et al. たった9個のhcASDシード遺伝子から始めたにもかかわらず、我々は、10-24 PCWに対応するヒトの胎児期中期の2つの重複する時期(3-5と4-6)において、L5とL6のCPNに関連する共発現ネットワークの寄与について、非常に有意かつ強固な証拠を同定した。これらの結果は、ASDの根底にある遺伝子座の顕著な不均一性は、根本的な病態生理学的メカニズムのもっと小さなセットを指し示すだろうという仮説を強く支持している。
ASDの病因におけるシナプスタンパク質の役割については明らかな証拠があるが、これらの知見は、シナプスを超えたメカニズムの寄与を示唆している(State and Sestan, 2012)。ASDネットワーク内で機能的に多様なリスク遺伝子が同定され、それぞれ異なる細胞区画に存在するタンパク質をコードしていることは、複数の異なる経路やプロセスにおける変化が、その空間的・時間的特性によってASDの表現型につながるのではないかという仮説と一致している。例えば、胎児期中期のPFC-MSCのCPi投射ニューロンは、シナプス結合を形成する最初の皮質ニューロンのひとつであり、これらの初期の神経回路は、最終的にASDのリスクを高める可能性のある様々な遺伝的摂動や関連する機能障害に対して特に脆弱である可能性がある。
解析の精度を最大限に高めるため、入力データの選択にかなりの注意を払った。前述のように、シード遺伝子は複数のde novo LoF変異を持つものに限定し、pASD遺伝子は単一のde novo LoF変異を持つものに限定した。これにより、すでに同定され、確立されたASD遺伝子がいくつか除外されたものの、統計学的根拠に基づいた一貫した組み入れ基準が確立され、ASDへの関与について比較的均一なエビデンスを持つインプットデータが提供され、部分的にはメカニズム的仮説によってもともと同定されていたかもしれない遺伝子の選択によってもたらされたバイアスが取り除かれた。
同様に、ASDにおける胎児中期のCPNの発達のある側面における脆弱性を示すエビデンスは非常に強固であるが、最終的にはASDにおいて生物学的な収束点がさらに発見されるという考え方も支持されている。例えば、胎児中期の皮質発達に加え、出生後の発達において視床と小脳にpASDが濃縮される予備的な証拠が確認されている。注目すべきは、以前からよく知られている2つのASD遺伝子、NRXN1とNLGN4Xも、この共発現ネットワーク内に見られることである(図S3)。同様にして、FMR1、TSC1、TSC2、PTENのようなよく確立された症候性ASD遺伝子は、我々の解析で強調されたネットワークには見当たらない。これらの知見を総合すると、善意のリスク遺伝子の数が増え、ヒトの脳発達の分子ランドスケープに関するデータの深度が増すにつれて、さらに多くの時点や脳領域が同定される可能性があることが示唆される。
この点で、われわれの知見と、本号のCell誌に掲載されたParikshakら(2013年)の付随研究で報告された知見との間に全体的な類似点があることに注目したい。Parikshakらは、別のアプローチを用いて、神経発達障害に関与する遺伝子の空間的・時間的収束を同定している。彼らもまた、胎児期中期の発達やL5/L6を含むASDにおけるCPNの潜在的役割を同定しているが、彼らの結果はL2/L3もASDに関与している。この違いは、選択した入力遺伝子、ネットワーク/モジュール構築のアプローチ、発現データセットの選択の違いを考えれば当然である。hcASD遺伝子の選択された小さなセットを使用することで、我々のアプローチは感度よりも特異性を優先し、ASDリスクの時間的・空間的収束の未検出ポイントが存在することを十分に予期していた。
それにもかかわらず、ここで示された知見は、特定のASD関連変異の研究における重要な変数を即座に制約し、どの遺伝子のどの変異が分子、細胞、あるいは回路レベルの表現型に重複を示す可能性が最も高いかについて、十分な情報に基づいた仮説を追求するための基礎を提供するものである。ASD遺伝子や変異の数が増加し、コードされるタンパク質が実行する生物学的プロセスが多岐にわたっていることを考えると、将来、in vitroやin vivoでの研究を、空間的・時間的特性やネットワーク関係に基づいて遺伝子のサブセットに集中させることができるこの能力は、病態生理学的メカニズムのより深い理解の追求や治療標的の同定において、大きな価値を持つことが期待される。
