本日は、日本解剖学会第110回関東支部学術集会の報告会(報告者:YWさん)とジャーナルクラブ(紹介者:武井)を行いました。
a0d7384ae4668f58ed04eb168bf13837Nature volume 600, pages686–689 (2021) Article
Published: 24 November 2021
Mechanical actions of dendritic-spine enlargement on presynaptic exocytosis (樹状突起スパインの伸長によるシナプス前エキソサイトーシスへの力学的作用)
Hasan Ucar, Satoshi Watanabe, Jun Noguchi, Yuichi Morimoto, Yusuke Iino, Sho Yagishita, Noriko Takahashi & Haruo Kasai
Laboratory of Structural Physiology, Center for Disease Biology and Integrative Medicine, Faculty of Medicine, The University of Tokyo, Tokyo, Japan
International Research Center for Neurointelligence (WPI-IRCN), UTIAS, The University of Tokyo, Tokyo, Japan
Abstract
Synaptic transmission involves cell-to-cell communication at the synaptic junction between two neurons, and chemical and electrical forms of this process have been extensively studied. In the brain, excitatory glutamatergic synapses are often made on dendritic spines that enlarge during learning1,2,3,4,5. As dendritic spines and the presynaptic terminals are tightly connected with the synaptic cleft6, the enlargement may have mechanical effects on presynaptic functions7. Here we show that fine and transient pushing of the presynaptic boutons with a glass pipette markedly promotes both the evoked release of glutamate and the assembly of SNARE (soluble N-ethylmaleimide-sensitive factor attachment protein receptor) proteins8,9,10,11,12—as measured by Förster resonance transfer (FRET) and fluorescence lifetime imaging—in rat slice culture preparations13. Both of these effects persisted for more than 20 minutes. The increased presynaptic FRET was independent of cytosolic calcium (Ca2+), but dependent on the assembly of SNARE proteins and actin polymerization in the boutons. Notably, a low hypertonic solution of sucrose (20 mM) had facilitatory effects on both the FRET and the evoked release without inducing spontaneous release, in striking contrast with a high hypertonic sucrose solution (300 mM), which induced exocytosis by itself14. Finally, spine enlargement induced by two-photon glutamate uncaging enhanced the evoked release and the FRET only when the spines pushed the boutons by their elongation. Thus, we have identified a mechanosensory and transduction mechanism15 in the presynaptic boutons, in which the evoked release of glutamate is enhanced for more than 20 min.
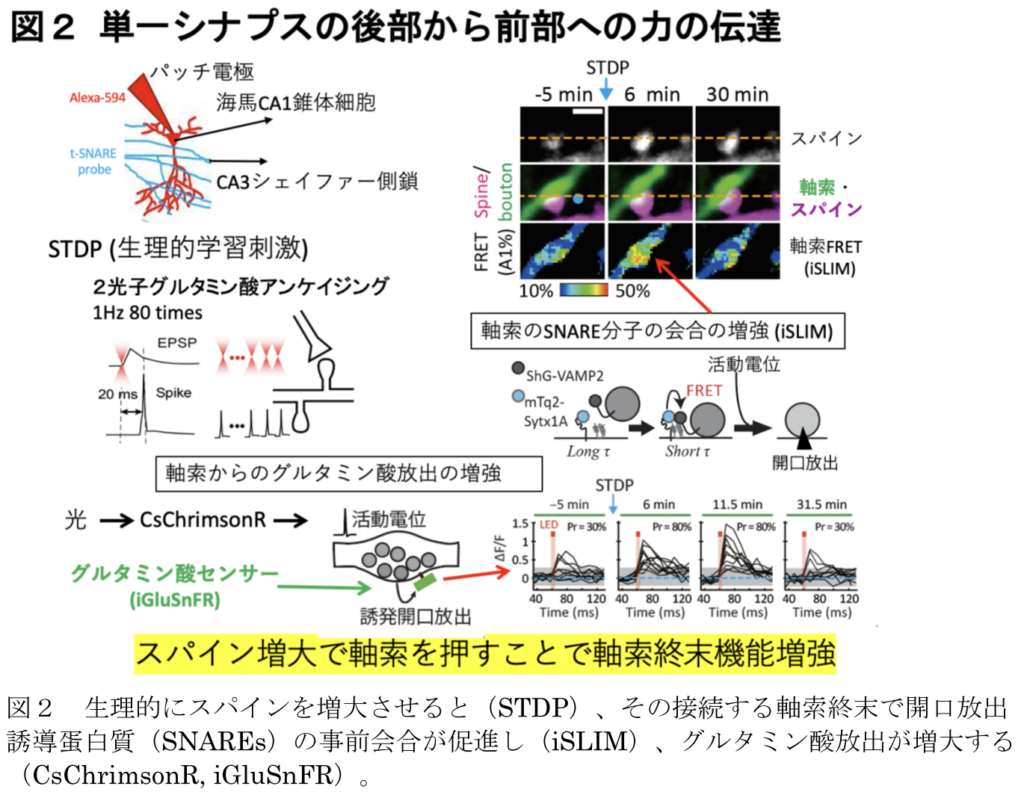
シナプス伝達は、2つの神経細胞間のシナプス接合部における細胞間情報伝達であり、このプロセスの化学的および電気的形態が広く研究されている。脳では、興奮性のグルタミン酸作動性シナプスは、学習時に拡大する樹状突起スパイン上で作られることが多い。樹状突起スパインとシナプス前末端はシナプス間隙で強固に結合しているため、この拡大はシナプス前機能に力学的影響を及ぼすと考えられる。我々は、ラットスライス培養標本を用いて、ガラスピペットでシナプス前ブトンを微細かつ一過性に押すと、グルタミン酸の誘発放出とSNARE(soluble N-ethylmaleimide-sensitive factor attachment protein receptor)タンパク質が著しく促進することを明らかにした。これらの効果はいずれも20分以上持続した。シナプス前部のFRETの増加は、細胞質カルシウム(Ca2+)には依存せず、SNAREタンパク質の会合とブトンにおけるアクチン重合に依存していた。このことは、高濃度のスクロース溶液(300 mM)がそれ自体でエキソサイトーシスを誘発するのとは対照的である。また、グルタミン酸の2光子アンケージングを行ったところ、スパインの伸長によってブトンが押された場合にのみ、誘発放出とFRETが増強された。このように、東京大学の河西春郎らのグループは、シナプス前ブトンにおいて、グルタミン酸の誘発放出が20分以上増強されるメカノセンシティブな伝達機構を見いだした。
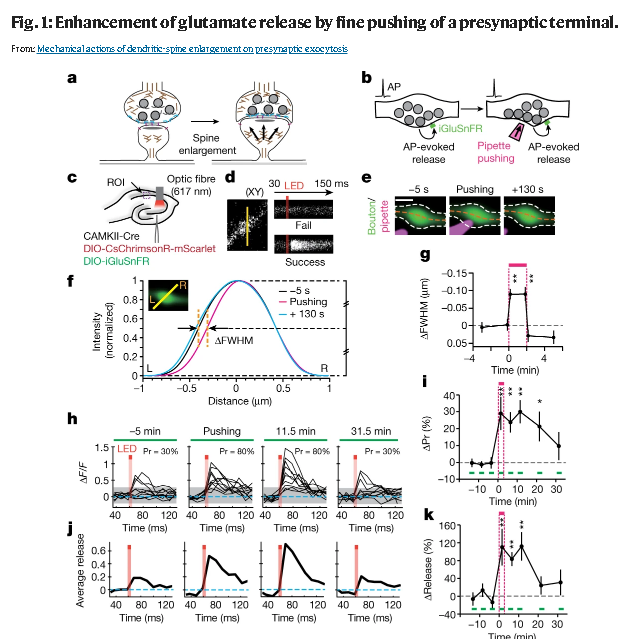
a, Putative mechanical actions of the spine enlargement on a presynaptic terminal. b, Experimental designs. AP, action potential. c, Virus injection protocols. ROI, region of interest. d, Line-scanning of iGluSnFR fluorescence on a presynaptic bouton in the CA1 region detected failure or success events after optogenetic stimulation (5 ms, orange bars). e, Pushing of the presynaptic terminal labelled with iGluSnFR (green) by the glass pipette (magenta). White and orange dashed lines indicate the outline and axial lines of the boutons, respectively. Scale bar indicates 0.5 µm. f, Fluorescence profiles before (black), during (magenta) and after (cyan) pushing in the terminal shown in e. The profiles are normalized at the peak, and aligned at the right sides (R). Orange dashed lines indicate the difference in FWHM. g, Mean time courses of ΔFWHM during pushing (magenta bar). n = 8. Kruskal–Wallis test (H = 15.0, **P = 5.4 × 10−4) followed by Dunn’s multiple comparisons test (versus the baseline). Push (10 s), **P = 1.06 × 10−3; push (110 s), **P = 2.03 × 10−3. h, j, Traces of iGluSnFR fluorescence obtained from repetitive line-scanning before (−5 min), during (pushing) and after pushing from an optogenetically stimulated bouton (h), and their average (j). Pr, release probability. i, k, Mean time courses of ΔPr (i) and the peaks of the averaged iGluSnFR traces (k). Green bars indicate the time windows for the Pr measurement. n = 10. For the baseline Pr, 3 consecutive Pr values (5 min apart) from all boutons were obtained. Two-sided Kruskal–Wallis test (H = 23.8, **P = 6.75 × 10−5) followed by Dunn’s multiple comparisons test (versus the baseline). 1.5 min, **P = 1.61 × 10−3; 6.5 min, **P = 1.62 × 10−3; 11.5 min, **P = 3.11 × 10−4; 21.5 min, *P = 0.017 (i). Kruskal–Wallis test (H = 19.17, **P = 7.29 × 10−4) followed by Dunn’s multiple comparisons test. 1.5 min, **P = 4.32 × 10−3; 6.5 min, **P = 3.15 × 10−3; 11.5 min, **P = 1.5 × 10−3 (k). Error bars indicate s.e.m.
下記は、東京大学のプレスリリースからの抜粋です。
Discussion
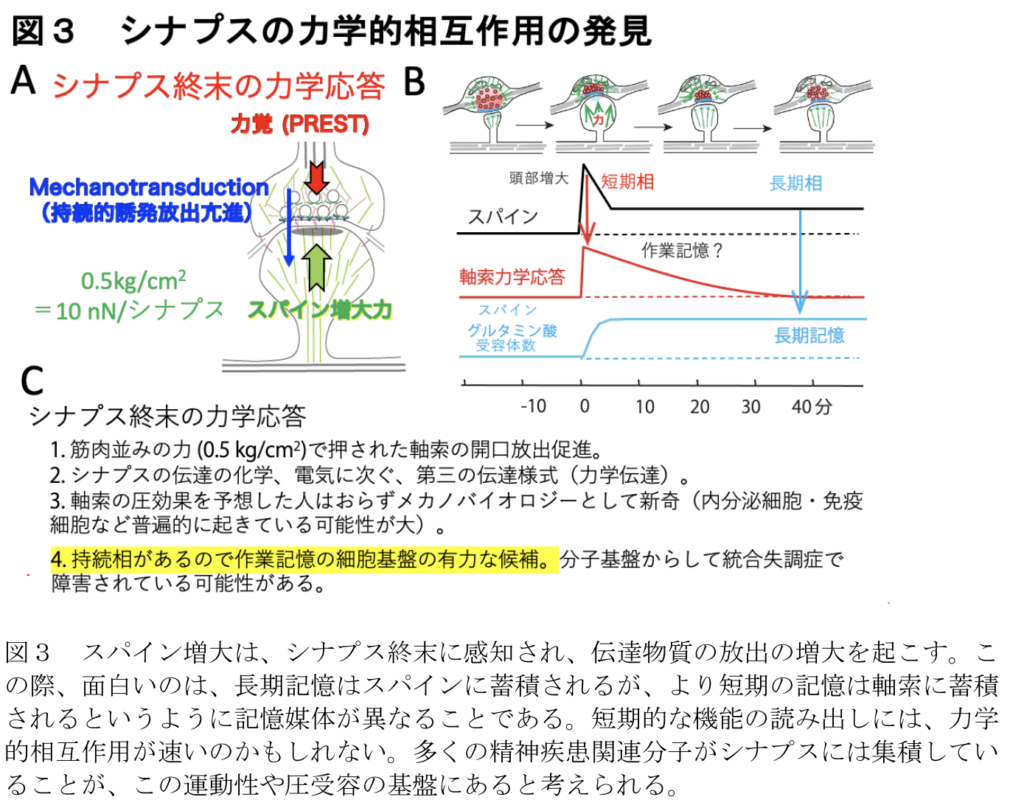
これらのデータは、スパインの拡大がシナプス前ブートンを押し、誘発された神経伝達物質放出を機械的に強化するという考えを支持している。シナプス構造の高圧凍結から明らかなように、細胞質は歪んでいないので、血圧のようなバルク溶液中の静水圧はこのような効果を引き起こさないであろうことに注意すべきである29。さらに強く押すと、誘発放出は抑制された。このことは、細胞質分子のコンフォメーション、それらの結合、膜の構造が適切に変化することで、SNAREタンパク質の集合が促進され、アクチン重合依存的に小胞が補充されたことを示唆している。このように、我々は、局所圧を感知し、シナプス前終末において少なくとも20分間、誘発された神経伝達物質の放出を促進することによって反応する、「圧力感知と伝達」(PREST)と呼ぶメカノセンセーションと伝達メカニズムを同定した(図1、3、4)。一過性のスパインの拡大は10分以上持続しないことから、PRESTはより長いワーキングメモリーとして働く可能性がある。PREST機構はまた、非分泌細胞だけでなく分泌細胞32においてもエキソサイトーシスを促進する可能性がある。なぜなら、SNAREに基づくエキソサイトーシスの様式はどこにでもあるからである。
神経が神経を「押して」情報伝達?! 河西春郎特任教授 学士院賞・恩賜賞受賞記念インタビュー



