Nature Article Published: 20 December 2023
Protracted neuronal recruitment in the temporal lobes of young children (幼児期まで継続する側頭葉のニューロン動員)
Marcos Assis Nascimento, Sean Biagiotti, Vicente Herranz-Pérez, Samara Santiago, Raymund Bueno, Chun J. Ye, Taylor J. Abel, Zhuangzhi Zhang, Juan S. Rubio-Moll, Arnold R. Kriegstein, Zhengang Yang, Jose Manuel Garcia-Verdugo, Eric J. Huang, Arturo Alvarez-Buylla & Shawn F. Sorrells
- Department of Neurological Surgery, University of California, San Francisco, CA, USA
- Eli and Edythe Broad Center of Regeneration Medicine and Stem Cell Research, University of California, San Francisco, CA, USA
Abstract
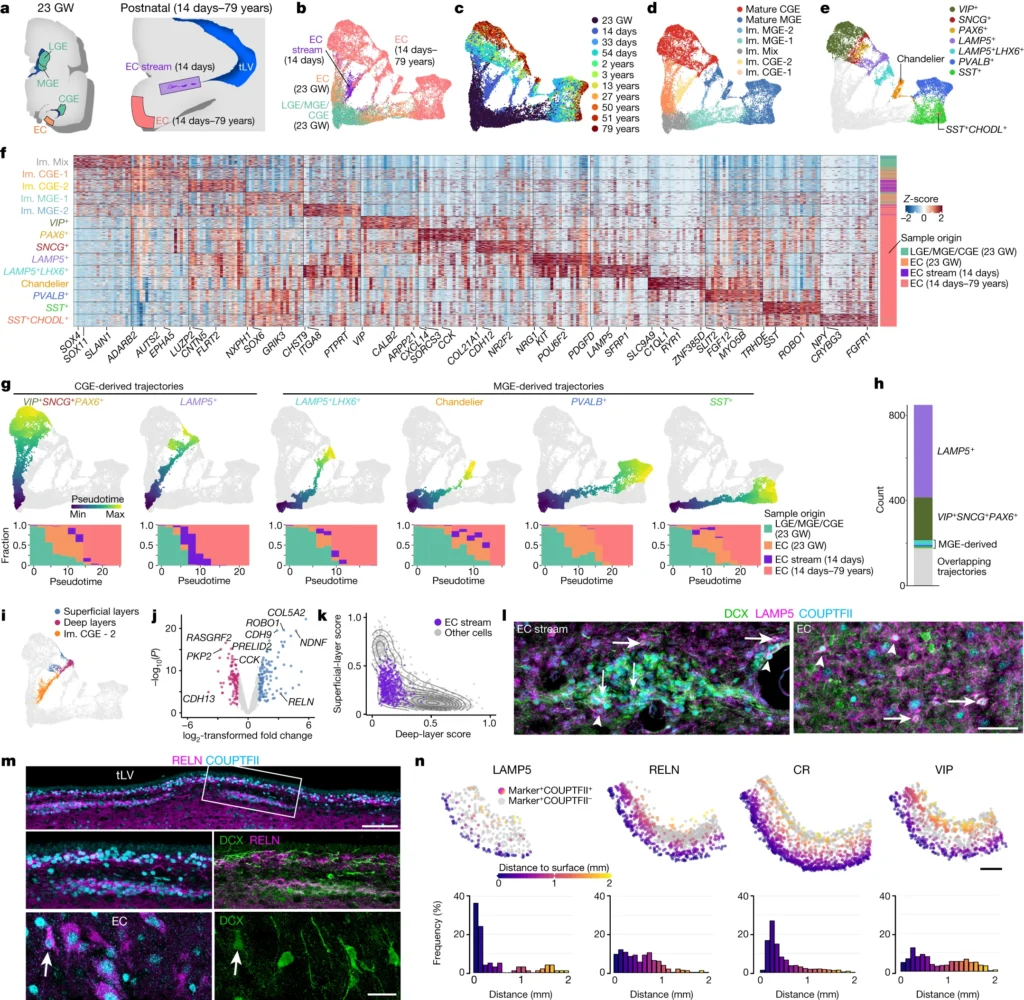
The temporal lobe of the human brain contains the entorhinal cortex (EC). This region of the brain is a highly interconnected integrative hub for sensory and spatial information; it also has a key role in episodic memory formation and is the main source of cortical hippocampal inputs1,2,3,4. The human EC continues to develop during childhood5, but neurogenesis and neuronal migration to the EC are widely considered to be complete by birth. Here we show that the human temporal lobe contains many young neurons migrating into the postnatal EC and adjacent regions, with a large tangential stream persisting until the age of around one year and radial dispersal continuing until around two to three years of age. By contrast, we found no equivalent postnatal migration in rhesus macaques (Macaca mulatta). Immunostaining and single-nucleus RNA sequencing of ganglionic eminence germinal zones, the EC stream and the postnatal EC revealed that most migrating cells in the EC stream are derived from the caudal ganglionic eminence and become LAMP5+RELN+ inhibitory interneurons. These late-arriving interneurons could continue to shape the processing of sensory and spatial information well into postnatal life, when children are actively interacting with their environment. The EC is one of the first regions of the brain to be affected in Alzheimer’s disease, and previous work has linked cognitive decline to the loss of LAMP5+RELN+ cells6,7. Our investigation reveals that many of these cells arrive in the EC through a major postnatal migratory stream in early childhood.
ヒトの脳の側頭葉には、嗅内皮質(EC)がある。脳のこの領域は、感覚情報と空間情報の高度に相互接続された統合ハブであり、エピソード記憶の形成にも重要な役割を果たし、皮質の海馬入力の主な供給源でもある1,2,3,4。ヒトの側頭葉ECは小児期にも発達を続けるが5、神経新生とECへの神経細胞移動は出生までに完了すると広く考えられている。ここでは、ヒトの側頭葉には、生後ECとその隣接領域に移動する多くの若いニューロンが存在し、大きな接線方向の流れが1歳頃まで持続し、放射状の分散が2~3歳頃まで続いていることを示す。これとは対照的に、アカゲザル(Macaca mulatta)では生後に相当する移動は見られなかった。神経節小脳胚葉帯、ECストリーム、生後ECの免疫染色と単核RNA配列決定から、ECストリームの移動細胞のほとんどが尾側神経節小脳に由来し、LAMP5+RELN+抑制性介在ニューロンになることが明らかになった。このような後発の介在ニューロンは、子どもが環境と活発に相互作用する生後も、感覚や空間情報の処理を形成し続ける可能性がある。ECはアルツハイマー病で最初に冒される脳の部位のひとつであり、これまでの研究では、認知機能の低下とLAMP5+RELN+細胞の消失が関連していた6,7。われわれの研究から、これらの細胞の多くが、幼少期に生後の主要な移動経路を通ってECに到達することが明らかになった。
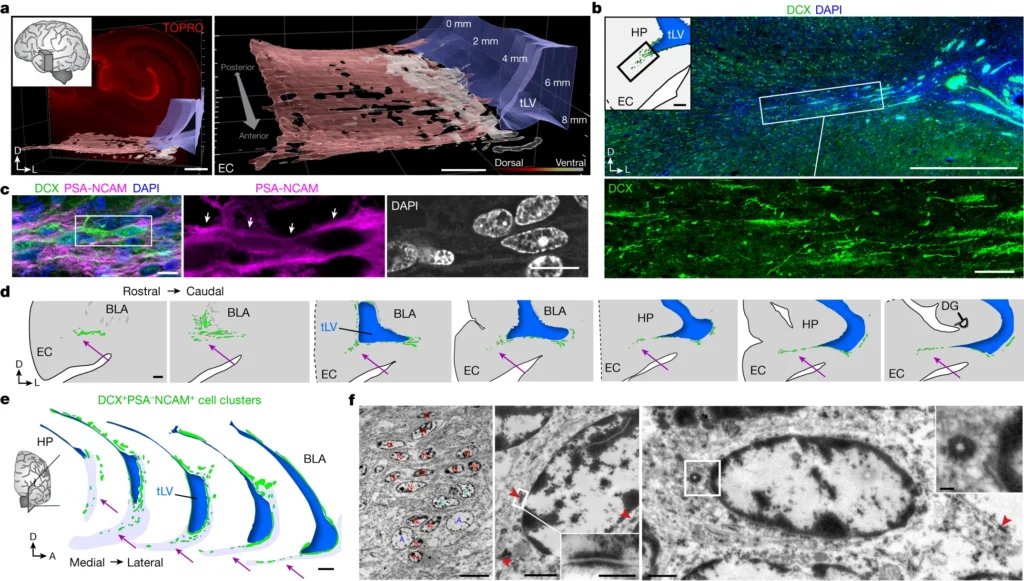
eでは、tLV(側頭葉室の外側壁)に多くのDCX+DLX2+細胞が含まれていること、そしてこれらの細胞がTBR1を発現していないことを示している。fでは、出生時のECストリームDCX+細胞がDLX2およびTBR1またはDLX2とCOUPTFIIで共染色されていることを示している。gでは、38週の胎児期(GW)と出生後7ヶ月におけるECストリームの左側のSCGN+細胞クラスターと、出生時の側頭葉のDCX+SCGN+細胞を示している。hでは、38 GWの人間のECがDCXとDLX2またはTBR1で免疫染色されており、iでは出生から2歳までの間にSCGNで免疫染色された人間のECを示している。jでは、38 GWと2歳の時点でのECがDCX+細胞とCOUPTFII、SP8、LHX6、NKX2.1で共染色されていること(矢印で示されている)を示している。kでは、出生から2歳までの間にECでDCX+細胞とCOUPTFII、SP8、LHX6、NKX2.1で共染色された細胞の割合を示している。大きな点は平均を、小さな点は個々のサンプル画像を、バーは個々の画像の標準誤差を示し、n = 5個体で3回の独立した実験で行われました。lでは、出生時にDCX+細胞がDLX2(矢で示されている)で共染色されているマカクのECストリーム領域を示し、この領域にはCOUPTFII−の個々の移動細胞が含まれている。
これらの図は、ECストリームが主にCGE由来の移動するインターニューロンを供給していることを示している。
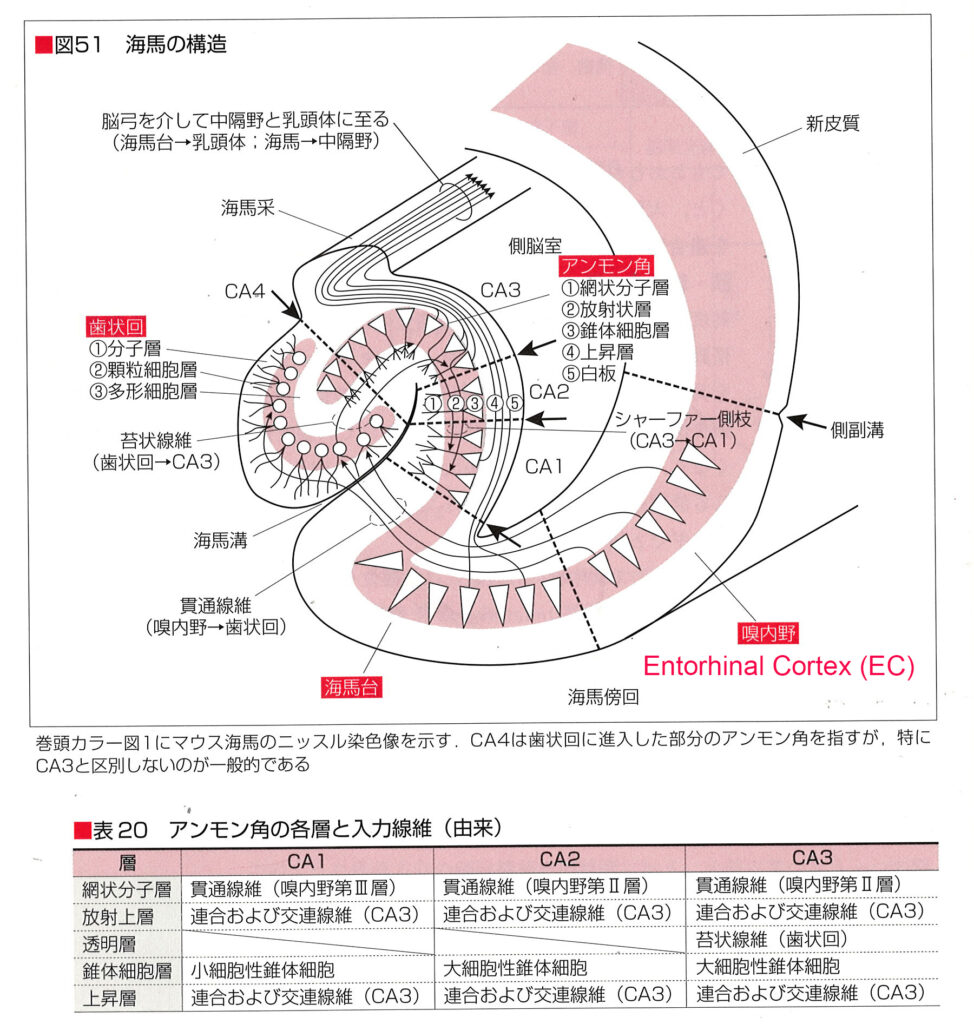
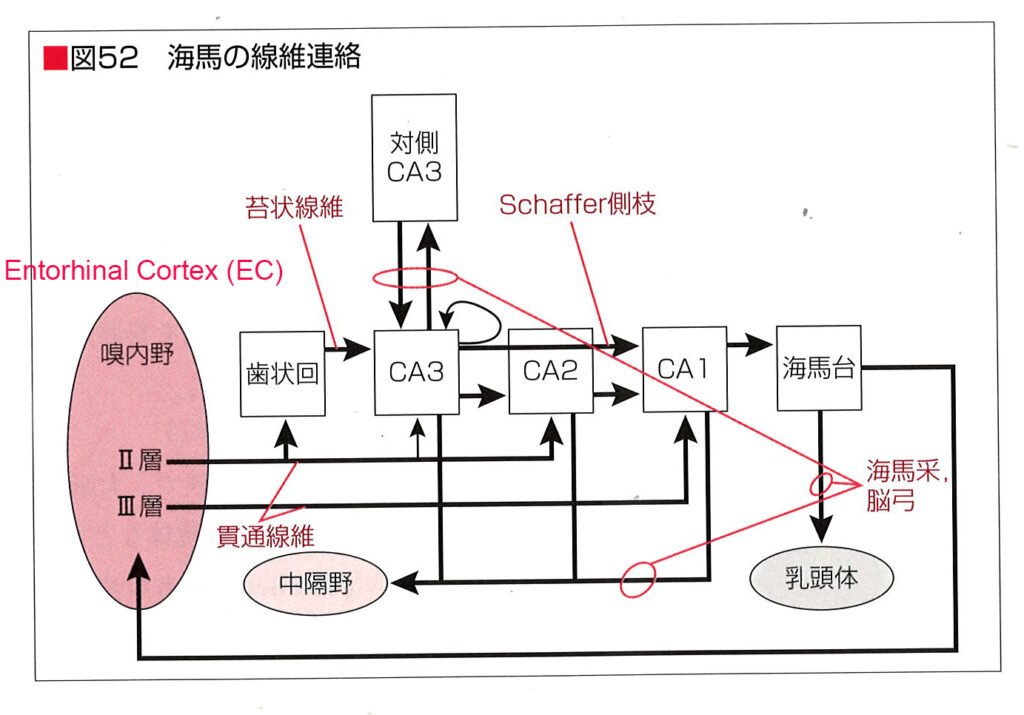
嗅内皮質ECは、海馬の不等皮質と側頭葉新皮質の間に位置する皮質領域である。 それは、ゆっくりと発達する前頭皮質および海馬と相互接続されている。 EC の胚発生は新皮質の発生とは異なる。 この一例は、EC 表層における星状島(2層に島状の細胞塊が観察される)の初期形成である。 皮質ニューロンの誕生と移動は主に胚形成中期に起こるが、ヒトでは EC のニューロンが出生後も成熟し続けることを示唆する証拠がある。 未成熟ニューロンで一般的に見られる 2 つの分子マーカー、微小管結合タンパク質ダブルコルチン (DCX) と細胞表面タンパク質ポリシアル化神経細胞接着分子 (PSA-NCAM) が、出生後のヒト EC で観察されている14,15。 これは、EC が出生後もニューロンを受け取り続けるかどうかという疑問を引き起こす。
研究チームは、ヒトの側頭葉サンプルを用いて免疫染色、単一核RNAシーケンシング、光シート顕微鏡を使用し、ニューロンの移動パターンを追跡した。
Discussion
われわれの発見は、生後ヒトの側頭葉には、未熟な移動ニューロンをECや近隣の皮質領域に運ぶ大きな移動流が残っていることを示している。この移動流は、妊娠中に癒合した脳室の位置の隣に形成され、生後少なくとも11ヵ月間は維持される。注目すべきことに、個々の若いニューロンは2~3歳まで大脳皮質に移動し続けるが、それ以上の年齢(3~77歳)では移動しない。これらの所見は、ドナーの年齢を一致させたsnRNA-seqデータによって裏付けられた。これらの移動ニューロンのほとんどは、若いLAMP5+ CGE由来の介在ニューロンである。アカゲザルでは同様の生後移動の流れは観察されず、マカクで出生時に存在した少数の移動細胞は、ヒトで発現する転写因子とは異なる転写因子を発現していた。ヒトの前頭葉8,9においても、生後数ヵ月間の若いニューロンの流れが報告されている。今回の研究から、ヒトの側頭葉には、生後1年間を通じて、長距離を移動し、大脳皮質の生後回路に採用される若いニューロンの大きな流れが存在することが示された。
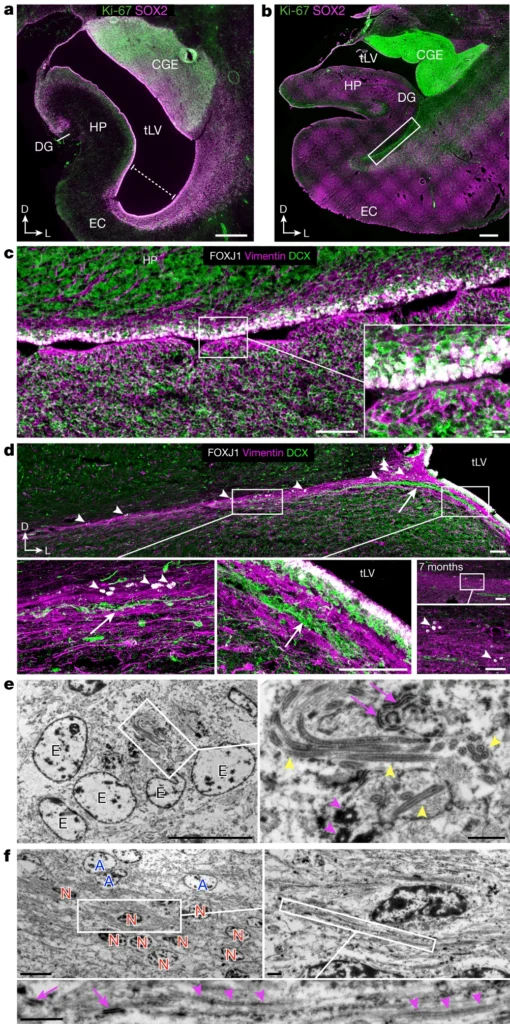
皮質介在ニューロンは、脳の進化的革新の鍵を握っていると考えられている25,26。ヒトの大脳皮質における尾側基底核原基CGEの寄与は、げっ歯類で観察されるものの約2倍であり24,27、その結果、皮質介在ニューロンの数と多様性が大きくなっている28,29,30,31,32。われわれの組織学的およびトランスクリプトーム解析は、生後ECストリームの未成熟ニューロンのほとんどがCGE由来であることと一致している。マウスの脳では、胎生期にCGEから海馬とECへの移動が報告されており33、マカクでも同様の移動が胎生期に限定されている可能性がある。この発生過程は、増殖が亢進しCGEが大きく拡大したヒトの脳では、やがて拡大する可能性がある。これと同様に、ヒトのCGEは妊娠中期から後期にかけて非常に顕著になり、周囲の脳領域と比較してより多くの分裂細胞が存在することが観察された(図5g,hおよびExtended Data Figs.) 注目すべきことに、CGEは出生時にもまだ増殖しており、分裂細胞の散在するクラスターと、移動形態を持つ若いニューロンが混在していた(図5e-hおよび拡張データ図7)。このことは、CGEに残された部分では、ある程度の神経新生が生後も続いており、生後のECの流れに寄与している可能性を示唆している。注目すべきことに、ヒトの脳オルガノイドにおけるCGE前駆細胞の異常な後期拡大は、結節性硬化症複合体遺伝子TSC1およびTSC2の変異と関連しており、その結果、脳室周囲腫瘍や皮質形成異常が形成される可能性がある34。
組織学的にも転写学的にも、ECの流れにRGの亜集団が観察された(図4bと5b-d)。これらのRGのサブセットは出生時にKi-67+であり、EOMES+中間前駆細胞やTBR1+未熟興奮性ニューロンにつながるトランスクリプトーム軌跡を持つ。このことは、興奮性神経新生がECストリームの領域で低いレベルで生後も続いていることを示唆している。淡蒼球RGは、CGE由来の介在ニューロンに転写的に類似した抑制性ニューロンを生成できることが示唆されている35。しかし、RGと介在ニューロンをつなぐ中間的な前駆細胞集団は、ECストリームでは捕捉されなかった。その代わりに、ECストリームの細胞の大部分はCGE由来の特性を有していた。
ECに加えて、前頭前皮質と海馬はそれぞれ乳児と小児において新しいニューロンを補充し続けており、ECはこれらの両方の領域と深く相互接続されています。 海馬では、EC の表層から求心性神経を受け取る歯状回内で新しいニューロンが特異的に補充されます。 私たちのデータ 10 と他のデータ 3,36 は、EC の場合と同様に、歯状神経新生は出生後に急速に減少し、成人では新しいニューロンが追加されたとしてもほとんどないことを示している。 しかし、歯状神経新生は成人でも継続することを示唆する人もいる11,37。 今後の研究では、ECと海馬における出生後の新しいニューロンの動員が機能的に関連しているかどうかを調査する可能性がある。
V-SVZ は、前脳内を接線方向に移動する介在ニューロンの一般的な通過経路である 8、9、38、39。 介在ニューロンの主要な導管である RMS は、融合した嗅心室の隣に現れる 16。 この研究では、出生前に発生し、神経細胞の移動の足場となるヒト側頭葉の心室融合を特定した。 RMS16 と同様に、EC ストリーム内の遊走ニューロンは鎖状に移動し、グリア細胞に囲まれている。 脳のサイズと解剖学的複雑さが増大し、胚領域が神経細胞の目的地から大きく分離されるにつれて、これらの脳室周囲経路は接線方向の移動のための足場を提供する40。 EC ストリームの領域は、CGE 由来ニューロンだけでなく、複数のニューロン サブタイプの接線方向移動のルートである可能性がある。 この可能性は、出生時の EC の流れにおける LHX6+ 細胞の存在と、出生後の EC における未熟なニューロン間の LHX6+ 細胞の相対存在量の急激な減少によって裏付けられる。
EC は多感覚統合を実行し、海馬への皮質入力の主な供給源として宣言的記憶に不可欠である 1,2,41。 この特徴的な皮質領域には、空間的に調整されたグリッド細胞 4 を含む、多様なニューロン サブタイプ 3 が含まれており、アルツハイマー病 (AD) で神経細胞の喪失が最初に注目される脳領域である 42,43。 アルツハイマー病における記憶症状の発症は、興奮と抑制の不均衡を反映して、EC におけるニューロン喪失および非けいれん発作と同時に起こる 44。 特に、EC の第 2 層にある海馬への投射ニューロンは、活動の低下に特に敏感である 45。これは、抑制性ニューロンのさまざまなサブタイプの活動の不均衡に起因する可能性がある。 アルツハイマー病患者の側頭葉では複数の介在ニューロンのサブタイプが影響を受けているが(参考文献22)、最近の研究では、アルツハイマー病患者およびこの疾患のマウスモデルではLAMP5+介在ニューロンが特に脆弱であることが示唆されている46。 我々の結果は、出生後のヒトECストリームが、上層LAMP5+RELN+介在ニューロンになるよう準備された若いニューロンを送達することを示しており、この集団は前臨床AD患者では急激に減少していることが最近判明している(参考文献7)。 さらに、別の最近の研究 6 では、前頭前皮質における LAMP5+RELN+ 介在ニューロンの喪失が、アルツハイマー病患者の認知機能低下と密接に関連していることが判明した。 これらの出生後に由来するLAMP5+RELN+ニューロンの機能的寄与を決定し、ヒトの脳へのそれらの到着が遅いために神経変性に対して特に脆弱になるかどうかを確認することは興味深いであろう。
我々の発見は、神経細胞の移動とリクルートといった脳発達の基本的な細胞プロセスが、ヒトでは他の生物種に比べていかに長引いているかを浮き彫りにした。ヒトのECは、多感覚統合、学習、エピソード記憶の発達といったECの機能的成熟と同時に起こる細胞メカニズムにより、生後もGABA作動性抑制性ニューロンをリクルートし続ける47。GABA作動性シグナル伝達と局所回路抑制細胞の成熟は、発達期に可塑性が高まる時期にとって極めて重要である48,49,50。生後採用された抑制性ニューロンの成熟が長引くと、これらの細胞が他の皮質領域からの複雑な情報を統合するため、ECに広い可塑性の期間がもたらされる可能性がある。
https://bmcresnotes.biomedcentral.com/articles/10.1186/s13104-020-05100-7
