Cell Reports ARTICLE| VOLUME 42, ISSUE 2, 112104, FEBRUARY 28, 2023
Microglia reactivity entails microtubule remodeling from acentrosomal to centrosomal arrays (ミクログリア活性化には、無中心体から中心体への微小管リモデリングが関与している)
Published:February 13, 2023DOI:https://doi.org/10.1016/j.celrep.2023.112104
Maria Rosito, Caterina Sanchini, Giorgio Gosti, …, Giancarlo Ruocco, Silvia Di Angelantonio,
Francesca Bartolini
1Center for Life Nano- & Neuro-Science, Istituto Italiano di Tecnologia, 00161 Rome, Italy
2Department of Physiology and Pharmacology, Sapienza University, 00185 Rome, Italy
3Soft and Living Matter Laboratory, Institute of Nanotechnology, Consiglio Nazionale delle Ricerche, 00185 Rome, Italy
4CrestOptics S.p.A, 00165 Rome, Italy
5Electron Microscopy Facility, Istituto Italiano di Tecnologia, 16163 Genova, Italy
6Telethon Institute of Genetics and Medicine, 80078 Pozzuoli, Italy
7Institute for Genetic and Biomedical Research, National Research Council, 20090 Milan, Italy
8Institute of Biochemistry and Cellular Biology, National Research Council, 00015 Rome, Italy
9Department of Biology and Biotechnologies ‘‘Charles Darwin’’, Sapienza University, 00185 Rome, Italy
10Santa Lucia Foundation (IRCCS Fondazione Santa Lucia), 00179 Rome, Italy
11Department of Physics, Sapienza University, 00185 Rome, Italy
12D-Tails s.r.l, 00165 Rome, Italy
13Department of Pathology and Cell Biology, Columbia University Medical Center, New York, NY 10032, USA
*Correspondence: silvia.diangelantonio@uniroma1.it (S.D.A.), fb2131@cumc.columbia.edu (F.B.)
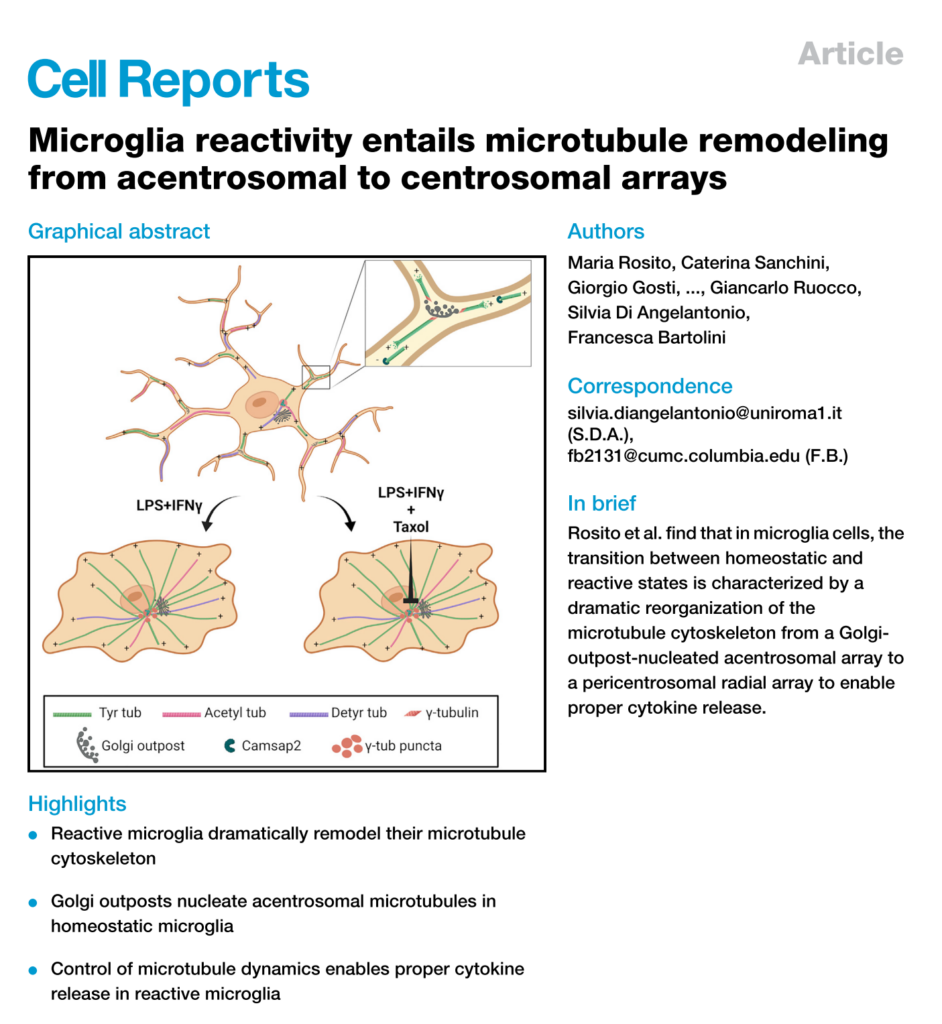
Highlights
• Reactive microglia dramatically remodel their microtubule cytoskeleton
• Golgi outposts nucleate acentrosomal microtubules in homeostatic microglia
• Control of microtubule dynamics enables proper cytokine release in reactive microglia
ハイライト
・反応性ミクログリアは、微小管細胞骨格を劇的にリモデリングする
・ゴルジ体は恒常性ミクログリアの中心体微小管を核形成する
・微小管ダイナミクスを制御することで、反応性ミクログリアにおける適切なサイトカイン放出が可能になる
Summary
Microglia reactivity entails a large-scale remodeling of cellular geometry, but the behavior of the microtubule cytoskeleton during these changes remains unexplored. Here we show that activated microglia provide an example of microtubule reorganization from a non-centrosomal array of parallel and stable microtubules to a radial array of more dynamic microtubules. While in the homeostatic state, microglia nucleate microtubules at Golgi outposts, and activating signaling induces recruitment of nucleating material nearby the centrosome, a process inhibited by microtubule stabilization. Our results demonstrate that a hallmark of microglia reactivity is a striking remodeling of the microtubule cytoskeleton and suggest that while pericentrosomal microtubule nucleation may serve as a distinct marker of microglia activation, inhibition of microtubule dynamics may provide a different strategy to reduce microglia reactivity in inflammatory disease.
まとめ
ミクログリアの反応には細胞形状の大規模な再構築が必要であるが、その際の微小管細胞骨格の挙動は未解明であった。我々は、活性化したミクログリアが、平行で安定な微小管の非中心体配列から、より動的な微小管の放射状配列への微小管の再編成の一例を提供することを示す。恒常性維持状態では、ミクログリアはゴルジ体前哨部(golgi outpots)で微小管の核形成を行い、活性化シグナルは中心体近傍での核形成物質の動員を誘導するが、この過程は微小管の安定化により阻害される。私たちの結果は、ミクログリア反応性の特徴が微小管細胞骨格の顕著なリモデリングであることを示しており、中心体周囲の微小管核形成がミクログリア活性化の明確なマーカーとして機能する可能性がある一方で、微小管ダイナミクスの阻害が炎症性疾患におけるミクログリア反応性を低下させる別の戦略を提供する可能性があることを示唆する。
Keywords
activated microglia, alternatively activated microglia, microtubule, centrosome, γ-tubulin, MTOC, Golgi outposts, retina, inflammation, reactive microglia
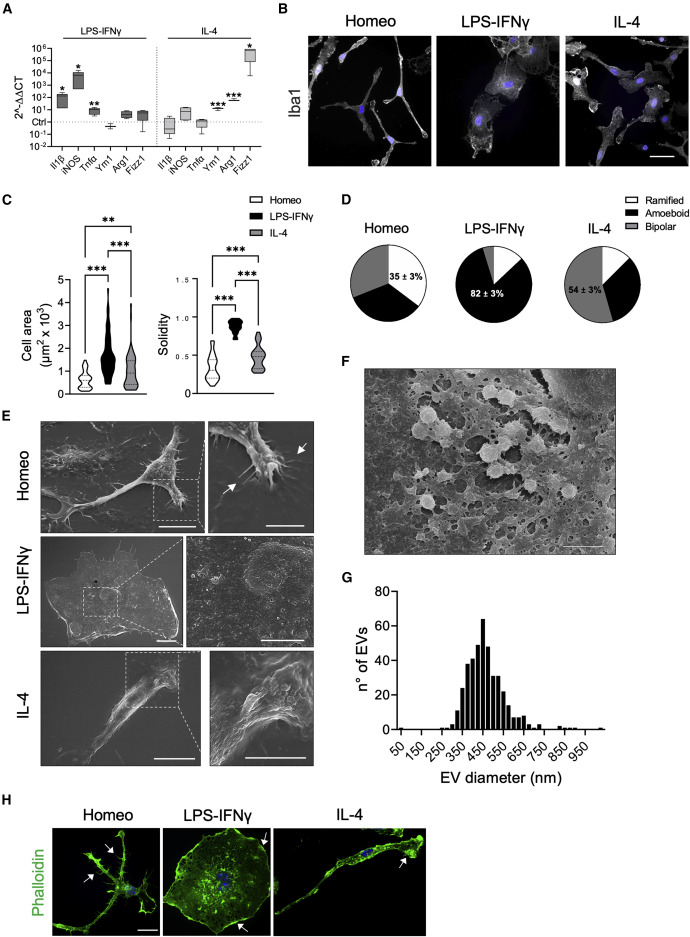
(A) Real-time qPCR reveals increased expression of pro-inflammatory (Il1b, iNOS, Tnfα) and anti-inflammatory genes (Ym1, Arg1, Fizz1) upon LPS-IFNγ or IL-4 challenge, respectively. Gene expression is normalized to the housekeeping gene Gapdh, n = 4 independent cultures. Box plots indicate the median, 25th, and 75th percentiles; whiskers show the minimum and maximum. ∗∗∗p < 0.001, ∗∗p < 0.01, ∗p < 0.05, Student’s t test.
(B) Representative images showing Iba1 immunostaining (gray) of microglia in homeostatic (Homeo) condition and following LPS-IFNγ or IL-4 treatment. Hoechst for nuclei visualization, blue. Scale bar, 20 μm.
(C) Violin plots showing cell surface area (left) and solidity coefficient (right) related to Homeo (white), LPS-IFNγ (black), or IL-4 (gray) challenged cells (n = 70 cells for each condition, from 3 independent experiments). ∗∗∗p < 0.001, ∗∗p < 0.01; left: Kruskall-Wallis with Dunn’s multiple comparisons test for cell area; right: one-way ANOVA with Tukey’s multiple comparisons test for solidity.
(D) Pie charts illustrating the distribution of cell morphology in Homeo, LPS-IFNγ, and IL-4 conditions. Ramified cells are enriched in Homeo (35% ± 3%); ameboid cells in LPS-IFNγ-treated microglia (82% ± 3%); and bipolar cells in IL-4-treated microglia (54% ± 3%). n = 3 independent experiments.
(E) Representative scanning electron micrographs of microglia in Homeo (top), LPS-IFNγ (middle), and IL-4 (bottom) conditions. Ramified cells (Homeo) show filopodia extensions as indicated by arrows, ameboid cells (LPS-IFNγ) exhibit numerous extracellular vesicles (EVs) on the cell surface, while bipolar cells (IL-4) are characterized by extensive membrane ruffling on the cell surface and leading edge. Scale bars, 10 μm (5 μm in zoom images).
(F) Scanning electron micrographs showing EVs on the LPS-IFNγ cell surface at higher magnification. Scale bar, 2 μm.
(G) Distribution of EV size measured on the ameboid cell surface. n = 22 cells.
(H) Representative confocal images of microglia labeled with Alexa Fluor 488-conjugated phalloidin (green). Ramified cells (Homeo) exhibit filopodia-like structures (as indicated by arrows) while ameboid (LPS-IFNγ) and bipolar cells (IL-4) are characterized by membrane ruffles along cell borders and at lamellipodia (as indicated by arrows). Hoechst for nuclei visualization, blue. Scale bar, 25 μm. https://www.cell.com/action/showPdf?pii=S2211-1247%2823%2900115-8
Introduction
ミクログリアは脳の主要な自然免疫細胞である。健康な脳における恒常的な状態では、ミクログリアは突起をもった形態を示し、運動性の高い突起を伸展・後退させることで局所環境を絶えずパトロールし、細胞の残骸を除去し、シナプスの調整を行い、神経栄養因子を供給する。しかし、神経細胞の炎症や傷害、神経変性疾患によって活性化されると、ミクログリアは遺伝子の発現や形態を劇的に変化させ、アメーバ状の形状を示すようになる。このように活性化された状態では、反応性ミクログリアは組織のリモデリングを促進する貪食活性を示し、過剰に活性化されると、脳障害や神経変性の一因になると広く考えられている。
真核生物では、細胞の対称性の変化は、アクチンと微小管(MT)の細胞骨格の大規模な再編成と関連している。アクチンとアクチンをベースとするモータータンパク質はほとんどの細胞で対称性を崩すのに必要であるが、神経細胞の極性の決定は微小管と微小管関連タンパク質に依存している。
微小管は、α/β-チューブリンヘテロ二量体が頭部から尾部に向かうように配列した、本質的に極性を持ったポリマーである。微小管は、高速で成長するプラス端と、低速で成長するマイナス端によって特徴付けられ、非神経細胞では、微小管組織化センター(MTOC)として働く中心体に付着していることが多い。方向性をもった輸送は、微小管の構造的極性によって可能になる。この極性は、マイナス端(ダイニン)またはプラス端(ほとんどのキネシン)のどちらかに輸送を駆動するモータータンパク質によって認識される(総説については、KlinmanとHolzbaurおよびReck-Petersenらを参照)。微小管は一般に、重合から脱重合への確率的な遷移(カタストロフィーイベント)、およびその逆(レスキューイベント)を常に繰り返す非常に動的な構造であり、2つの動的状態は特徴的な成長または収縮の速度を示す。安定化されると、微小管は分解に抵抗性を示し、α-またはβ-チューブリンサブユニット上に分子部位を付加するチューブリン修飾酵素の基質となる。これらの修飾の組み合わせにより、小器官の輸送やMT格子の力学的特性など、様々な機能を制御する「チューブリン・コード」が提供される(総説については、Gadadharら、Janke and Magiera、Janke and Bulinskiを参照してほしい)。
細胞極性の確立は、セントロソームの再配置、あるいは微小管がセントロソームで優先的に核形成されない非ラジアルMTアレイの形成によって達成される。この遷移の間、一般的にセントロソームは最大のMT核形成活性を失う一方、セントロソームから離れた細胞内膜やMT核形成物質の自己組織化集合体が非セントロソームMTOCとして機能し、カルモジュリン制御スペクトリン関連タンパク質(CAMSAP)ファミリーのメンバーが、遊離したMTのマイナス末端にしばしばキャッピングを行い、安定化させる。非セントロソームMTの局所的安定化と、MTOCのセントロソームや細胞中心からの再配置は、細胞分化に重要な非対称MTアレイを確立する。
我々は、ミクログリアが監視/恒常性状態から反応性状態へと移行する際の形態学的変化に、微小管細胞骨格の再配列が必要なのではないかと考えた。ここでは、活性化ミクログリアが、恒常性状態における平行で安定した微小管の非セントロゾームアレイから、すべてのMTのマイナス端がペリセントロゾーム領域に固定された、より動的なMTの放射状アレイへとMTが移行するユニークな例に関わっていることを示す。さらに、恒常性状態では、ゴルジ体の前哨基地が非セントロソームMT核形成の場であること、活性化チャレンジが、MTの安定化によって抑制されるプロセスであるペリセントリオーラ物質(PCM)のセントロソームへの動員をもたらすことを見出した。我々の結果は、活性化ミクログリアにおけるMT細胞骨格のユニークな再配列を明らかにし、ペリセントリオーラ物質の再局在化と集合が、組織におけるミクログリアの反応性の動態を観察する手段を提供する一方で、微小管動態の阻害が、炎症性疾患におけるミクログリア治療の潜在的な標的となる可能性を示している。
Discussion
混合極性の MT の非中心体配列から、すべての MT が均一に配向され、中心体または中心体周辺 MTOC に固定されている放射状配列への MT 再編成のこれまでにないユニークな例を同定した。 さらに、我々の構造的、機能的、組織的解析から、ゴルジ体前哨部における前中心体MT核形成がミクログリア細胞のパトロール表現型の支持に重要な役割を果たすこと、チューブリンリモデリングがin vitroおよび組織におけるミクログリア反応性を可能にすること、反応性ミクログリアにおけるPCM成熟を標的とすることが、ミクログリオシスが神経損傷および認知機能低下に寄与する神経変性疾患中の組織損傷を抑える有効なアプローチとなる可能性があることがわかった。さらに、神経障害性疼痛の寛解と再発における脊髄CD11c+ミクログリア集団の役割が最近明らかになったことから、化学療法剤による末梢神経障害における脊髄ミクログリア微小管機能不全の寄与を明らかにすることが重要になるであろう(その多くはMT細胞骨格を標的とする)。

“Journal Club (February 15, 2023)” への2件のフィードバック