Experimental & Molecular Medicine volume 54, pages2200–2209 (2022)
Open Access Published: 12 December 2022

Phenotype-based screening rediscovered benzopyran-embedded microtubule inhibitors as anti-neuroinflammatory agents by modulating the tubulin–p65 interaction (表現型に基づくスクリーニングにより、チューブリン-p65相互作用の調節による抗神経炎症剤としてのベンゾピラン包接型微小管阻害剤を再発見した)
Junhyeong Yim, Jaeseok Lee, Sihyeong Yi, Ja Young Koo, Sangmi Oh, Hankum Park, Seong Soon Kim, Myung Ae Bae, Jongmin Park & Seung Bum Par
Affiliations
1Department of Biophysics and Chemical Biology, Seoul National University, Seoul, 08826, Korea.
2Department of Chemistry, Kangwon National University, Chuncheon, 24341, Korea.
3CRI Center for Chemical Proteomics, Department of Chemistry, Seoul National University, Seoul, 08826, Korea.
4Department of Dental Sciences, School of Dentistry and Dental Research Institute, Seoul National University, Seoul, 08826, Korea.
5Bio Platform Technology Research Center, Korea Research Institute of Chemical Technology, Daejeon, 34114, Korea.
6Department of Medicinal Chemistry and Pharmacology, University of Science & Technology, Daejeon, 34114, Korea.
7Department of Chemistry, Kangwon National University, Chuncheon, 24341, Korea. jpark@kangwon.ac.kr.
8Kangwon Institute of Inclusive Technology, Kangwon National University, Chuncheon, 24341, Korea. jpark@kangwon.ac.kr.
9Department of Biophysics and Chemical Biology, Seoul National University, Seoul, 08826, Korea. sbpark@snu.ac.kr.
10CRI Center for Chemical Proteomics, Department of Chemistry, Seoul National University, Seoul, 08826, Korea. sbpark@snu.ac.kr.
〇Experimental&Molecular Medicine impact factor = 8.718
〇表現型スクリーニングー生物学的研究や創薬に用いられるスクリーニングの一種で、細胞や生物の表現型を所望の形で変化させる低分子、ペプチド、RNAiなどの物質を同定するためのものである。表現型スクリーニングへの動物ベースのアプローチは、何千もの低分子を含むライブラリをスクリーニングには適していない。そのため、これらのアプローチでは、すでに承認された薬物や、ドラッグリポジショニング(薬効再評価)のための後期ステージにある薬物候補を評価する上で有用性を見いだした(Wikipedia)。
Abstract
Neuroinflammation is one of the critical processes implicated in central nervous system (CNS) diseases. Therefore, alleviating neuroinflammation has been highlighted as a therapeutic strategy for treating CNS disorders. However, the complexity of neuroinflammatory processes and poor drug transport to the brain are considerable hurdles to the efficient control of neuroinflammation using small-molecule therapeutics. Thus, there is a significant demand for new chemical entities (NCEs) targeting neuroinflammation. Herein, we rediscovered benzopyran-embedded tubulin inhibitor 1 as an anti-neuroinflammatory agent via phenotype-based screening. A competitive photoaffinity labeling study revealed that compound 1 binds to tubulin at the colchicine-binding site. Structure–activity relationship analysis of 1’s analogs identified SB26019 as a lead compound with enhanced anti-neuroinflammatory efficacy. Mechanistic studies revealed that upregulation of the tubulin monomer was critical for the anti-neuroinflammatory activity of SB26019. We serendipitously found that the tubulin monomer recruits p65, inhibiting its translocation from the cytosol to the nucleus and blocking NF-κB-mediated inflammatory pathways. Further in vivo validation using a neuroinflammation mouse model demonstrated that SB26019 suppressed microglial activation by downregulating lba-1 and proinflammatory cytokines. Intraperitoneal administration of SB26019 showed its therapeutic potential as an NCE for successful anti-neuroinflammatory regulation. Along with the recent growing demands on tubulin modulators for treating various inflammatory diseases, our results suggest that colchicine-binding site-specific modulation of tubulins can be a potential strategy for preventing neuroinflammation and treating CNS diseases.
神経炎症は、中枢神経系疾患に関与する重要なプロセスの1つである。したがって、神経炎症を緩和することは、中枢神経系疾患の治療戦略として注目されている。しかし、神経炎症過程の複雑さや脳への薬物輸送の難しさが、低分子治療薬を用いて神経炎症を効率的に制御する上での大きな障害となっています。このため、神経炎症を標的とした新規化学物質(NCEs)の開発が求められている。ここでは、表現型に基づくスクリーニングにより、ベンゾピラン包接型チューブリン阻害剤1を抗神経炎症剤として再発見した。競合的光親和性標識法により、化合物1がコルヒチン結合部位でチューブリンに結合することを明らかにした。1のアナログの構造活性相関解析により、SB26019が抗神経炎効果を増強するリード化合物であることが判明しました。その結果、SB26019の抗神経炎作用には、チューブリン単量体のアップレギュレーションが重要であることが明らかになった。また、偶然にも、チューブリン単量体がp65をリクルートし、細胞質から核への移行を阻害し、NF-κBを介した炎症経路をブロックすることを発見した。さらに、神経炎症マウスモデルを用いたin vivo検証では、SB26019がlba-1と炎症性サイトカインを減少することにより、ミクログリアの活性化を抑制することが示された。SB26019の腹腔内投与は、抗神経炎症制御を成功させるためのNCEとしての治療の可能性を示した。近年、様々な炎症性疾患の治療においてチューブリン調節物質に対する需要が高まっており、今回の結果は、コルヒチン結合部位特異的なチューブリン調節が神経炎症の予防および中枢神経系疾患の治療のための戦略として可能であることを示唆している。
Editorial Summary
Neurodegeneration: A new approach to reduce brain inflammation
A screen for compounds that reduce inflammation in the brain has identified an effective compound with an unexpected mode of action, potentially opening a new therapeutic avenue for neurodegenerative diseases. Neuroinflammation contributes to the pathology of diseases like Alzheimer’s and Parkinson’s, but researchers have struggled to develop drugs targeting such inflammation. South Korean researchers led by Seung Bum Park of Seoul National University and Jongmin Park of Kangwon National University, Chuncheon, screened chemical compounds to identify those that mitigate the inflammatory response in cultured brain immune cells. They detected a compound that inhibits inflammation by disrupting the assembly of microtubules, multi-protein fibers that contribute to cellular infrastructure. Although this mechanism was unexpected, the researchers validated their findings in a mouse model of neuroinflammation, suggesting that this cellular pathway could offer a viable drug target.
神経変性 脳の炎症を抑える新しいアプローチ
脳の炎症を抑える化合物のスクリーニングにより、予想外の作用機序を持つ有効な化合物が同定され、神経変性疾患に対する新しい治療法の道が開かれる可能性が出てきた。神経炎症は、アルツハイマー病やパーキンソン病などの疾患の病態に関与しているが、研究者たちは、このような炎症を標的とした薬剤の開発に苦心してきた。ソウル大学のSeung Bum Park教授とKangwon National University, Chuncheon (江原大学校 春川キャンパス) のJongmin Park教授率いる韓国の研究者たちは、培養した脳免疫細胞の炎症反応を緩和する化合物をスクリーニングした結果、このような化合物を発見した。その結果、細胞基盤を構成する多タンパク質繊維である微小管の集合を阻害することにより、炎症を抑制する化合物を発見した。このメカニズムは予想外だったが、研究者らは神経炎症モデルマウスでこの知見を検証し、この細胞経路が有効な創薬ターゲットになる可能性を示唆した。
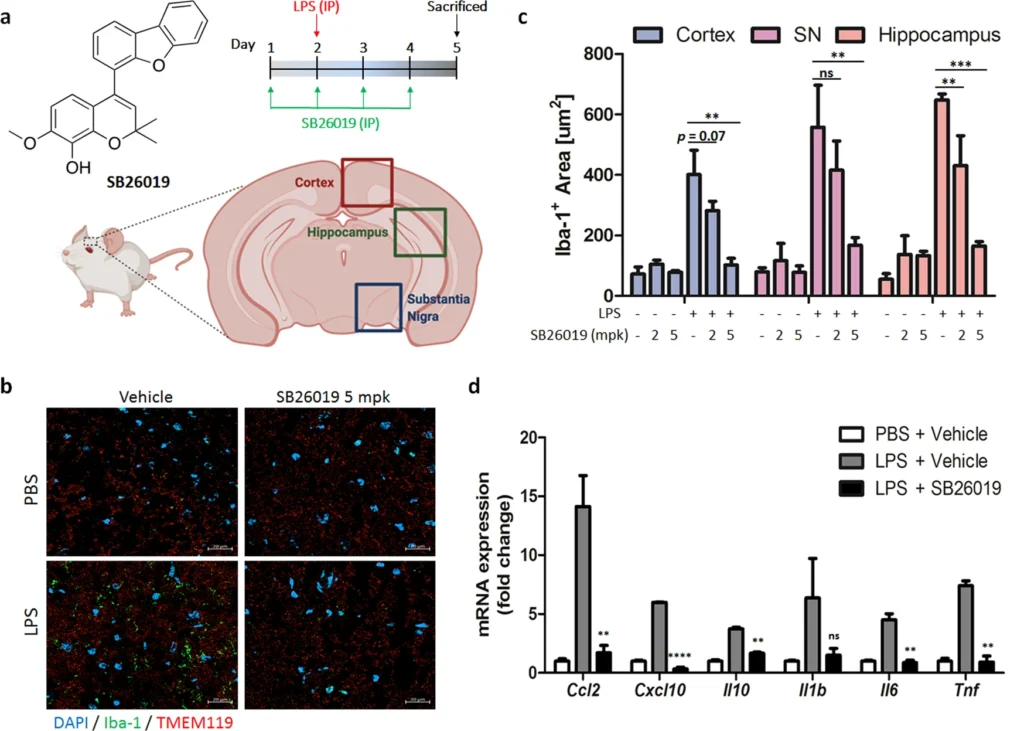
Discussiion
チューブリン調節薬は、その細胞毒性から主に抗がん剤と考えられてきたが、コルヒチンは、前述のように、痛風および家族性地中海熱の治療薬として承認されている。また、コルヒチンはベーチェット病の治療薬や心臓手術後の心房細動の予防薬として試験された。さらに、COVID-1930,31,32や心血管疾患に対する抗炎症試薬としてコルヒチンに注目が集まっている。このように、様々な炎症性疾患や肝細胞を介した骨髄系細胞の不活性化に対するチューブリン調節剤が最近見直されていることを考えると、神経炎症はコルヒチン結合部位特異的チューブリン調節剤を使って探索すべき新しい領域であると考えられる。したがって、神経炎症過程の複雑さや血液脳関門による脳への薬物輸送の悪さを克服し、神経変性疾患治療のためのチューブリン標的NCEsの開発につなげるためには、様々なタイプのチューブリン調節因子を発見することが必要不可欠である。今回の成果は、コルヒチン結合部位特異的なチューブリン調節剤を抗神経炎薬として開発する道を開くものと考えている。
〇痛風・尿酸ニュース古い薬のコルヒチンが現代の新しい治療に?
〇微小管を介して誘導される炎症応答の分子機序解明と統御法開発
JournalClub_Kanamaru_20230213
“Journal Club (February 13, 2023)” への1件のフィードバック