Nature Communications volume 14, Article number: 6322 (2023)
Polarized microtubule remodeling transforms the morphology of reactive microglia and drives cytokine release (極性をもった微小管リモデリングが反応性ミクログリアの形態を変化させ、サイトカイン放出を促進する)
Max Adrian, Martin Weber, Ming-Chi Tsai, Caspar Glock, Olga I. Kahn, Lilian Phu, Tommy K. Cheung, William J. Meilandt, Christopher M. Rose & Casper C. Hoogenraad
Department of Neuroscience, Genentech, Inc., South San Francisco, CA, 94080, USA
ジェネンテック inc (Genentech inc.) は、アメリカカリフォルニア州サンフランシスコに本社を置くバイオベンチャー企業のパイオニアである。バイオベンチャーとしてはアムジェンに次ぐ世界二位の売上規模を誇り、日本最大の製薬会社である武田薬品工業を上回る。1990年からロシュ傘下にあったが、2009年に総額468億ドルで完全子会社化された(2002年に中外製薬もロシュ傘下になった)。(Wikipedia)
Abstract
Microglial reactivity is a pathological hallmark in many neurodegenerative diseases. During stimulation, microglia undergo complex morphological changes, including loss of their characteristic ramified morphology, which is routinely used to detect and quantify inflammation in the brain. However, the underlying molecular mechanisms and the relation between microglial morphology and their pathophysiological function are unknown. Here, proteomic profiling of lipopolysaccharide (LPS)-reactive microglia identifies microtubule remodeling pathways as an early factor that drives the morphological change and subsequently controls cytokine responses. We find that LPS-reactive microglia reorganize their microtubules to form a stable and centrosomally-anchored array to facilitate efficient cytokine trafficking and release. We identify cyclin-dependent kinase 1 (Cdk-1) as a critical upstream regulator of microtubule remodeling and morphological change in-vitro and in-situ. Cdk-1 inhibition also rescues tau and amyloid fibril-induced morphology changes. These results demonstrate a critical role for microtubule dynamics and reorganization in microglial reactivity and modulating cytokine-mediated inflammatory responses.
ミクログリア反応性は、多くの神経変性疾患における病理学的特徴である。刺激中、ミクログリアはその特徴である突起形態を失うなど、複雑な形態変化を起こす。しかし、その根底にある分子メカニズムや、ミクログリアの形態と病態生理学的機能との関連は不明である。この論文では、リポ多糖(LPS)反応性ミクログリアのプロテオミクスプロファイリングから、微小管リモデリング経路が、形態変化を引き起こし、その後サイトカイン応答を制御する初期因子であることが明らかになった。我々は、LPSに反応したミクログリアが微小管を再編成し、安定で中心体に固定されたアレイを形成することで、サイトカインの効率的な輸送と放出を促進することを発見した。我々は、微小管リモデリングと形態変化の重要な上流制御因子として、サイクリン依存性キナーゼ1(Cdk-1)をin-vitroおよびin-situで同定した。Cdk-1を阻害すると、タウやアミロイド線維による形態変化も抑制される。これらの結果は、ミクログリアの反応性とサイトカインが介在する炎症反応の調節において、微小管の動態と再編成が重要な役割を果たしていることを示している。
Introduction
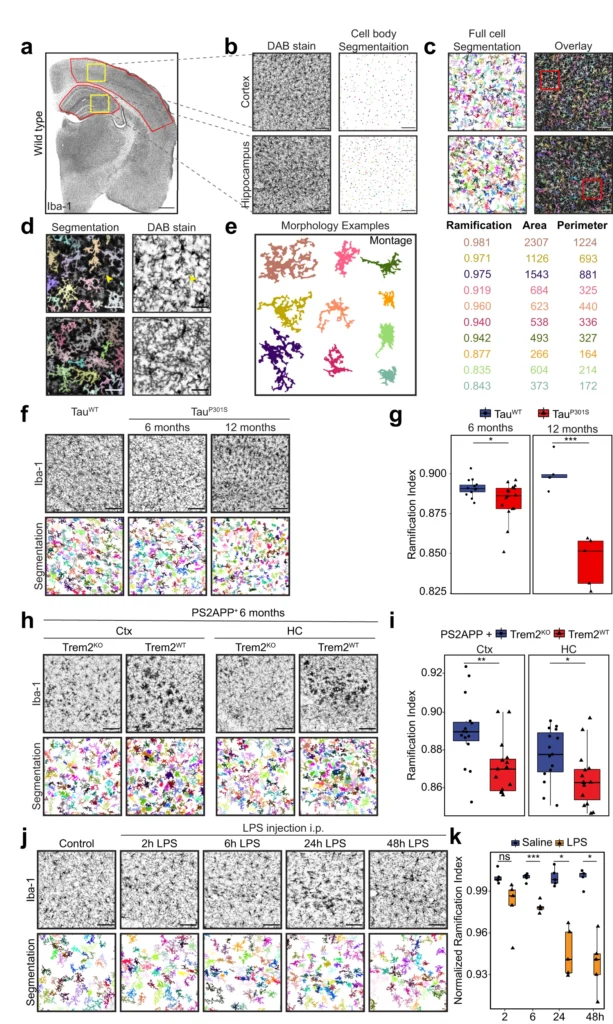
ミクログリアは脳の組織に常在するマクロファージであり、組織の恒常性の維持に重要な役割を果たしている。ミクログリアは、その環境に応じて、正常な脳の発達におけるシナプス刈り込みや神経回路のリモデリングから、自閉症スペクトラム障害、統合失調症、さまざまな神経変性疾患における病的作用まで、さまざまな役割を担っている。最近、脳疾患におけるミクログリアの多様な機能を説明しうる、ミクログリアのさまざまな活性状態を解明する研究がいくつか始まっている。反応性ミクログリアは病変部位に集積し、死細胞、タンパク質凝集塊、その他の細胞残屑の除去に関与する保護機能を実行する。一方、炎症性メディエーターの過剰産生を伴うミクログリアの持続的あるいは慢性的な過剰刺激は、有害な神経炎症につながる可能性がある。組織学的に、恒常性ミクログリアと反応性ミクログリアの最も顕著な違いは、細胞形態の明確な変化であり、数十年にわたって患者やin vivoモデルにおけるミクログリアの反応性を測定するために用いられてきた。重要なことは、ミクログリアの形態は、遭遇する刺激の種類や脳内の位置に特異的であるということである。しかし、ミクログリアの形態学的変化と機能的変化の間の細胞生物学的関連は、包括的に研究されていない。
そのタイル状の領域内(一つのミクログリアがカバーする領域内)では、恒常性ミクログリアは、その近傍にある他のすべての細胞型と接触するダイナミックな隆起を持ち、そのような広範な結合によって、安静時ミクログリアは、危険シグナルを組織内に監視する優れた監視員となっている。ミクログリアが刺激されると、細胞の突起は劇的に消失し、ミクログリアはアメーバ状となり、運動性を示すようになる。細胞形態の変化は、根底にあるアクチンや微小管の細胞骨格組織の再配列の結果である。これまでのところ、恒常性ミクログリアと反応性ミクログリアにおける細胞骨格ダイナミクスの理解は非常に限られている。
微小管は、ニューロンやオリゴデンドロサイトを含む中枢神経系の多くの細胞において、運動性、細胞内輸送、細胞形状の維持などの細胞プロセスに関与している。微小管は、in vivoでのミクログリアの分岐形態に必須であることが示されている。しかし、ミクログリアの反応性における微小管動態の役割については、ほとんど知られていない。反応性ミクログリアは、in vitroでは安静時ミクログリア(ラミファイド型ミクログリア)よりも密度が低い微小管組織を持っている。その微小管は細胞質全体に伸びており、微小管組織化センター(MTOC)での翻訳後アセチル化によって安定化される。最近では、ミクログリアの分岐点にあるゴルジ体のoutpostsが、恒常性ミクログリアにおいて微小管の核形成に関与していることが示されている。しかし、ミクログリアが反応する過程で、どのような因子や経路が微小管形成に関与しているのか、また、これらの細胞骨格の再配列がミクログリアの機能とどのように関連しているのかは、依然として不明である。
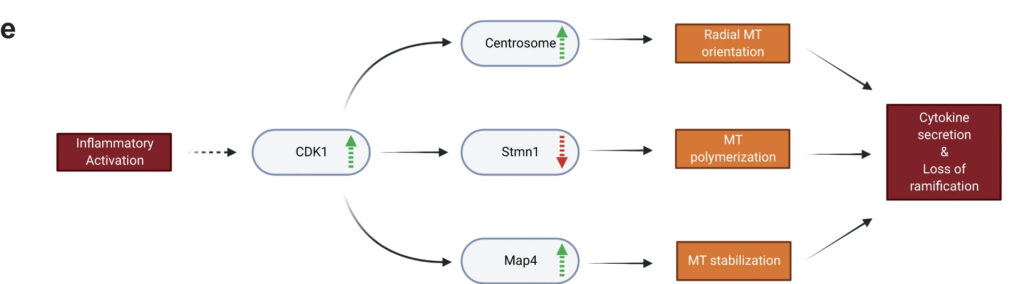
この論文では、反応性ミクログリアの初期形態変化、その根底にある細胞骨格の再配列、そして炎症反応との関連について研究する。ミクログリア細胞の形態は、刺激時に高度に制御される動的微小管に依存していることがわかった。ミクログリアは、中心体を活性化し、ゴルジ体を介した微小管重合を抑制することによって、微小管を放射状の配列に再編成する。さらに反応性ミクログリアでは、微小管重合はStathmin 1(Stmn1)のdownregulationによって促進され、微小管の安定化は微小管関連タンパク質4(Map4)によって媒介される。この3つの経路はすべて、細胞分裂がない状態で、サイクリン依存性キナーゼ1(Cdk1)の活性化によって駆動される。Cdk1活性は、急性脳スライスにおける反応性ミクログリアのアメーバ細胞形態と、サイトカインの効率的な輸送と放出に必要である。全体として、本研究は、微小管リモデリングが恒常性ミクログリアを反応性アメーバ状態に変化させ、サイトカインを介する炎症反応を促進するのに必要であることを明らかにした。
Discussion
反応性ミクログリア細胞は、多くの神経疾患や神経変性疾患において重要な構成要素であり、疾患の転帰を予測したり修正したりするために広く研究されている。しかし、ミクログリアの反応性の根底にある分子過程やメカニズムは、これまでほとんど検討されてこなかった。本研究では、最初のミクログリア刺激によってCdk1シグナル伝達が起こり、それが中心体の成熟、Stmn1のダウンレギュレーション、Map4の活性化を引き起こし、それらが微小管のリモデリング、重合、安定化を媒介するというモデルを提案する(図7e)。LPSに反応したミクログリアにおける微小管の再編成は、サイトカインの細胞膜への輸送を促進し、in vivoでのミクログリア反応性に特徴的な形態学的変化を誘導することによって、効率的なサイトカイン分泌に寄与している。
極性微小管リモデリングが反応性ミクログリア細胞の形態変化を引き起こす
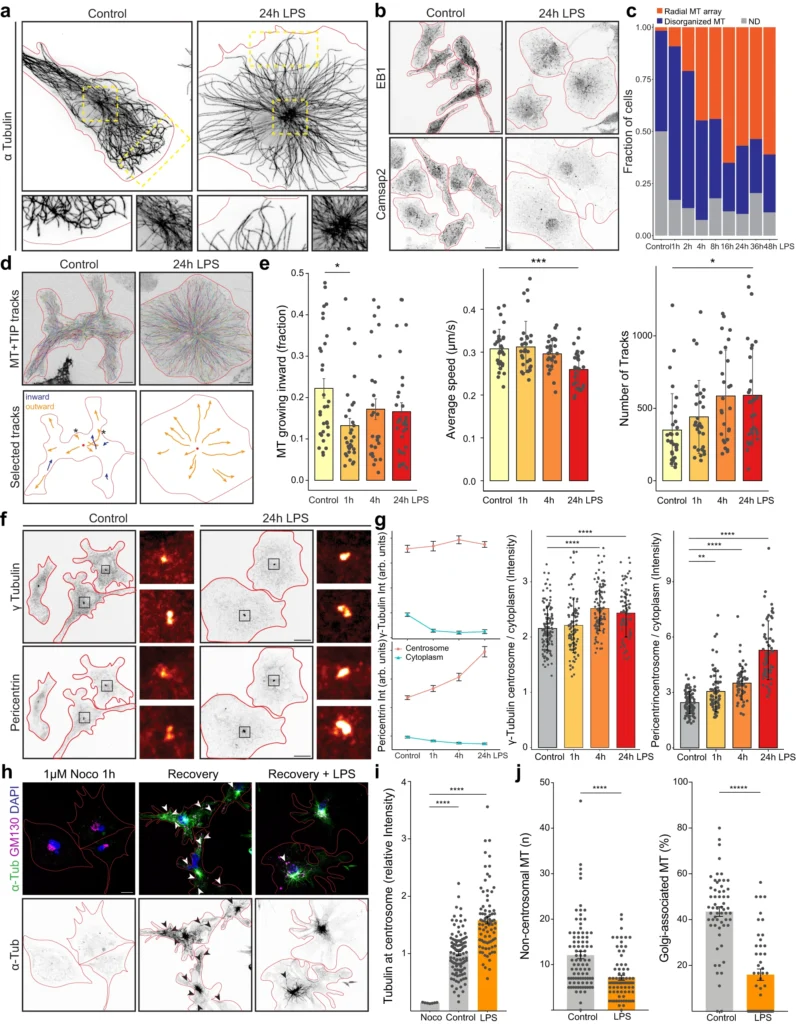
本研究では、微小管リモデリング経路が、LPS反応性ミクログリア細胞の形態変化を引き起こす初期因子であることを明らかにした。細胞骨格をリモデリングし、放射状の微小管アレイを構築するために反応性ミクログリアが採用するメカニズムは、少なくとも次の3つの部分から構成されていることがわかった:(1)チューブリン封鎖因子Stathmin 1のダウンレギュレーションによって、遊離チューブリンからより多くの微小管が重合される。(3) 結果として生じる微小管ネットワークは、Map4のリクルートとMTOC (microtubule organizing center )での微小管のアセチル化によって安定化される。これらの平行した経路が組み合わさることで、放射状の微小管配列が構築・維持され、後述する機能的変化を促進することができる。我々はまた、プロテオミクスと機能アッセイの両方を用いた時間経過研究を通して、これらの事象の時間的順序を研究した。ゴルジ体を介した微小管重合から中心体核形成への転換は、MT+TIPの追跡によって明らかなように急速であり、LPS刺激後1時間以内に完全な効果に達した。24時間以上にわたってペリセントリンが中心体に蓄積し続けたことから、これらの細胞におけるMTOCの活性化は迅速かつ持続的である。測定されたMT+TIPトラック数は、LPS刺激から4時間後にピークに達し、その時点でサイトカイン分泌が劇的に増加し始め、細胞形態はよりアメーバ状になった。我々は、中心体からの微小管の迅速な核形成が、サイトカイン分泌を促進するために微小管を放射状配列に再配列させる鍵となると仮定した。微小管重合におけるこの最初のスパートの後、反応細胞は新たな定常状態に入り、放射状配列を維持し安定化させるが、新たな微小管の成長は減少する。われわれのモデルは、LPS刺激後に中心体の活性化を示す骨髄由来のマクロファージや、ミクログリア細胞における最近の研究のデータと一致している。しかし、どちらの研究でも、今回明らかになったような根本的な分子経路を説明することはできなかった。今回の結果は、Stathmin 1の過剰発現がマクロファージの反応性を低下させる理由の説明にも役立つかもしれない。オリゴデンドロサイトや他の脳細胞タイプのゴルジ体のoutpostsは、その形態と機能の維持に重要であることが示されている。現在では、これらのゴルジのoutpostsがLPS反応時にミクログリアで消失することが示されており、ゴルジ由来の微小管が消失するという我々の観察結果を裏付けている。これらと我々の研究はまた、in situでのミクログリア細胞の挙動と形態を忠実に模倣したミクログリア細胞生物学のin vitroモデルを開発する必要性を浮き彫りにしており、より洗練された初代ミクログリア培養やiPSC由来のミクログリア培養の出現によって、この分野が急速に進歩することを期待している。
微小管リモデリングは反応性ミクログリアにおけるサイトカイン応答を制御する
筆者らは、LPSに反応したミクログリアにおける微小管の再配列が、細胞の形態変化とサイトカインの放出の両方に必要であることを発見した。われわれのデータは、微小管細胞骨格の動態が、細胞膜への小胞輸送と細胞膜からの小胞輸送を促進することによって、ミクログリアの反応性を促進していることを示唆している。マクロファージにおける研究では、サイトカインとアポリポタンパク質Eの分泌は、微小管を介して細胞表面に輸送される必要のある小胞から起こることが示されている。MMP9メタロプロテアーゼの放出もこのように制御されており、MMP9を含む小胞は安定化した微小管に沿って輸送されることを好む49。さらに、マクロファージでは、タキソールによる微小管の安定化が、LPS刺激後のインフラマソームの活性化とIL-1bの放出をさらに促進した。微小管が安定した放射状のアレイに配列することで、これらの機能が促進されるという今回の発見は、細胞骨格が細胞機能にどのような影響を及ぼすかを説明するものである。微小管のプラス端が末梢に向かって伸びることで、キネシンを駆動源とする分泌小胞は、細胞膜に向かう直接的な早道を持つようになる。さらにこのモデルは、初期のエンドサイトーシス小胞やファゴソームが、ダイニンを介した微小管輸送によって核周辺腔まで運ばれ、そこでリソソームコンパートメントと融合するという観察結果とも合致する。興味深いことに、サイトカインのエキソサイトーシスと細胞膜でのファゴソーム形成のプロセスは連動しており、マクロファージとミクログリアにおける小胞輸送の高度な連携を示唆している。このような協調は、キネシンやダイニン駆動の小胞に明確な細胞内行き先を割り当てる、均一な放射状の微小管配列によって強く促進されることは明らかである。最後に、微小管細胞骨格がミクログリアの反応性に関与するというわれわれのモデルは、微小管を標的とする薬剤が神経変性疾患の転帰を調節するというin vivoの研究とも合致する: 我々のデータは、微小管ダイナミクスを阻害することで、初代培養におけるミクログリアの反応性とサイトカイン放出が強く抑制されたことを示している。これらの知見は、微小管安定化剤であるエポチロンDが、パーキンソン病モデルにおいてミクログリアの反応性を全体的に抑制した理由を説明する一助になるかもしれない57。微小管ダイナミクスを標的とすることで、ミクログリアの刺激によって活性化される多くの経路を解明できる可能性があり、疾患の転帰を調節するための関連性を検証する研究がさらに増えることを期待している。
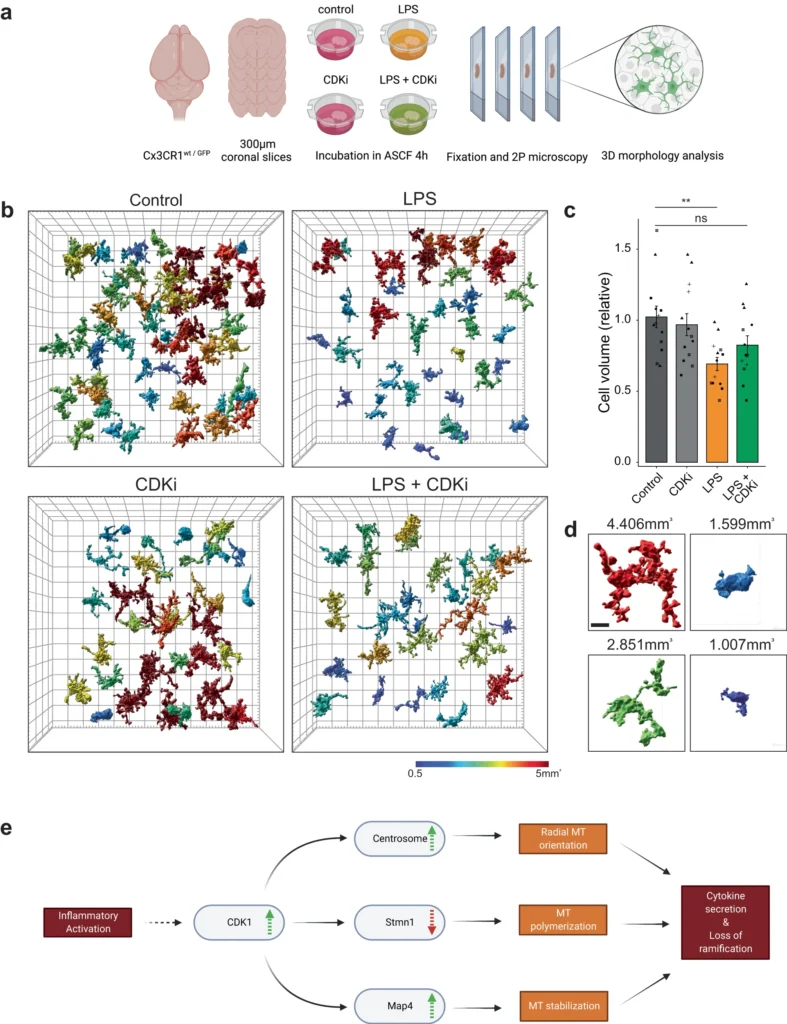
Cdk1は微小管リモデリングと形態変化の上流制御因子である
筆者らは、刺激されたミクログリアにおいて、微小管の安定化、中心体の核形成、サイトカインの輸送が、Cdk1キナーゼの上流活性化によって制御されていることを明らかにした。また、LPS、アミロイドβ、TauP301S線維に対する形態学的変化が、Cdk1の活性化に依存していることも明らかにした。培養ミクログリアは非増殖性であるため、有糸分裂における微小管ダイナミクスとミクログリアの反応性には類似性があるはずであり、両過程におけるCdk1の共通の役割を支持するものである。有糸分裂では、分離した中心体が微小管の唯一の核形成因子となり、2つの放射状微小管クラスターが形成される。さらに、有糸分裂の微小管は動原体が捕捉されると安定化する。Cdk1は有糸分裂の紡錘体の制御において重要な役割を担っており、刺激されたミクログリアにおいても、有糸分裂中にPolo様キナーゼによって駆動される中心小体の分離がない場合に、単一の放射状配列につながる同様の機能を持つことが考えられる。われわれのCdk1阻害実験は、in vitroとin situの両方で、サイトカイン放出と形態変化に対して用量依存的な効果を示した。これはCdk1依存的なMap4のリン酸化を示した以前の研究と一致するが、Map4のリン酸化には別のシグナル伝達因子が関与していることも考えられる。Stmn1のSer38上の阻害性リン酸化は、以前にCdk1の直接的な標的であり、Cdk1活性によって制御されることが示されており、今回の研究と一致している。まとめると、ミクログリア刺激に関連してCdk1の非有糸分裂的役割が新たに見つかったことは興味深く、in vivo神経変性疾患モデルにおけるCdk1阻害の効果を明らかにすることは貴重であろう。
