
Cell 2022 Dec 22;185(26):4869-4872. doi: 10.1016/j.cell.2022.11.020.
Studying human neural function in vivo at the cellular level: Chasing chimeras? (ヒトの神経機能をin vivoで細胞レベルで研究する。キメラを追い求める?)
Ben Vermaercke 1, Vincent Bonin 2, Pierre Vanderhaeghen 3
- 1VIB-KU Leuven Center for Brain & Disease Research, 3000 Leuven, Belgium; Department of Neurosciences, Leuven Brain Institute, KU Leuven, 3000 Leuven, Belgium; Neuro-Electronics Research Flanders, Kapeldreef 75, 3001 Leuven, Belgium. ルーヴェン脳研究所
- 2Neuro-Electronics Research Flanders, Kapeldreef 75, 3001 Leuven, Belgium; Department of Biology, Leuven Brain Institute, KU Leuven, 3000 Leuven, Belgium; imec, 3001 Leuven, Belgium.
- 3VIB-KU Leuven Center for Brain & Disease Research, 3000 Leuven, Belgium; Department of Neurosciences, Leuven Brain Institute, KU Leuven, 3000 Leuven, Belgium; IRIBHM, ULB Neuroscience Institute, Université Libre de Bruxelles, B-1070 Belgium. Electronic address: pierre.vanderhaeghen@kuleuven.be.
ルーヴェンは、ベルギーのフラームス=ブラバント州の州都である。(wikipedia)
PMID: 36563661 DOI: 10.1016/j.cell.2022.11.020

移植は、実験生物学における手段の一つであり、発生学の基本原理を明らかにするものだった。先駆的な実験では、移植片と宿主細胞に異なる種が用いられ、結果として得られる単一生物(「種間キメラ」)の異なる細胞集団の同定が容易に行われた。最近では、ヒト多能性幹細胞(PSC)由来の神経細胞をネズミの脳に異種移植することで、ヒトの神経細胞の発生と機能を調べることができるようになった。異種移植研究により、ヒト大脳皮質神経細胞の発達が長いなど、種特異的特性が明らかになり、神経修復にヒト神経細胞を移植する可能性が示された。
Revahら7名は、Nature誌で、ヒト多能性幹細胞を大脳皮質オルガノイドに分化させた後、仔ラットの大脳皮質に移植するモデルを開発した(図1)。数カ月間にわたる神経細胞の発達を、単一細胞のトランスクリプトーム解析から機能解析まで幅広く行い、試験管内で培養した同様の大脳皮質オルガノイドで観察されるよりもはるかに高いレベルで、神経細胞の発達と統合の複雑なパターンが明らかにされた。さらに、移植されたオルガノイドのニューロンは、成人のヒトの脳で見られる神経細胞のサブタイプに近いことがわかり、神経細胞のアイデンティティーの特定は、生体内にのみ見られるメカニズムに依存している可能性が示唆された。移植されたヒトオルガノイドの神経細胞は、層や領野といった特定の空間構成を示さなかったが、このことは、何らかの仕様と成熟が達成されることを妨げるものではない。
移植されたヒト由来ニューロンは、胚後期から生後初期に特徴的な未熟なパターンを思わせる自発的な同期活動を示し、約半数のヒトのニューロンでヒゲ刺激が感覚反応を引き起こしたことから、ホスト神経回路に接続し、そこからの入力を感知する能力があることが示された。逆に、移植されたオルガノイドのヒトニューロンも、ラットの脳に対して機能的な出力を示した。ヒトのニューロンを光遺伝学的に刺激すると、移植されたラットの行動に影響を与えることができた。このことは、これまでのオルガノイド移植実験と対照的である。これまでの実験では、移植片の統合と血管新生は成功したが、宿主との接続は低レベルにとどまった。これは、オルガノイドが新生児の脳ではなく成体の脳に移植されたためと思われる。
この研究は、ヒトの神経生物学を研究するための技術のレパートリーを増やすものである。これに匹敵する初期のアプローチでは、まずヒト皮質ニューロンをヒトPSCから2次元的に分化させ、分散ニューロンとして新生児マウス皮質の脳室内に移植している(図1)。異種移植されたニューロンは、その後、大脳皮質灰白質に移動・定着し、複雑な形態的・機能的特性を獲得する。ヒトの分散ニューロンは、オルガノイド由来のニューロンよりも高いレベルの結合性を示すと考えられている。例えば、視覚野に移植されたニューロンは、視覚パターンの方向に対する同調を示し、皮質回路への特異的な統合を反映している。ヒト由来分散培養ニューロンはまた、より大きな樹状突起と強固なシナプス可塑性を示し、オルガノイドグラフト内に集積する代わりに、ネズミの皮質に疎に移植することでより高レベルの接続性とホスト回路との成熟を得られることが示唆される。しかし、このモデルでは移植される神経細胞の数が少ない(数千)ため限界がある。一方、オルガノイド移植では、多くの(少なくとも100倍以上の)細胞にアクセスできるため、単一細胞のトランスクリプトミクスや潜在的にはプロテオミックや代謝プロファイリングなどのhigh-content molecular analysesが可能になる。また、オルガノイド移植モデルは、ヒト神経細胞間の相互作用の研究に適している。一方、分散ニューロンの移植は、移植された細胞のほとんどが宿主皮質とつながっていますが、他の移植ヒト神経細胞とつながることはほとんどないため、ヒト神経細胞の細胞自律性の研究により適している。
もう一つの重要な点は、マウスを宿主とした他の多くの研究とは異なり、Ravehたちは新生児ラット脳への移植を行ったことである。このため、小型のマウスでは不可能であった大きなオルガノイド構造の統合が容易になった。さらに、ラットはマウスよりも洗練された行動特性を示し、寿命も長い。これは、ヒトの大脳皮質ニューロンの発達が長期に及ぶことを考えると、重要な利点である。
一方、マウスへの異種移植は、確立されたトランスジェニックモデルを幅広く使用できるという利点があり、機構的または疾患特異的な洞察をさらに深めることができる可能性がある。例えば、アルツハイマー病のトランスジェニックマウスにヒト皮質ニューロンを異種移植したところ、生体内のアミロイド毒性に対するヒトニューロンの種特異的な感受性が明らかになった。
Ravehらの研究により、移植された細胞は、同じ初期条件で作製されたオルガノイドと比較して、転写、形態、機能的に高度であることが明らかになったが、in vitroで培養されたものである。次に、この新しいモデルを用いて、電位依存性カルシウムチャネル(CACNA1C)の変異によって引き起こされる神経発達障害であるティモシー症候群の研究を行った。対照群とCACNA1C変異PSCから得たオルガノイドを移植し比較したところ、in vitroでは検出されなかった表現型が検出された。特に、活性依存的なメカニズムに関連した樹状突起の形態異常が、in vitroの同じ変異型PSCのオルガノイドと比較して、移植環境下でより多く見られることがわかった。
しかし、何が原因で移植されたオルガノイドに違いが生じるのか、さらなる検討が必要である。移植細胞の宿主回路への統合は、血管やグリアから発せられる誘導シグナルの存在だけでなく、脳全体の回路への統合に関連する活動依存的なメカニズム、さらには栄養、代謝、行動、環境の影響によって左右される可能性がある。
全体として、異種移植モデル(オルガノイドまたは分散されたヒトニューロンを使用)は、生体内の神経回路の文脈で、健康な状態または病的な状態でヒト神経細胞を研究するための一連の新しいツールを提供する。しかし、in vitroの2Dおよび3Dモデルは、その高い汎用性とスループットから、特に遺伝子スクリーニングや多くのPSC株の並行使用を含むプロジェクトでは、今後も基本的な存在であり続けるだろう。最後に、移植されたヒト皮質ニューロンは、分化のパターンが進んでいるにもかかわらず、その発生時期が長いため、移植後何ヶ月経っても成熟した皮質ニューロンのすべての特徴を示すにはほど遠いということに留意することが重要である。結局のところ、還元主義的なin vitroモデルから動物モデルへの異種移植やex vivoでのヒト脳の探索といった補完的なアプローチを組み合わせることで、健康や病気におけるヒトの神経生物学を理解し、ヒトの脳を特徴づけるものを読み解くための新しい展望が開けるのである。
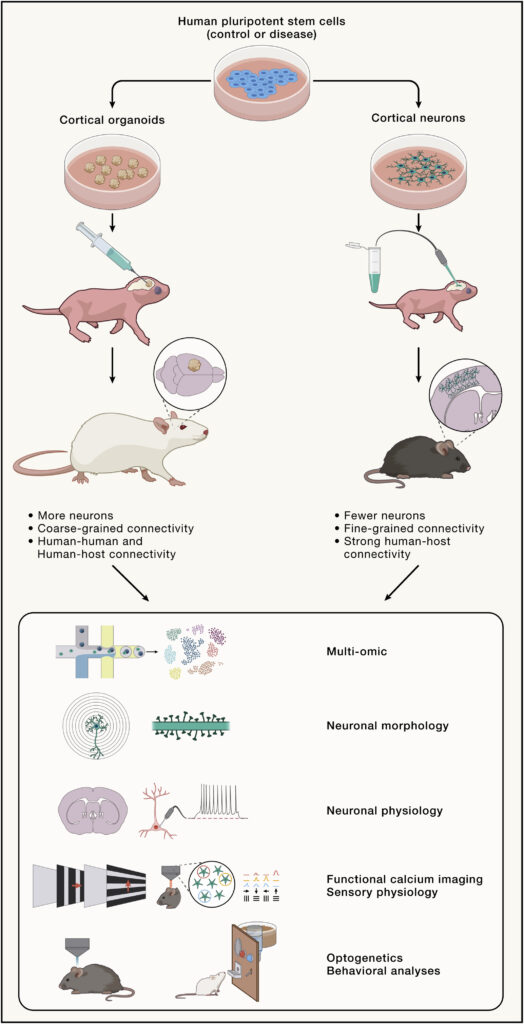
Figure 1. More ways to study human neurons in vivo
Human pluripotent stem cells (human PSC), whether derived from healthy donors or bearing pathogenic mutations, can be differentiated into cortical neurons using 2D cultures or 3D organoid models to model neural function and disease, but their level of maturation and functionality remains limited in vitro. To study human PSC-derived neurons in vivo, they can be transplanted into the neonatal rodent cortex, either as dissociated cortical neurons or cortical organoids. Each method has distinctive advantages and limitations, but together they both enable the study of transplanted neurons and their host at many levels, from molecular to behavioral, providing a unique experimental window to study human neurobiology in health and disease.
ヒト多能性幹細胞(PSC)は、健康なドナー由来であれ、病原性突然変異を持つものであれ、2次元培養や3次元オルガノイドモデルを用いて皮質ニューロンに分化させ、神経機能や疾患をモデル化することができるが、その成熟度や機能性はin vitroではまだ限定的である。ヒトPSC由来ニューロンを生体内で研究するには、分散した皮質ニューロンまたは皮質オルガノイドとして、新生仔げっ歯類の大脳皮質に移植することができる。それぞれの方法には独特の利点と限界があるが、両者を合わせると、移植された神経細胞とその宿主を分子レベルから行動レベルまで多くのレベルで研究することができ、健康や病気における人間の神経生物学を研究するためのユニークexperimental windowを提供することができるのである。
〇キメラ
生物学における キメラ (chimera) とは、同一の個体内に異なる遺伝情報を持つ細胞が混じっている状態や、そのような状態の個体のことをさす。キメラまたはキマイラ(Χίμαιρα, Chimaira) は、ギリシア神話に登場する怪物である。テューポーンとエキドナの娘であり、ライオンの頭と山羊の胴体、蛇の尻尾を持つ。ペガサスに乗る英雄ベレロポーン(ベレロフォン)により背中を矢で射られて退治されたとされる。(Wkipedia)

〇キメラとベレロフォンが登場する映画:M:I-2 / Mission: Impossible 2
2000年監督:ジョン・ウー 出演:トム・クルーズ、ダグレイ・スコット他
大手製薬会社バイオサイトの研究員ネコルヴィッチは、1日で人を死に至らしめるキメラウイルスとその治療薬であるベレロフォンを開発した。イーサン(クルーズ)はその護衛の任務を担当していたが、休暇中にCIAが替え玉として送った工作員アンブローズが裏切り、ウイルスと薬を奪ってしまう。狙いはウイルスを市中にばらまいて、治療薬で儲けることだった。
本日は、大掃除を行いました。実験室の埃を落とし、すっきりしました。生物学類のH.K.さんが大活躍しました。体育専門学群のY.K.さんが12月をもって、当研究室のジャーナルクラブを卒業されました。毎回、入念に準備された論文紹介をしてくれました。新しい場所でのご活躍を期待しています!
