Journal of Neuroscience 10 July 2013, 33 (28) 11329-11345; DOI: https://doi.org/10.1523/JNEUROSCI.5221-12.2013
Articles, Development/Plasticity/Repair
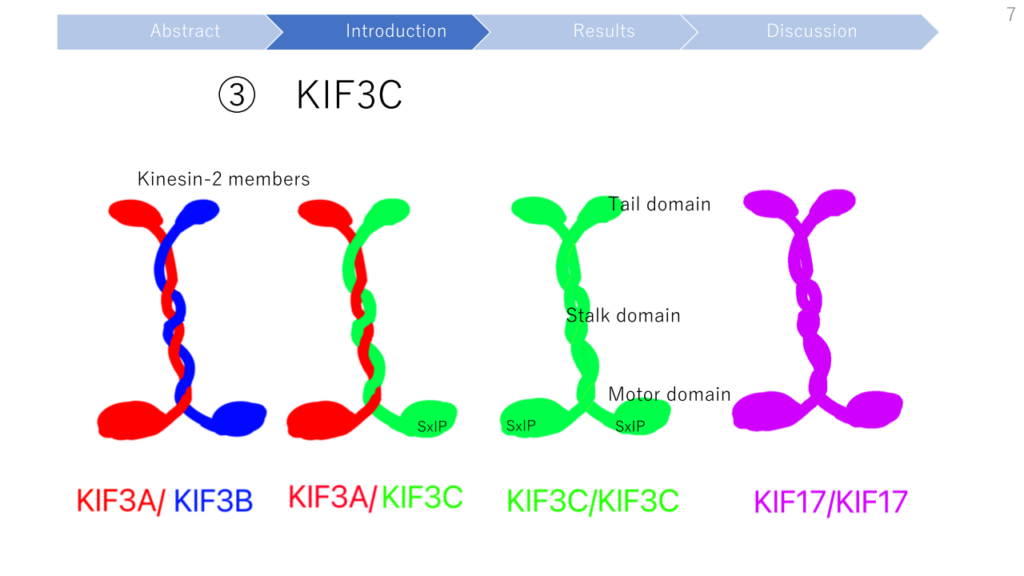
The Kinesin-2 Family Member KIF3C Regulates Microtubule Dynamics and Is Required for Axon Growth and Regeneration (キネシン-2ファミリーメンバーKIF3Cは微小管ダイナミクスを制御し、軸索の成長と再生に必要である)
Laura F. Gumy, Daniel J. Chew, Elena Tortosa, Eugene A. Katrukha, Lukas C. Kapitein, Aviva M. Tolkovsky, Casper C. Hoogenraad and James W. Fawcett
Centre for Brain Repair, University of Cambridge, Cambridge CB2 0PY, United Kingdom, and 2
Division of Cell Biology, Faculty of Science, University of Utrecht, 3584CH Utrecht, The Netherlands
Journal of Neuroscience 10 July 2013, 33 (28) 11329-11345; DOI: https://doi.org/10.1523/JNEUROSCI.5221-12.2013
Abstract
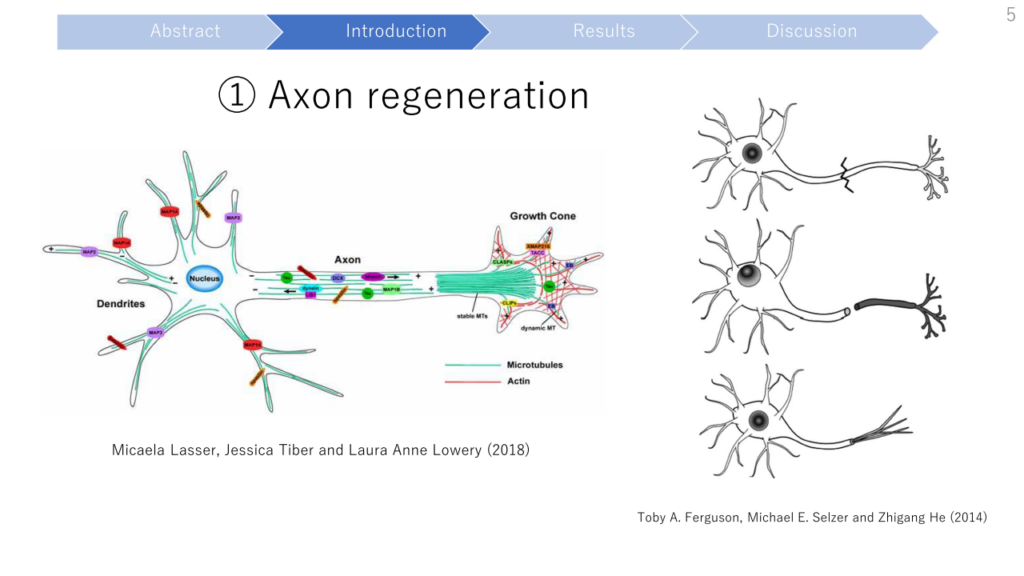
- Axon regeneration after injury requires the extensive reconstruction, reorganization, and stabilization of the microtubule cytoskeleton in the growth cones.
- They identify KIF3C as a key regulator of axonal growth and regeneration by controlling microtubule dynamics and organization in the growth cone.
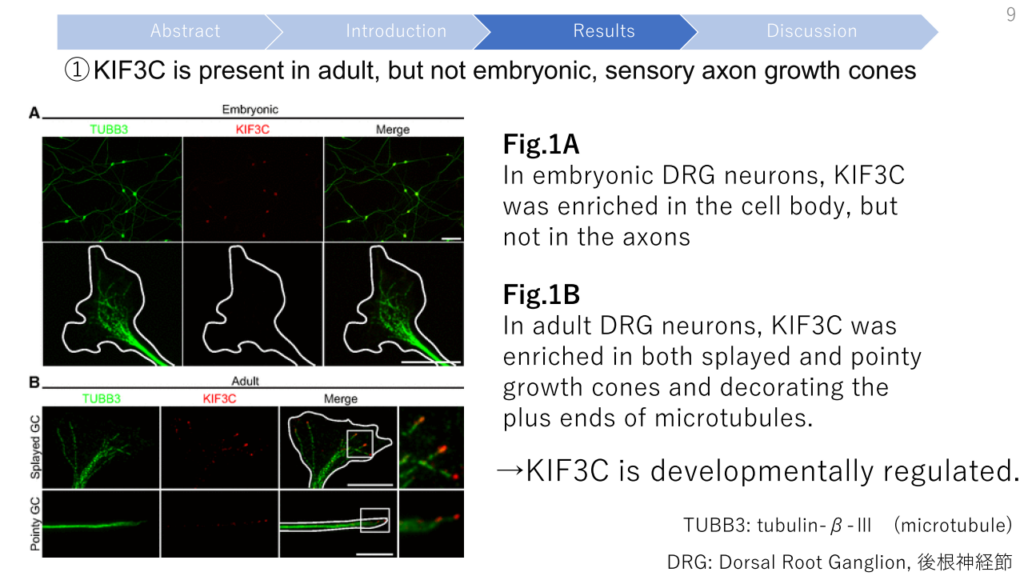
- KIF3C is developmentally regulated. Rat embryonic sensory axons and growth cones contain undetectable levels of KIF3C protein that is locally translated immediately after injury. In adult neurons, KIF3C is axonally transported from the cell body and is enriched at the growth cone where it preferentially binds to tyrosinated microtubules.
- Functionally, the interaction of KIF3C with EB3 is necessary for its localization at the microtubule plus-ends in the growth cone.
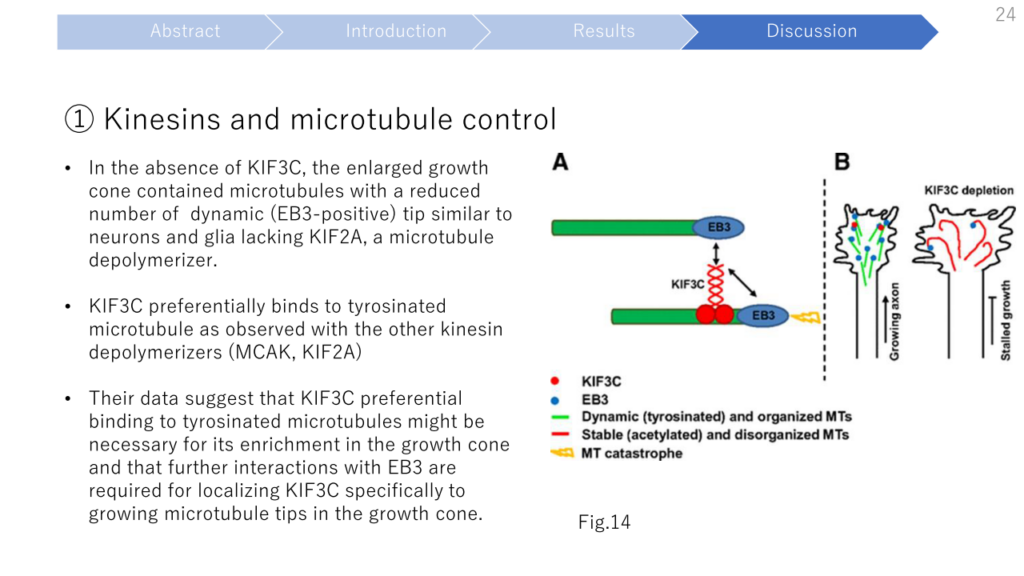
- Depletion of KIF3C in adult neurons leads to an increase in stable, overgrown and looped microtubules because of a strong decrease in the microtubule frequency of catastrophes, suggesting that KIF3C functions as a microtubule-destabilizing factor.
- Adult axons lacking KIF3C, by RNA interference or KIF3C gene knock-out, display an impaired axonal outgrowth in vitro and a delayed regeneration after injury both in vitro and in vivo.
- Murine KIF3C knock-out embryonic axons grow normally but do not regenerate after injury because they are unable to locally translate KIF3C.
→KIF3C is an injury-specific kinesin that contributes to axon growth and regeneration by regulating and organizing the microtubule cytoskeleton in the growth cone.
- 損傷後の軸索再生には、成長円錐における微小管の広範な再構築、再編成、安定化が必要である。
- 研究グループは、KIF3Cが成長円錐における微小管のダイナミクスと組織化を制御することにより、軸索の成長と再生の重要な制御因子であることを明らかにした。
- KIF3Cは発生学的に制御されている。ラット胚の感覚軸索と成長円錐には、検出不可能なレベルのKIF3Cタンパク質が存在し、損傷直後に局所的に翻訳される。成体神経細胞では、KIF3Cは細胞体から軸索方向に輸送され、チロシン化微小管と優先的に結合する成長円錐に濃縮されている。
- 機能的には、KIF3CとEB3との相互作用が、成長円錐の微小管プラス端への局在に必要である。
- 成体神経細胞でKIF3Cを枯渇させると、微小管のカタストロフィーの頻度が強く減少するため、安定化して、過剰に伸長したループ状微小管が増加し、KIF3Cが微小管不安定化因子として機能することが示唆された。
- RNA干渉やKIF3C遺伝子ノックアウトによってKIF3Cを欠損した成体軸索は、in vitroでは軸索伸長が損なわれ、in vivoでは損傷後の再生が遅れることが示された。
- マウスのKIF3Cノックアウト胚軸索は、正常に成長するが、KIF3Cを局所的に翻訳することができないため、損傷後に再生することはない。
→KIF3Cは傷害特異的なキネシンであり、成長円錐の微小管細胞骨格を調節し組織化することで軸索の成長と再生に寄与している。
論文紹介:H.K. (生物学類4年)
