Cell Volume 184, Issue 24, 24 November 2021, Pages 5869-5885.e25
Article
Jie Wang, Yi Miao, Rebecca Wicklein, …,Marius Wernig, K. Christopher Garcia, Thomas C. Su¨dhof
1. Department of Molecular and Cellular Physiology, Stanford University School of Medicine, Stanford, CA 94305, USA
2. Howard Hughes Medical Institute, Stanford University School of Medicine, Stanford, CA 94305, USA
3. Institute for Stem Cell Biology and Regenerative Medicine, Department of Pathology, Stanford University School of Medicine, Stanford, CA 94305, USA
4. Department of Structural Biology, Stanford University School of Medicine, Stanford, CA 94305, USA
Highlights
•RTN4/NoGo receptors engage in high-affinity interactions with BAI adhesion-GPCRs (RTN4/NoGo受容体はBAI結合性GPCRと高親和性で相互作用する)
•RTN4/NoGo receptors bind to BAIs via a glycan-mediated interface (RTN4/NoGo受容体は、糖鎖を介したインターフェースでBAIと結合する)
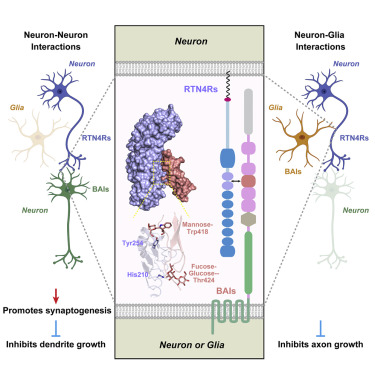
•In neurons, interactions of RTN4Rs and BAIs control synapse and dendrite formation (神経細胞では、RTN4RとBAIの相互作用により、シナプスと樹状突起の形成が制御される)
•Additionally, interactions of neuronal RTN4Rs with glial BAIs constrain axon growth (さらに、神経細胞のRTN4RとグリアのBAIの相互作用は、軸索の成長を抑制する)
Summary
RTN4 (Reticulon R receptor)-binding proteins were widely studied as “NoGo” receptors, but their physiological interactors and roles remain elusive. Similarly, BAI adhesion-GPCRs were associated with numerous activities, but their ligands and functions remain unclear. Using unbiased approaches, we observed an unexpected convergence: RTN4 receptors are high-affinity ligands for BAI adhesion-GPCRs. A single thrombospondin type 1-repeat (TSR) domain of BAIs binds to the leucine-rich repeat domain of all three RTN4-receptor isoforms with nanomolar affinity. In the 1.65 Å crystal structure of the BAI1/RTN4-receptor complex, C-mannosylation of tryptophan and O-fucosylation of threonine in the BAI TSR-domains creates a RTN4-receptor/BAI interface shaped by unusual glycoconjugates that enables high-affinity interactions. In human neurons, RTN4 receptors regulate dendritic arborization, axonal elongation, and synapse formation by differential binding to glial versus neuronal BAIs, thereby controlling neural network activity. Thus, BAI binding to RTN4/NoGo receptors represents a receptor-ligand axis that, enabled by rare post-translational modifications, controls development of synaptic circuits.
RTN4結合タンパク質は “NoGo “受容体として広く研究されているが、その生理的相互作用因子や役割は不明なままである。同様に、BAI (脳特異的血管新生抑制因子)接着性GPCRは多くの生物現象と関連しているが、そのリガンドや機能は不明であった。我々は、非バイアス的アプローチを用いて、予想外の結果を見出した。RTN4受容体は、BAI接着性GPCRの高親和性リガンドである。BAIの単一のトロンボスポンジン1型繰り返し(TSR)ドメインは、3種類のRTN4受容体アイソフォームすべてのロイシンリッチリピートドメインとnMレベルの親和性をもって結合する。BAI1/RTN4-受容体複合体の1.65Åの結晶構造では、BAI TSRドメインのトリプトファンのC-マンノシル化とスレオニンのO-フコシル化により、RTN4-受容体とBAI界面は特異な糖鎖で形作られ、高親和性相互作用を可能にしている。ヒトの神経細胞では、RTN4受容体は、グリアと神経細胞のBAIとの結合の違いによって樹状突起の配列、軸索の伸長、シナプス形成を制御し、それによって神経ネットワークの活性を制御している。このように、RTN4/NoGo受容体へのBAIの結合は、稀な翻訳後修飾によって可能となった、シナプス回路の発達を制御する受容体-リガンド軸を表している。
Keywords
BAI: RTN4R adhesion-GPCR NoGo receptor, C-mannosylation, O-fucosylation, human neuron, synapse formation, neuronal network activity, synaptic transmission, morphology
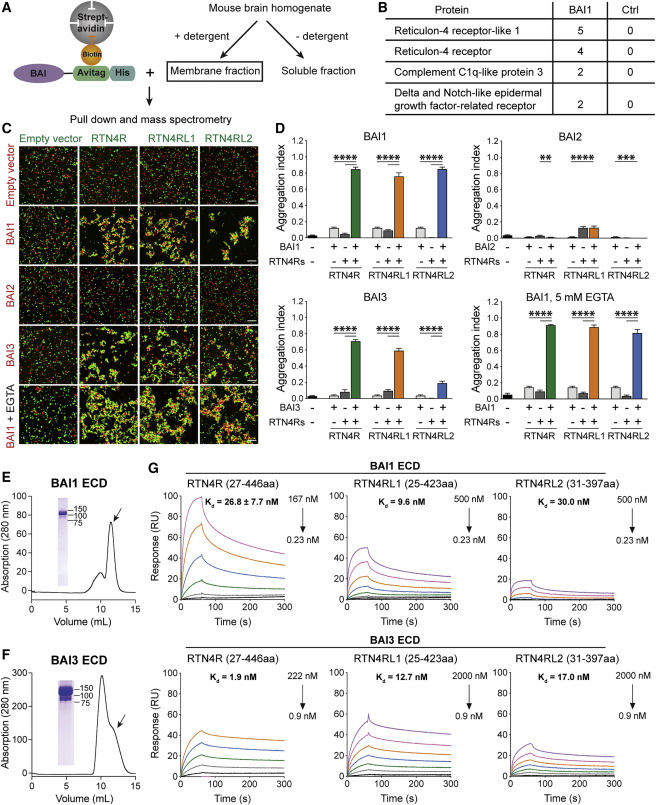
(A) Schematic of pull-down assays.
(B) Selected top hits from BAI1 pull-down assays.
(C) Cell-adhesion assays for BAIs and RTN4Rs, using HEK293F cells co-expressing mCherry or GFP with the indicated proteins (control, empty vector; scale bars, 200 μm).
(D) Cell-adhesion quantification (means ± SEM; n = 10–60 for all groups). Statistics were performed using one-way ANOVA with Dunnett’s multiple comparison tests (∗∗p < 0.01, ∗∗∗p < 0.001, ∗∗∗∗p < 0.0001).
(E and F) SEC profiles of mouse BAI1 (E) and BAI3 (F) ECDs. Arrowheads indicate the collected BAI fraction analyzed by SDS-PAGE.
(G) Affinity measurements of the between BAI1- and BAI3-RTN4R interaction by SPR (means ± SEM, n = 1–4 for all groups (RU, resonance units)).
体育専門学群3年のKさんが、しっかりとした発表をしてくださいました。今後の成長が楽しみです。
