International Review of Neurobiology
Volume 113, 2013, Pages 167-205
Transcriptional Dysregulation of Neocortical Circuit Assembly in ASD (第6章 ASDにおける大脳皮質回路形成の転写調節障害)
1Department of Human Genetics, Molecular & Behavioral Neuroscience Institute (MBNI), University of Michigan, Ann Arbor, Michigan, USA. Electronic address: kykwan@umich.edu.
Abstract
Autism spectrum disorders (ASDs) impair social cognition and communication, key higher-order functions centered in the human neocortex. The assembly of neocortical circuitry is a precisely regulated developmental process susceptible to genetic alterations that can ultimately affect cognitive abilities. Because ASD is an early onset neurodevelopmental disorder that disrupts functions executed by the neocortex, miswiring of neocortical circuits has been hypothesized to be an underlying mechanism of ASD. This possibility is supported by emerging genetic findings and data from imaging studies. Recent research on neocortical development has identified transcription factors as key determinants of neocortical circuit assembly, mediating diverse processes including neuronal specification, migration, and wiring. Many of these TFs (TBR1, SOX5, FEZF2, and SATB2) have been implicated in ASD. Here, I will discuss the functional roles of these transcriptional programs in neocortical circuit development and their neurobiological implications for the emerging etiology of ASD.
自閉症スペクトラム障害(ASD)は、ヒトの大脳新皮質を中心とする主要な高次機能である社会的認知とコミュニケーションを障害する。大脳新皮質回路の構成は、最終的に認知能力に影響を及ぼす遺伝的変化の影響を受けやすい、精密に制御された発達過程である。ASDは、大脳新皮質によって実行される機能を障害する早期発症の神経発達障害であるため、大脳新皮質回路の誤配線がASDの根本的なメカニズムであるという仮説が立てられてきた。この可能性は、新たな遺伝学的知見や画像研究のデータによって裏付けられている。新皮質発生に関する最近の研究では、転写因子が新皮質回路形成の重要な決定因子であり、神経細胞の特定、移動、配線を含む多様な過程を媒介することが明らかにされている。これらの転写因子の多く(TBR1、SOX5、FEZF2、SATB2)がASDに関与している。ここでは、新皮質回路発達におけるこれらの転写プログラムの機能的役割と、ASDの新たな病因に対する神経生物学的な意味について述べる。
Introduction
大脳新皮質の進化は、我々の種が持つ卓越した認知能力、知覚能力、運動能力の根底にあると考えられている。大脳新皮質の組織と回路の進化は、より高度な認知を可能にする一方で、認知に影響を及ぼす障害に対する感受性を高めているのではないかという仮説がある。自閉症スペクトラム障害(ASD)は、社会的互恵性やコミュニケーションなど、ヒトの大脳新皮質が実行する高次認知機能に障害を与える。ASDの根底にあるメカニズムは依然として謎に包まれているが、遺伝学的研究およびイメージング研究から得られた新たな生物学的知見は、ASDにおける新皮質の回路形成の異常を示唆している。新皮質の組織と回路の獲得には、神経細胞の同一性の特定、神経細胞の移動、神経回路の配線など、一連の発生過程の協調的な実行が必要である。最近の研究では、転写因子(TF)が新皮質発生の重要な決定因子として浮上してきた(Kwan et al., 2012, Leone et al., 2008, MacDonald et al., 2013, Molyneaux et al., 2007, Rash and Grove, 2006, Rubenstein, 2011)。興味深いことに、新皮質回路の発達に必要な多くのTFがASDに関与している。本章では、新皮質の発達におけるこれらのASDに関与する転写メカニズムの機能を概説し、ASDを支える神経生物学への洞察を述べたい。
ASDは遺伝性の強い疾患であるが、表現型や遺伝子の多様性が、決定的なリスクをもたらす遺伝子座の同定を妨げてきた。しかし、ハイスループットな方法論を利用して、患者や家族のよく特徴づけられた集団を解析した研究から、信頼できる遺伝学的知見が得られ始めている(Iossifov et al、 2013, Neale et al., 2012, O’Roak, Vives, Fu, et al., 2012, O’Roak, Vives, Girirajan, et al., 2012, Sanders et al., 2011, Sanders et al., 2012, Sebat et al., 2007, Talkowski et al., 2012, Weiss et al., 2003)。これらのデータから、単一の遺伝子座がASD症例の1%以上を占めることはなく、寄与している遺伝子座は数百に上ることが明らかになった。やや皮肉なことかもしれないが、過去数十年の進歩を妨げてきた遺伝子の不均一性は、現在ではASDの生物学的基盤を明らかにする機会となっている。実際、この戦略は、ASDに関連する遺伝子と、知的障害(ID)や症候性自閉症の主要な単遺伝性原因である脆弱X症候群で失われるRNA結合タンパク質であるFMRP(Iossifov et al. この解析により、ASD候補遺伝子のかなりの数がFMRPと関連していることがわかった。これは、自閉症と脆弱X症候群の根底に共通の分子経路が存在する可能性と一致する。加えて、重み付け遺伝子共発現ネットワーク解析は、ASDリスク遺伝子間のこれまで認識されていなかったつながりを明らかにすることができる。このような偏りのないアプローチの一例として、分化する正常ヒト神経細胞前駆細胞における遺伝子発現解析が用いられ、SFARIデータベース(http://gene.sfari.org)でアノテーションされたASD感受性遺伝子との有意な重複が明らかになった(Konopka, Wexler, et al., 2012)。ASDリスクをもたらす遺伝子座間の関係を今後研究することで、ASDの神経生物学的基盤に関するさらなる洞察が得られる可能性が高い。
遺伝学的データの蓄積により、ASDの病因に最も関連する生物学的事象の時期や場所をより正確に特定できるようになるかもしれない。この可能性は、ヒト脳における遺伝子発現の時空間解析に焦点を当てた複数のグループによる最近のトランスクリプトーム研究によって促進されている(Colantuoni et al.) これらのリソースの1つ(http://www.humanbraintranscriptome.org)から得られた利用可能なデータから、最も信頼性の高いリスク保有遺伝子座の多くが、新皮質の組織と神経回路の獲得にとって重要な発達ウィンドウである胎児期中期(図6.1の赤矢印)に、新皮質で急激な発現上昇を示すことが明らかになった(State & Šestan, 2012)。他の脳領域では一貫して観察されない(図6.1)この明確な妊娠中期の発達パターンは、ASD関連遺伝子が大脳新皮質の構造発達と神経回路配線の間に機能する経路に収束している可能性を示唆している。
さらに、新皮質の発達の胎児期中期がASDに関与していることを示す証拠もある。神経細胞の移動は、生まれたばかりの神経細胞が胚珠帯から離れ、正しい外套層の目的地に向かって配置される過程であるが(Angevine and Sidman, 1961, Caviness, 1982, Lambert de Rouvroit and Goffinet, 1998, Rakic, 1974)、妊娠初期から中期にかけて起こり、一部のASD患者では障害があることが示されている(Hutsler et al.) さらに、ASDやその他の神経精神疾患の症例では、新皮質ニューロンのミニコラム構成に異常があることを示す証拠がある(Casanova, Buxhoeveden, Switala, & Roy, 2002)。新皮質のミニコラムは、局所的なネットワークに接続された縦に配列されたニューロンで構成されているが、これは発生的な放射状ユニットに由来すると考えられており、その形成には胎児期のニューロン移動が関係している可能性が高い(Mountcastle, 1997, Peters, 2010, Rakic, 1988)。興味深いことに、新皮質の神経回路の基本単位であるミニコラムの配置や間隔が微妙に変化するだけでも、新皮質の抑制性結合の構造は大きく変化する(Casanova, Buxhoeveden, & Gomez, 2003)。したがって、大脳新皮質の構造的発達に必要な胎児期中期のプロセスの変化は、ASDの原因となる大脳新皮質回路の機能にグローバルな影響を及ぼす可能性がある。
実際、大脳新皮質の結合の機能的障害は、ASDやその他の神経発達障害の原因であるという仮説が立てられている。ASDの新皮質の結合障害または結合不足説を支持する証拠については、別のところでレビューされている(Geschwind and Levitt, 2007, Just et al.) 特に、いくつかの機能的イメージング研究からのデータは、前頭葉領域と頭頂葉領域の間のコミュニケーション帯域幅の減少を支持しており、これは実行能力の前頭葉領域から新皮質の後方領域への再分配につながる(Just et al., 2012)。同期活動によって評価されるこの前後機能的結合の低下は、ASDの広範な表現型と一致して、新皮質の機能に多様な結果をもたらすと考えられている。
解剖学的画像研究のデータからも、新皮質の結合性の変化が示唆されている。拡散張力画像法による軸索線維路の研究では、若年および成人のASD患者において、脳梁投射の減少が一貫して報告されている(Alexanderら、2007、Kellerら、2007、Kumarら、2010、Shuklaら、2010、Weinsteinら、2011)。脳梁は最も顕著な皮質内路であるため、脳梁の変化は他の皮質内結合にも変化をもたらす可能性がある。実際、半球内結合の低下もASDに関与している(Ingalhalikarら、2011、Kumarら、2010、Langeら、2010、Leeら、2007、Nagaeら、2012、Shuklaら、2010、Sundaramら、2008、Weinsteinら、2011)。皮質内結合に加えて、皮質遠心路の欠陥もASDで報告されており(Ingalhalikar et al., 2011, Wolff et al.
興味深いことに、これらの変化は単に結合性の一般的な低下を反映しているのではなく、これらの軸索投射の形成過程における発達的軌跡の変化の結果である可能性がある。高リスク児(ASD児の弟妹)を対象とした最近の縦断研究では、生後6ヶ月から24ヶ月までの軸索路発達が研究された(Wolff et al.) ASDを発症した乳幼児とそうでない乳幼児を比較したところ、調査した15本の白質(WM)経路のうち12本で発達の軌跡が変化しており、生後6ヵ月で一過性に分画異方性が増加した後、24ヵ月以降も持続的に減少することが明らかになった。これらのデータから、ASDにおける神経結合の変化は、行動異常の発症に先立つ生後早期発達までに出現し、皮質内結合と皮質外結合の両方に影響を及ぼしながら、大脳新皮質に広く及んでいることが示唆される。
ASDは基本的に発達障害である。ASDにおける新皮質の異常な回路は、幼少期に発症することから、胎児期や生後早期の欠陥メカニズムに起因する発達的なものである可能性が高い。この後の文章では、まず大脳新皮質の構造的発達と神経回路の組み立ての根底にある細胞プロセスを概観する。続いて、ASDを誘発する4つの転写プログラムが、大脳新皮質の発達の様々な側面で果たす役割と、ASDの病態生理学に寄与する可能性について考察する。
大脳皮質は、大脳半球の最も表層部にある薄い灰白質のシートであり、意識的な感覚、認知、運動のプロセスに関与している。系統発生学的に大脳皮質の最も新しい区分である6層の新皮質の出現は、哺乳類の進化と高次脳機能における重要な進歩であると考えられている(Nieuwenhuys, 1994, Northcutt and Kaas, 1995)。大脳新皮質は、細胞建築学的にも機能的にも、6つの層、(L)1-6層(DeFelipe and Farinas, 1992, Jones, 1986, Mountcastle, 1997, O’Leary and Koester, 1993)と、感覚、運動、連合に大別される数多くの隣接領域に組織されている(O’Leary and Sahara, 2008, Rakic, 1988, Rash and Grove, 2006)。大脳新皮質の神経細胞の同一性と結合性は、哺乳類の種間でよく保存されている かなりの層状依存性と面状依存性を示しており、このことは、この複雑な大脳新皮質構 成の確立が大脳新皮質機能にとって重要である可能性が高いことを示唆している。したがって、大脳新皮質が発達する過程で組織や回路が正しく獲得されないと、認知障害や精神・神経疾患への感受性の高まりにつながる可能性がある(Liu, 2011, Manzini and Walsh, 2011, Rubenstein, 2011, Valiente and Marín, 2010)。
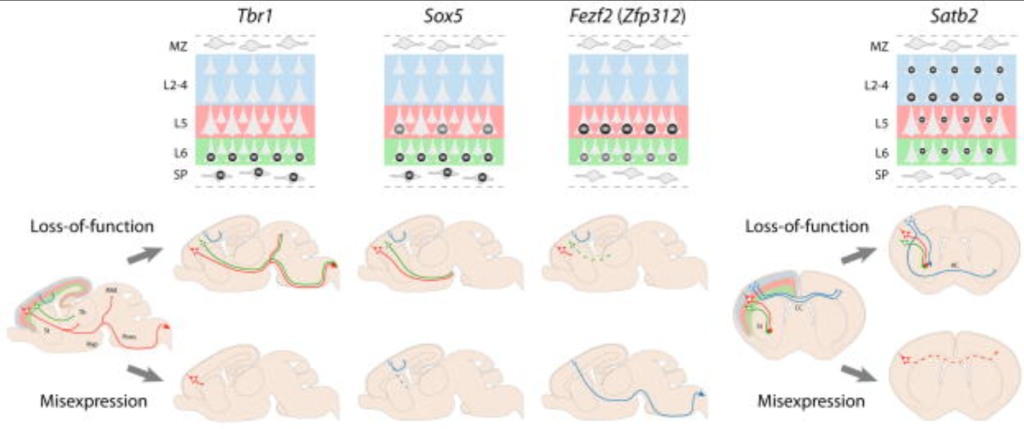
大脳新皮質の各層内には、グルタミン酸作動性の興奮性投射(錐体)ニューロ ンとGABA作動性の抑制性介在ニューロンが存在する(DeFelipe and Farinas, 1992, Jones, 1986)。投射ニューロンは新皮質ニューロン全体の約 80%を占め、長い軸索投射を 伸ばしている。皮質内投射は大脳新皮質の近位領域と遠位領域を接続し、皮質外投射は大脳新 皮質の出力系を構成し、大脳新皮質と皮質下の脳構造を接続する。樹状突起スパインとして知られるシナプス後 の特殊化を発達させる投射ニューロンは、最大の入力系でもあり、脳の他の構造か らの求心性の主要な標的である(DeFelipe and Farinas, 1992, O’Leary and Koester, 1993)。L2-L6に位置する投射ニューロンは、分子的同一性と軸索投射において、層やサブタイプに依存した違いを示す(図6.2)(DeFelipe and Farinas, 1992, Kwan et al., 2012, Leone et al., 2008, MacDonald et al.) corticofugal軸索投射は、深層(L5とL6)と、L6とWMの間に位置す る早生ニューロンを含む新皮質構造であるサブプレート(SP)から厳密に発 生する(Allendoerfer and Shatz, 1994, Herrmann et al.) 大脳皮質視床路を形成する視床を支配する軸索は、主にSPとL6から発生するが、皮質直接路、皮質-皮質下核、皮質脊髄路を含む大脳下を投射する軸索は、もっぱらL5から発生する。対照的に、上層(L2-L4)に位置する投射ニューロンは、大脳皮質内、半球内または対側にのみ投射する。対側の皮質内軸索によって形成される脳梁は、両大脳半球間のコミュニケーションを可能にしている。神経画像研究では、ASDにおけるこの層依存性新皮質結合の変化が示唆されている。特に、皮質内軸索路、特に脳梁の障害が強く関与している(Alexanderら、2007、Ingalhalikarら、2011、Kellerら、2007、Kumarら、2010、Langeら、2010、Leeら、2007、Nagaeら、2012、Shuklaら、2010、Sundaramら、2008、Weinsteinら、2011)。内被膜を含む皮質と被膜の結合性の変化も報告されている(Ingalhalikarら, 2011, Wolffら, 2012)。
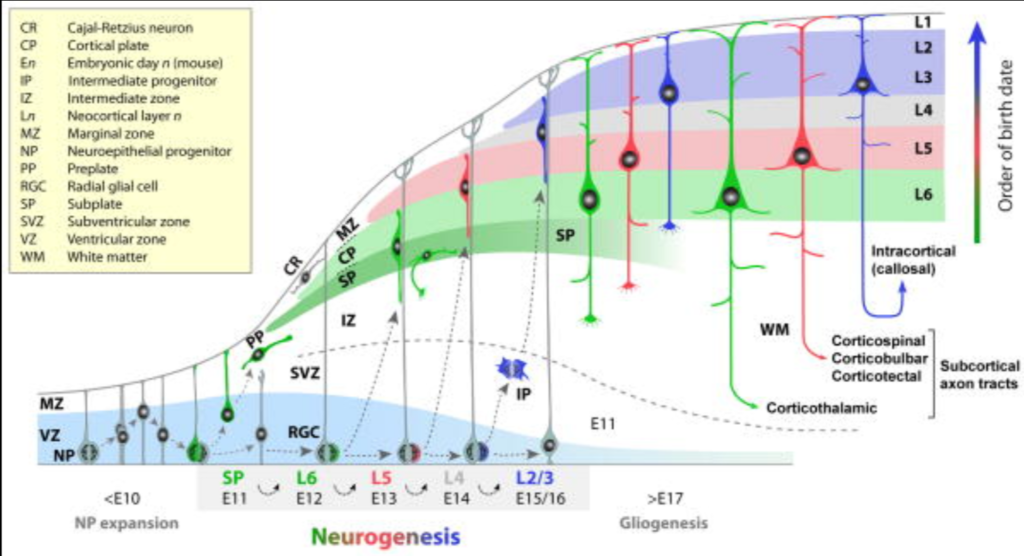
新皮質投射ニューロンの多様なサブタイプは、背側終脳、すなわち脳室と脳室下帯 (VZとSVZ)の胚珠帯内で起こる終末分裂から生成され、放射状移動を経て、新皮質の外套 層にある目的地に到達する(図 6.2)(AngevineとSidman, 1961, Rakic, 1974)。神経新生が始まる前、背側終脳VZは増殖中の神経上皮前駆細胞(NPs)で構成されており、NPsは主に対称分裂を行い、細胞周期に再突入する2つの娘細胞を生み出し、NPsのプールを指数関数的に拡大する(Caviness et al., 1995, Rakic, 1995)。神経新生が始まると、マウスでは胚発生日(E)10.5頃に、一部のNPは放射状グリアの形態をとり、放射状グリア細胞(RGC)になる(Rakic, 1971)。RGCは、VZで神経原性分裂を受けることによって(Anthonyら、2004、Malatestaら、2003、Miyataら、2004、Noctorら、2004)、直接的に投射ニューロンの前駆細胞として機能する、 2004)、また間接的には、中間前駆細胞(IP)を生じ、それがVZから移動してSVZでさらに神経原性分裂を行う(Englundら、2005, Kowalczykら、2009, Noctorら、2008, Sessaら、2010)。さらに、RGCは外套膜層への神経細胞子孫の放射状移動の足場となる(Bentivoglio and Mazzarello, 1999, Rakic, 1971)。
最も初期の新皮質ニューロンは、大脳壁の表層部で前板(preplate; PP)と呼ばれる細胞 の帯を形成する(図 6.2)(De-CarlosとO’Leary, 1992, Marin-Padilla, 1971, Marin-Padilla, 1978, The Boulder Committee, 1970)。マウスで E11.5 付近に発生した最初の投射ニューロンは、VZ から放射状に移動し、中間 帯(IZ)を通過した後、PP 内に層として定着し、新皮質の L2-L6 が最終的に出現する皮質板(CP) を形成する(Marin-Padilla, 1978)。入ってくるCPニューロンによって、PPは2つの層、すなわち生後大脳皮質のL1を形成する表層辺縁帯(MZ)と、L6の下に位置する深層SPに分割される。MZとSPの初期に生まれたニューロンは、形態学的、シナプス学的に最初に成熟し、先駆的な結合を形成し、その後のCPニューロンの移動と皮質の入出力回路の組み立てに重要な役割を果たす(Allendoerfer and Shatz, 1994, Herrmann et al., 1994, Kostovic and Rakic, 1980, Kostovic and Rakic, 1990, Molliver et al.) 興味深いことに、SPはASDに関連する遺伝子の発現が豊富であり(Hoerder-Suabedissen et al.
マウスではE11.5からE16.5にかけて神経新生が進行し、新皮質投射ニューロンの多様なサブタイプが順次生成される(図6.2)。新しく生成されたニューロンは、古い、移動後 のニューロンを通過してCPの最も表層部に移動するため、投射ニューロンは、内側が先、外側が後(L6-L2)という順序でCPに追加される(Angevine and Sidman, 1961, Caviness, 1982, Lambert de Rouvroit and Goffinet, 1998, Rakic, 1974)。放射状の移動が終わると、新たに移動してきたニューロンは分子的、形態学 的に多様なニューロンサブタイプに分化し、その層の位置に適した神経回路 を形成する(Anton et al., 1999, D’Arcangelo and Curran, 1998, Lambert de Rouvroit and Goffinet, 1998, Yokota et al.)
関連する前駆細胞系列からの新皮質神経新生の連続的な性質は、神経細胞の誕生日と終 末分裂の場所を、神経細胞の位置、同一性、軸索の連結性に直接結びつけている(図 6.2)。大脳皮質神経新生初期(マウスではE11.5-E13.5)には、ニューロンの大部分がVZで非対称神経原性分裂を介して直接生成される。これらの初期に生まれたニューロンは、ほとんどが大脳新皮質の皮質外皮出力を構成する新皮質の深層に向かう。神経発生の後期(~E14.5-E16.5)には、多くのニューロンがSVZのIPの分裂を通して間接的に誘導される(Noctor et al.) これらの後期ニューロンは、ほとんどが皮質内結合を形成し、脳梁を広範囲に神経支配する上層に向かう。IPは皮質投射ニューロンのかなりの数に寄与していると考えられ(Haubensak et al., 2004, Miyata et al. この可能性と一致するように、多くの霊長類、そして大脳を持つ他の多くの哺乳類には、外側SVZとして知られるIPをさらに含む特殊な領域がある(Lui, Hansen, & Kriegstein, 2011)。SVZはかなりの数の上層ニューロンに寄与しているため、脳室下部の分裂の障害は、ASDに関与している皮質内結合をより深刻に変化させる可能性がある。
神経新生と神経細胞移動の欠陥は、ヒトにおいて重篤な脳奇形につながる可能性がある(Kerjan and Gleeson, 2007, Liu, 2011, Manzini and Walsh, 2011, Thornton and Woods, 2009)。VZの有糸分裂に必要な細胞機構、特に中心体(centrosome)の集合に関わる機構に影響を及ぼす突然変異は、原発性小頭症につながる可能性があり、一方、遊走障害は裂頭症や回旋障害につながる可能性がある。
おそらく最も広く研究されている神経細胞移動の表現型は、リーラー突然変異体のものであろう。Reeler変異を持つマウスでは、新生投射ニューロンは生殖帯から離れ、IZを通って移動することができるが、CP内の古いニューロンを越えて移動することができず、直下で早々に停止してしまう(Rice and Curran, 2001, Tissir and Goffinet, 2003)。神経細胞移動の最終段階でのこの失敗の結果、PPの分割に欠陥が生じ、L2-SPの順序が逆転する。Reelerマウスは、MZに位置するCajal-Retzius(CR)ニューロンから分泌される細胞外マトリックスタンパク質をコードするReelin(Reln)の機能欠損変異を持つ。重要なことに、RELNがASDの遺伝的危険因子であることが複数の研究で示されており(Holt et al., 2010, Kelemenova et al., 2010, Li et al., 2008, Persico et al., 2001, Serajee et al.
肉眼的な構造異常に加えて、神経細胞移動の欠陥は、ヒト大脳新皮質の柱状組織の変化など、より微細な変化を引き起こす可能性がある(Kwan, Lam, et al., 2012, Mountcastle, 1997, Rakic, 1988)。ASDや統合失調症患者の死後脳で報告されている新皮質の小柱の配置の変化(Casanova et al., 2003, Casanova et al., 2002)に加え、神経病理学の他の詳細な研究でも、検査された自閉症の脳の一部で、神経細胞の移動に微妙な欠陥があることが明らかになっている(Hutsler et al., 2007, Uppal and Hof, 2013, Wegiel et al., 2010)。さらに、ASDとの関連が指摘されているcontactin-associated protein-like 2(CNTNAP2、以前はCASPR2として知られていた)の欠損は、マウスとヒトの両方で遊走障害を引き起こす(Peñagarikanoら、2011、Straussら、2006)。これらのデータを総合すると、大脳新皮質投射ニューロンの移動不全と、それに伴う神経回路の潜在的な変化が、ASDやその他の神経発達障害の一因である可能性が裏付けられる。
大脳新皮質における層依存性の違いは、残りの約20%の新皮質ニューロンによってさらに増強される。異なる形態学的、神経化学的、電気生理学的サブタイプの介在ニューロンもまた、選択的な層選好性をもって新皮質を構成している(Markram et al.) 新皮質介在ニューロンは腹側前脳の前駆細胞から生成され、主に内側と尾側の神経節辺縁に存在する(Anderson et al., 1997, Marín and Rubenstein, 2003, Nadarajah and Parnavelas, 2002, Wonders and Anderson, 2006, Xu et al.) 大脳新皮質に到達するために、新生介在ニューロンは主にCPの上または下にある移動コリドーを経由して、接線方向の移動を行う。目的地の皮質領域に到着すると、介在ニューロンは放射状移動を経てCPに入り(Ang et al., 2003, Nadarajah and Parnavelas, 2002, Yokota et al., 2007)、その後、サブタイプ、起源、誕生日に基づいて皮質のラミナに定住する(Miyoshi and Fishell, 2011, Miyoshi et al.)
大脳皮質の興奮と抑制のバランスの崩壊は、てんかんを患うASD患者の割合の高さやその他の観察結果から示唆されるように、ASDに関連するという仮説が立てられている(Rubenstein & Merzenich, 2003)。したがって、介在ニューロンの生成、移動、配線に対する変化がこのメカニズムに関与している可能性がある。この可能性と一致するように、介在ニューロン前駆細胞の初期形態決定に重要な遺伝子(Dlxファミリーの遺伝子)がASDと関連している(Liuら、2009年、Nakashimaら、2010年)。さらに、GABA作動性シグナル伝達の欠陥が、レット症候群のASD関連表現型の根底にあることが報告されている(Chao et al.)