Cell Reports Available online 20 December 2023, 113576
Repetitive CREB-DNA interactions at gene loci predetermined by CBP induce activity-dependent gene expression in human cortical neurons (CBPによって決定される遺伝子座における反復的なCREB-DNA相互作用は、ヒト大脳皮質神経細胞における活動依存的な遺伝子発現を誘導する)
Yuri Atsumi 1, Ryohei Iwata 2, Hiroshi Kimura 3, Pierre Vanderhaeghen 2, Nobuhiko Yamamoto 14, Noriyuki Sugo 15
1Graduate School of Frontier Biosciences, Osaka University, Suita, Osaka 565-0871, Japan2VIB-KU Leuven, Center for Brain & Disease Research and KU Leuven, Department of Neurosciences & Leuven Brain Institute, 3000 Leuven, Belgium3Cell Biology Center, Institute of Innovative Research, Tokyo Institute of Technology, Yokohama, Kanagawa 226-8503, Japan4Institute of Neurological and Psychiatric Disorders, Shenzhen Bay Laboratory, Shenzhen, Guangdong 518132, China
Abstract
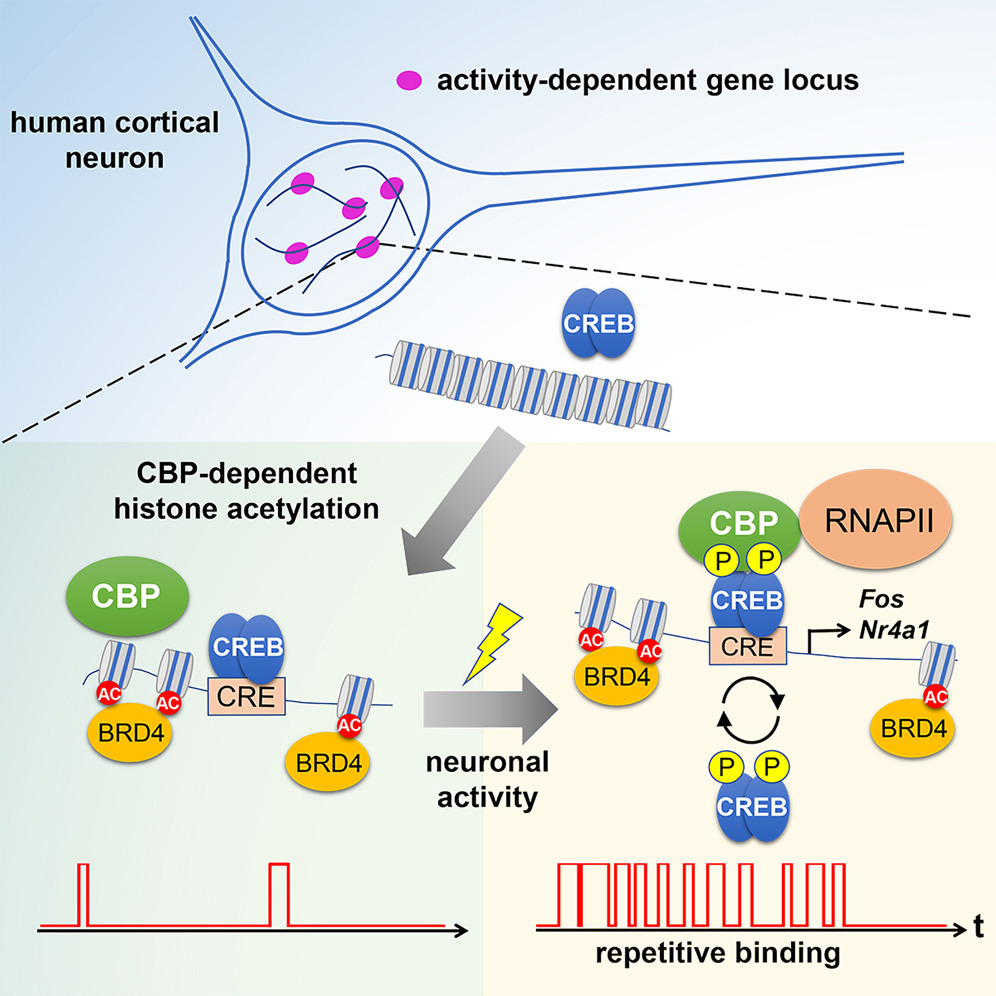
Neuronal activity-dependent transcription plays a key role in plasticity and pathology in the brain. An intriguing question is how neuronal activity controls gene expression via interactions of transcription factors with DNA and chromatin modifiers in the nucleus. By utilizing single-molecule imaging in human embryonic stem cell (ESC)-derived cortical neurons, we demonstrate that neuronal activity increases repetitive emergence of cAMP response element-binding protein (CREB) at histone acetylation sites in the nucleus, where RNA polymerase II (RNAPII) accumulation and FOS expression occur rapidly. Neuronal activity also enhances co-localization of CREB and CREB-binding protein (CBP). Increased binding of a constitutively active CREB to CBP efficiently induces CREB repetitive emergence. On the other hand, the formation of histone acetylation sites is dependent on CBP histone modification via acetyltransferase (HAT) activity but is not affected by neuronal activity. Taken together, our results suggest that neuronal activity promotes repetitive CREB-CRE and CREB-CBP interactions at predetermined histone acetylation sites, leading to rapid gene expression.
神経細胞の活動に依存した転写は、脳の可塑性と病理において重要な役割を果たしている。興味深い問題は、神経細胞の活動が、核内で転写因子とDNAやクロマチン修飾因子との相互作用を介して、どのように遺伝子発現を制御しているのかということである。我々は、ヒト胚性幹細胞(ESC)由来の大脳皮質神経細胞における単一分子イメージングを利用することにより、神経活動が、核内のヒストンアセチル化部位におけるcAMP応答エレメント結合タンパク質(CREB)の反復的出現を増加させ、そこでRNAポリメラーゼII(RNAPII)の蓄積とFOSの発現が急速に起こることを実証した。神経細胞活動はまた、CREBとCREB結合タンパク質(CBP)の共局在化を促進する。構成的に活性なCREBとCBPの結合が増加すると、CREBの反復出現が効率的に誘導される。一方、ヒストンアセチル化部位の形成は、アセチルトランスフェラーゼ(HAT)活性を介したCBPのヒストン修飾に依存するが、神経細胞の活動には影響されない。以上の結果から、神経細胞活動は、あらかじめ設定されたヒストンアセチル化部位において、CREB-CREおよびCREB-CBPの反復的相互作用を促進し、迅速な遺伝子発現をもたらすことが示唆された。
Highlights
- Single-molecule imaging shows CREB and CBP dynamics in human cortical neurons
- Neuronal activity induces CREB-CBP repetitive emergence at histone acetylation sites
- RNAPII accumulates at the repetitive emergence sites, leading to gene expression
- Histone acetylation sites are predetermined by CBP HAT activity
- ヒト皮質ニューロンにおけるCREBとCBPの動態を1分子イメージングで示す
- 神経活動がヒストンアセチル化部位でCREBとCBPの反復出現を誘導する
- RNAPIIが反復創発部位に集積し、遺伝子発現につながる
- ヒストンアセチル化部位はCBP HAT活性によってあらかじめ決定されている。
Keywords
neuronal activity, CREB, CBP, single-molecule imaging, human cortical neuron, RNAPII, BRD4, histone acetylation, activity-dependent gene
Research topic(s)
CP: Neuroscience; CP: Molecular biology
記憶関連分子CREBが脳の神経回路を活性化する仕組みを解明
遺伝子発現の1分子イメージングによる学習・記憶研究の新展開(大阪大学プレスリリース)
https://www.fbs.osaka-u.ac.jp/ja/research_results/papers/detail/1081
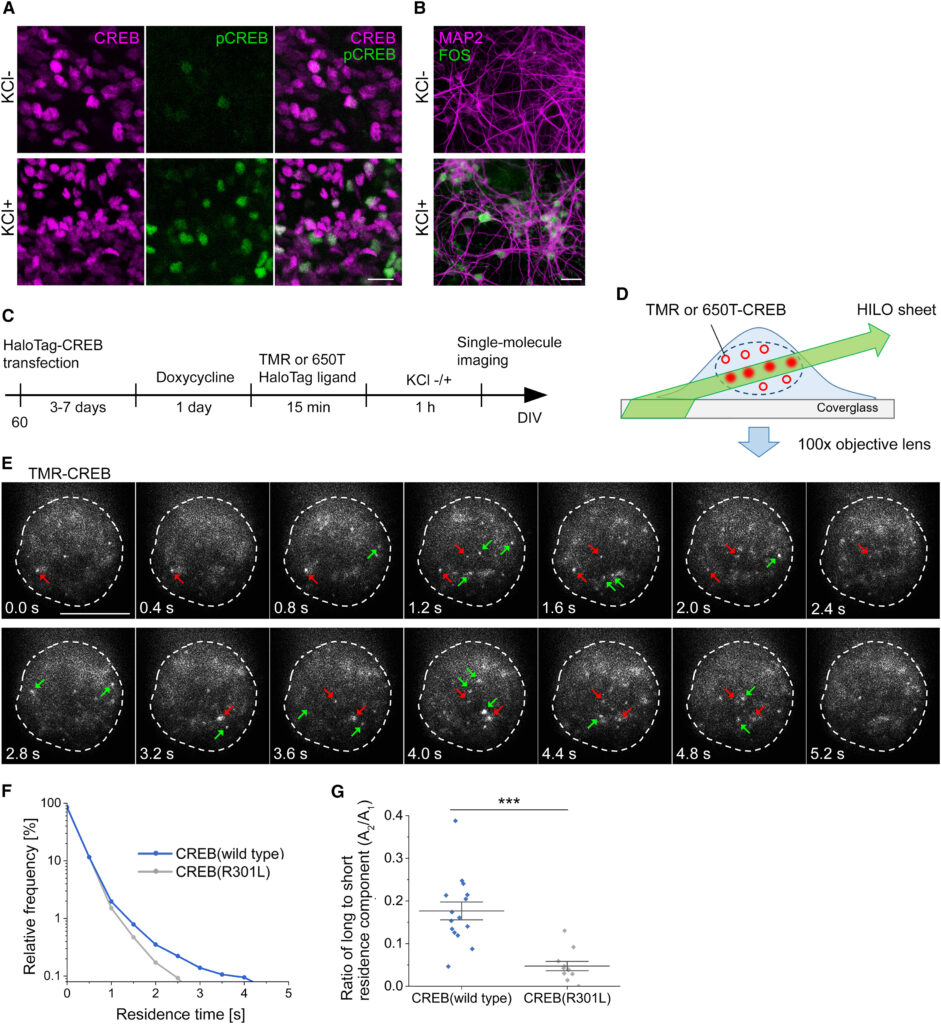
(A) 人間のESC由来の大脳皮質ニューロンでのCREBおよびSer133リン酸化CREB(pCREB)の免疫細胞化学が示されている。45日目のin vitro(DIV)でのKCl処理ありとなしの状態が示されている。
(B) 53日目のin vitro(DIV)でのKCl処理ありとなしの状態でのFOSの免疫細胞化学が示されている。ほとんどの細胞(86.5%、104細胞)がKCl処理でFOSシグナルを発現していることが示されている。
(C) 人間のESC由来ニューロンにおけるCREB SMIの実験タイムラインが示されている。
(D) SMI用のHILO顕微鏡法の概略図が示されている。TMRまたは650T-CREBはHILO照明によって励起され、単一分子レベルでの蛍光イメージが得られる。
アブストラクト: 本研究では、人間の胚性幹細胞(ESC)由来の大脳皮質ニューロンにおいて、神経活動依存的な転写が脳の可塑性と病理において重要な役割を果たしていることが示されている。特に、神経活動がCREB(cAMP response element-binding protein)の繰り返し出現と、CREBとCBP(CREB-binding protein)の共局在を増加させること、そしてこれが活性化されたRNAポリメラーゼII(RNAPII)の蓄積とFOS遺伝子の発現を引き起こすことが明らかにされている。また、CREBの活性化された形態がCBPとの結合を効率的に促進し、CREBの繰り返し出現を引き起こすことが示されている。一方、ヒストンアセチル化部位の形成は、CBPのヒストン修飾活性に依存しているが、神経活動によっては影響されないことが示されている。
背景: 発達中の脳において、感覚誘発や自発的な発火活動は、神経回路の改造や可塑性において重要な役割を果たし、多くの活動制御遺伝子の発現を制御している。CREBは、活動依存的な遺伝子発現において重要な転写因子である。CBPはヒストンのアセチル化を介してCREB依存的な転写を調節するが、CBPの役割は完全には明らかにされていない。
方法: 人間ESC由来の大脳皮質ニューロンを用いて、神経活動依存的なCREBのダイナミクスを研究している。このために、単一分子イメージング(SMI)を用いてCREBの動きや、CREBとCBPの相互作用を観察している。
結果: 神経活動はCREBの反復的な出現と、特定の核内部位におけるCREBとCBPの相互作用の頻度を増加させることが分かっている。CREBの繰り返し出現は、RNAPIIの蓄積と早期応答遺伝子の転写を促進する。また、CREBのホットスポットは、GFP-BRD4でマークされたヒストンアセチル化部位でしばしば観察される。これらの結果は、CREBの繰り返し結合がヒストンアセチル化部位での早期応答遺伝子の転写を促進することを示唆している。
CBPのHAT(ヒストンアセチルトランスフェラーゼ)活性は、CREB-DNA結合に不可欠であり、CBPのHAT活性の不活性化は、活動依存的なCREBのダイナミクスの崩壊につながる。また、ヒストンアセチル化部位の数やレベルは、神経活動によって変化しないことが示されている。
論議: 本研究は、神経活動によってCREB-DNAおよびCREB-CBPの相互作用の頻度が増加し、これが活動依存的な遺伝子発現を誘導することを示している。この結果は、神経活動依存的なCREB-DNAおよびCREB-CBPの相互作用が遺伝子発現を調節するモデルを支持している。
限界: この研究は、転写因子とヒストン修飾酵素の空間的・時間的ダイナミクスを明らかにしているが、これらの分子が直接結合または相互作用しているとは限らない。また、使用された人間ESC由来の大脳皮質ニューロンは、主に深層ニューロンに偏っている可能性があり、完全に分化していない可能性もある。これにより、神経活動依存的な応答性に影響を与える可能性がある。
可能な応用: CREBダイナミクスの不調和は、Rubinstein-Taybi症候群や他の神経病理に関連している可能性がある。この研究は、ヒトおよびマウスの大脳皮質ニューロンにおける活動依存的なCREBダイナミクスが共有されていることを示唆しているが、ヒトの大脳皮質ニューロンにおけるCREB-CRE結合時間はマウスに比べて短いことが観察されている。これは、ヒトの大脳皮質ニューロンにおけるより精密な遺伝子調節を可能にするかもしれない。
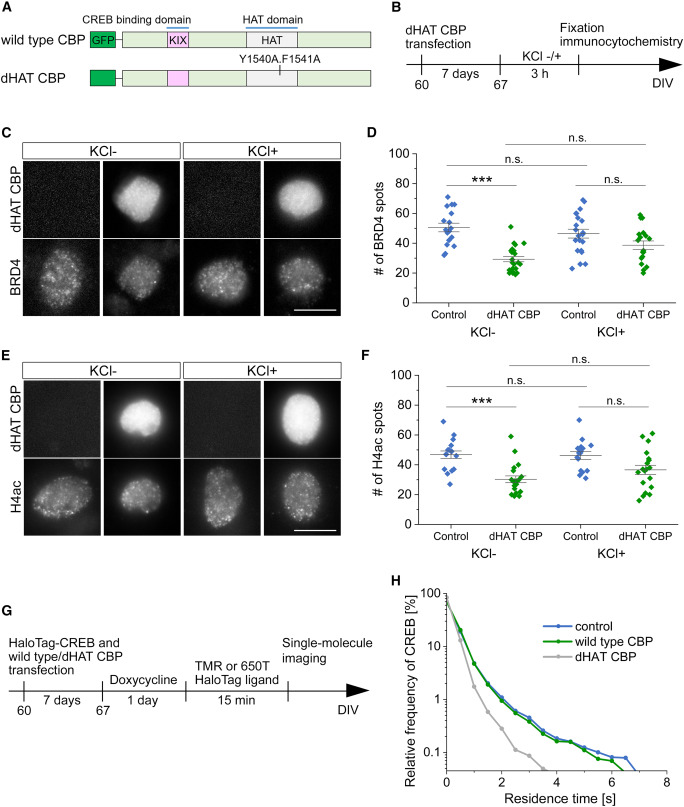
(A) CBPのHAT活性を持たない変異体(dHAT CBP)の構造図が示されている。
(B) そして (C) dHAT CBPを発現させたニューロンにおいて、BRD4に対する免疫細胞化学を行った結果が示されている。これらの図では、dHAT CBPを発現させることによってBRD4のシグナルが弱まることが示されている。量的な分析から、dHAT CBPの発現によってBRD4スポットの数が有意に減少していることがわかる(コントロールでは50.5 ± 2.8、dHAT CBPでは29.3 ± 1.7、p < 0.001)。
この結果は、CBPのHAT活性がニューロン内のヒストンアセチル化部位の形成に重要であること、その活性の欠如がBRD4スポットの減少に直接的に関連していることを示唆している。

本記事の一部に、paper interpreterを使用しています。