Int J Mol Sci 2023 Dec 28;25(1):432. doi: 10.3390/ijms25010432.
Exogenous IL-17A Alleviates Social Behavior Deficits and Increases Neurogenesis in a Murine Model of Autism Spectrum Disorders (外因性IL-17Aは自閉症スペクトラム障害モデルマウスにおいて社会的行動の欠損を緩和し、神経新生を増加させる)
Yehoshua Willinger 1, Daniella R Friedland Cohen 1, Gadi Turgeman 1 2
1Department of Molecular Biology, Faculty of Natural Sciences, Ariel University, Ariel 40700, Israel.
2The Adelson School of Medicine, Ariel University, Ariel 40700, Israel.
アリエル大学は、アリエルに本部を置くイスラエルの公立大学。1982年創立、1982年大学設置。大学の略称はアリエル大学である(Wikipedia)
Abstract
Among the proposed mechanisms for autism spectrum disorders (ASD) is immune dysregulation. The proinflammatory cytokine Interleukine-17A (IL-17A) was shown to play a key role in mediating immune-related neurodevelopmental impairment of social behavior. Nevertheless, post-developmental administration of IL-17A was found to increase social behavior. In the present study, we explored the effect of post-developmental administration of IL-17A on ASD-like behaviors induced by developmental exposure to valproic acid (VPA) at postnatal day 4. At the age of seven weeks, VPA-exposed mice were intravenously injected twice with recombinant murine IL-17A (8 μg), and a week later, they were assessed for ASD-like behavior. IL-17A administration increased social behavior and alleviated the ASD-like phenotype. Behavioral changes were associated with increased serum levels of IL-17 and Th17-related cytokines. Exogenous IL-17A also increased neuritogenesis in the dendritic tree of doublecortin-expressing newly formed neurons in the dentate gyrus. Interestingly, the effect of IL-17A on neuritogenesis was more noticeable in females than in males, suggesting a sex-dependent effect of IL-17A. In conclusion, our study suggests a complex role for IL-17A in ASD. While contributing to its pathology at the developmental stage, IL-17 may also promote the alleviation of behavioral deficits post-developmentally by promoting neuritogenesis and synaptogenesis in the dentate gyrus.
自閉スペクトラム症(ASD)のメカニズムとして提唱されているものの中に、免疫異常がある。炎症性サイトカインであるインターロイキン-17A(IL-17A)は、免疫に関連した社会的行動の神経発達障害を媒介する上で重要な役割を果たしていることが示された。それにもかかわらず、IL-17Aを発達後に投与すると、社会的行動が増加することが明らかになった。本研究では、生後4日目にバルプロ酸(VPA)に曝露することで誘発されるASD様行動に対するIL-17Aの発達後投与の効果を検討した。7週齢のVPA曝露マウスに組換えマウスIL-17タンパク(8μg)を2回静脈注射し、1週間後にASD様行動を評価した。IL-17A投与は社会的行動を増加させ、ASD様表現型を緩和した。行動の変化は、IL-17およびTh17関連サイトカインの血清レベルの上昇と関連していた。外因性IL-17Aは、歯状回で新たに形成されたダブルコーチン陽性新生ニューロンの樹状突起形成も増加させた。興味深いことに、神経細胞新生に対するIL-17Aの効果は、男性よりも女性で顕著であったことから、IL-17Aの性差依存的な作用が示唆された。結論として、われわれの研究は、ASDにおけるIL-17Aの複雑な役割を示唆している。発達段階においてASDの病態に寄与する一方で、IL-17は歯状回における神経新生とシナプス形成を促進することによって、発達後の行動障害の緩和を促進する可能性がある。
Keywords: IL-17A; autism spectrum disorder (ASD); hippocampal neurogenesis; social behavior.
Introduction
自閉スペクトラム症(ASD)は、反復的で日常的な行動、社会的回避、認知の硬直性を特徴とする神経発達障害の集合体である[1,2]。100人に1人以上がASDと診断され、その有病率は男性が女性の4倍である。ASDの病因はほとんど不明であるが、感染症、ストレス、化学物質への出生前および出生後早期の曝露による遺伝的およびエピジェネティックな変化の両方が、もっともらしい原因と考えられている [3,4,5,6]。例えば、神経精神薬として広く使用されている脂肪酸であるバルプロ酸(VPA) [7]は、出生前にこの薬物に暴露された子どものASDリスクを増加させることがいくつかの研究で示されている [8]。
また、ASD患者における免疫機能の広範な変化もいくつかの研究で証明されている[9,10]。これらの変化は、適応性の低下や認知能力の低下など、ASDにおける中核的な特徴の障害と関連していることが判明している[11]。ASD患者は、中枢神経系と末梢の両方において炎症性プロファイルを持っているようである。さらに、発達期におけるASDの病因において、免疫調節不全、特に炎症性サイトカインIL-17Aの役割が認識されつつある。IL-17Aへの発達期の曝露はASD発症と関連しているが、最近、成人期にIL-17Aを脳内投与すると、母親の免疫活性化によって引き起こされた社会的障害が改善されることが示された [13] 。
成人期の神経新生は、主に海馬の歯状回(DG)の下顆粒細胞層(SGZ)と側脳室の脳室下帯(SVZ)で起こる [14,15] 。神経新生の間、新しく形成されたニューロンは成熟し、膜芽が成長して樹状突起と軸索極に神経突起を形成するという形態学的変化を起こす。新しく形成されたニューロンは海馬ネットワークに機能的に統合され、学習と記憶の過程にメカニズム的に関与している [15,17,18]。海馬の神経新生と行動との関連は、多くの研究で観察されている [18,19]。神経新生の障害は、自閉症スペクトラム障害 [23] など、いくつかの神経行動障害 [20,21,22] と関連している。特に、神経細胞新生の障害は、ASDの病態生理学および/または治療における重要な特徴であることが示唆された[24,25]。ASDのVPAモデルにおいても、成体神経新生の異常が観察された。歯状回では、神経前駆細胞プールが減少し、新しく形成されたニューロンの数が増加していることが検出された [26,27,28]。
免疫系は、ケモカインやサイトカインの分泌、免疫細胞の活性化など、いくつかの方法で成体海馬の神経新生に影響を与える可能性がある [29,30]。私たちは以前、ナイーブな成体マウスにインターロイキンIL-17Aを単回投与すると、空間学習がわずかに改善され、神経突起の成長と神経細胞の成熟が増加する一方で、神経前駆細胞の増殖が抑制されることで神経新生が変化することを発見した [31]。同様に、私たちは、高レベルの全身性IL-17Aが、外傷を受けたマウスの社会的相互作用行動を改善することを発見し、これは神経新生における予想される変化と関連していた[32]。
本研究では、VPA曝露によって誘導される確立された自閉症モデルマウスにおいて、ASD様表現型と神経新生に対する成人期のIL-17A投与の効果を探索しようとした[33]。我々は、発育期の曝露とは対照的に、成人期のIL-17A投与は、VPAによって誘導された神経新生の変化を修正し、我々が以前に観察したように、行動、特に社会的行動を改善する可能性があると仮定した[32]。さらに、IL-17Aの短期投与が血清サイトカインレベルに及ぼす影響と、以前に報告したように性差が観察されるかどうかを検討した[33,34]。この結果は、ASDにおけるIL-17Aの複雑な役割に光を当てるものであり、成人期におけるIL-17Aの保護的役割を示唆するものである。
方法: 実験は、Ariel Universityの動物ケアおよび使用委員会の承認を受け、NIHのガイドラインに従って行われた。妊娠中のICRマウスをEnvigo(イスラエル)から購入し、22℃で12:12時間の暗明サイクルで飼育した。生後4日目に、新生仔マウスにVPA(300 mg/kg)を単回皮下注射し、7週齢でIL-17Aタンパク(8 µg)を3日間隔で2回静脈内注射した。行動テストは8週目と9週目に行われ、その後マウスは麻酔され、心臓から直接血液を採取した。ASD様行動の評価には、オープンフィールドテスト、3チャンバー社会的相互作用、水迷路テストを含む一連の行動パラダイムが使用された。ASDスコアは、各行動アセイの結果をZ標準化して算出され、ポジティブなスコアがASD様行動の増加を意味した。
結果: IL-17Aの治療は、VPA暴露マウスの社会行動と一般的なASD様表現型を改善した。特に雌マウスで社会的刺激に対する好みが改善され、社会的相互作用の期間が増加しました。認知的硬直性は、水迷路テストで評価され、IL-17A投与により改善された。IL-17A治療により、VPAに暴露された動物の血清中のTヘルパー関連サイトカインのレベルが変化した。特に、IL-17A治療後の雌マウスでは、複数のサイトカインが増加しました。これらの変化は、社会的行動とASDスコアと相関していた。
議論: IL-17Aは、ASDなどの神経発達障害の可能な病因として提案されている。本研究では、IL-17Aの2回の注射により社会行動が改善され、全体的なASD様行動が減少した。特に、IL-17A、IL-17F、IL-21の血清レベルが社会行動と正の相関を示し、ASDスコアとは逆の相関を示した。IL-17A投与による血清IL-17Aレベルの上昇は、IL-17Aの半減期が8時間であるにもかかわらず、2週間後も維持された。これはIL-17Aが内因性IL-17Aの発現を増加させる正のフィードバックループを引き起こしたと考えられる。また、IL-17Aは成人の海馬神経新生に影響を与えることが示唆されており、特にDCX+細胞の神経新生を促進した。これらの結果は、IL-17AがASDの行動的な欠陥を解決する上で重要な役割を果たす可能性があることを示唆している。本研究はマウスモデルに基づいており、人間における効果は未確認である。また、IL-17A治療による長期的な影響や副作用についてもさらなる研究が必要である。
可能な応用: この研究は、ASDの治療法としてIL-17Aの可能性を示しています。特に、発達後のIL-17A投与が行動療法や他の治療法と組み合わせて、ASDの症状を軽減する可能性がある。また、神経新生やシナプトジェネシス(シナプス形成)の促進による神経発達障害の治療法の開発に対する洞察も提供している。
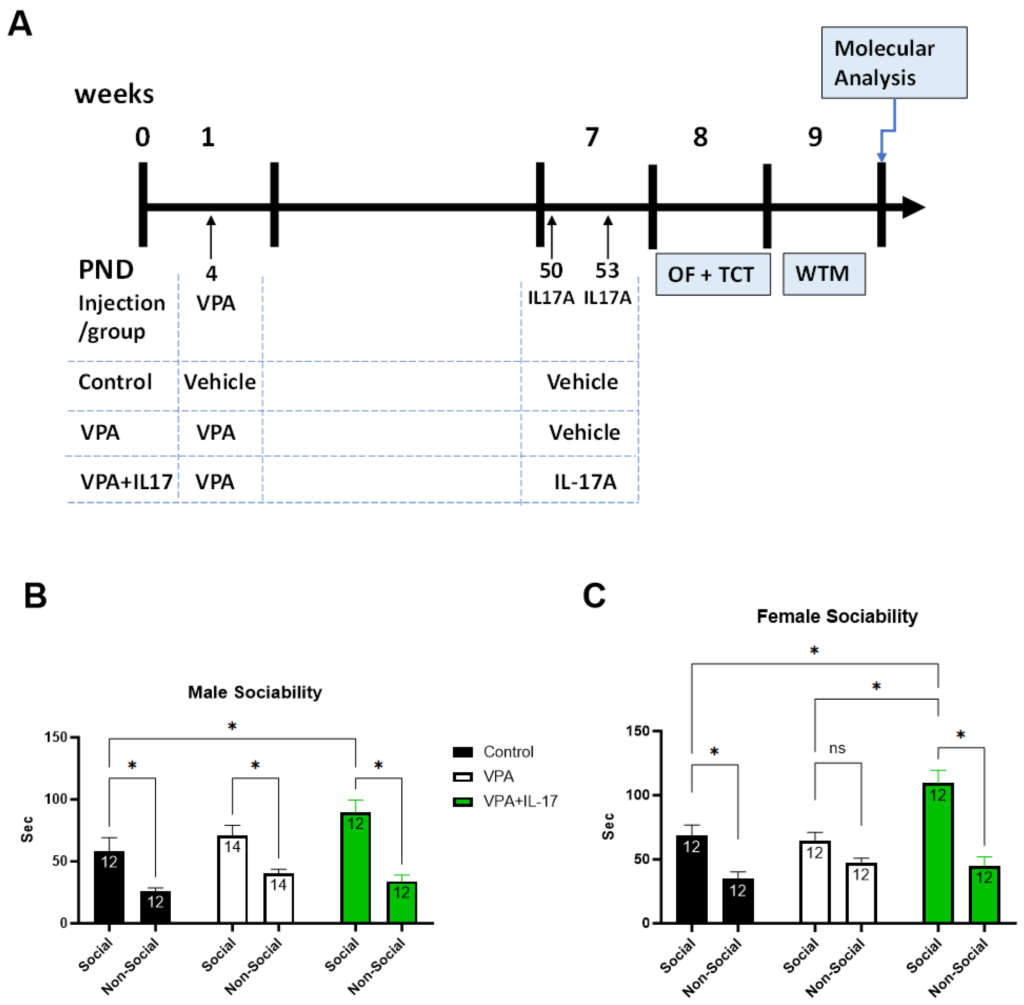
(A)部分は、実験の設計を概説した図であり、実験の経過が週単位と生後日数(PND)で示されている。VPAまたはIL-17Aの注射時点が各治療群にマークされ、コントロール群(VPAに暴露されず治療も受けていないマウス)、VPA群(ASDをモデル化したVPAに暴露されたが治療を受けていないマウス)、VPA+IL-17群(成人期にIL-17Aで治療されたVPA暴露マウス)が示されている。オープンフィールドパラダイム(OF)、3室社会的相互作用テストパラダイム(TCT)、水迷路パラダイム(WTM)が使用されている。VPA暴露マウスの社会的相互作用はTCTパラダイムを通じて評価されている。
(B)部分は、テストされた雄マウスが社会的刺激(新しいマウス)または非社会的刺激(空のケージ)との相互作用時間(秒)を示すグラフであり、各群のデータが示されている。
(C)部分は、同様にテストされた雌マウスのデータを示すグラフであり、社会的刺激または非社会的刺激との相互作用時間が秒単位で示されている。データは平均±標準誤差で示され、各バー内には各群のサンプル数が表示されている。* p < 0.05、nsは非有意、2ウェイANOVAを使用している。
Discussion
炎症性サイトカインであるIL-17は、ASDのような神経発達障害の病因である可能性が示唆されている [35,36]。マウスでは、母親の免疫活性化への発達期の曝露が、成人期の社会的行動障害と関連することが示された [13,37]。しかし意外なことに、IL-17Aの脳内投与は社会性障害を軽減することができ、社会的行動の調節においてサイトカインがポジティブな役割を果たすことが示唆された [13,38]。同様に、われわれは以前、IL-17の血清レベルの上昇が、トラウマにさらされたマウスにおける社交性の増加 [32]、および統合失調症マウスにおける社会的新奇嗜好性の増加 [39]と関連していることを示した。IL-17とTh17の血中濃度の上昇は、治療後の統合失調症患者における認知機能の改善とも関連していた [40]。本研究では、サイトカインIL-17Aを2回注射すると、社会的行動が改善し、ASD様行動が全体的に減少することが観察された(図1および図3E,F)。Th17関連サイトカイン、すなわち男性ではIL-17A、女性ではIL-17FとIL-21の血清レベルは、社会的行動と正の相関があり、ASDの総スコアと負の相関があることがわかった(図8)。興味深いことに、IL-17Aの推定半減期は8時間であるが、2回のIL-17A静脈内投与により、2週間後のIL-17Aの血清中濃度が男女ともに上昇した(図7A,B)[41]。我々は、IL-17A投与が、以前に示唆されたように、IL-17Aの内因性発現を上昇させる正のフィードバックループを誘発したと推測している[42,43]。
炎症性表現型への免疫系の変調は、ASD患者における重要な特徴であることが以前に示唆された [44]。胃腸(GI)を併存するASD児は、GIを併存しないASD児と比較して、末梢のTh17細胞集団の上昇を示したが、GIを併存しないASD児は、健常児と比較して、Th2およびTh1集団の増加を特徴とした[45]。さらに最近では、ASDと診断された小児では、コントロール小児と比較して、Th1、Th2、Th17亜集団のレベルが上昇し、Tregのレベルが低下していることが報告されている[46]。ASDのVPAモデルマウスでは、神経炎症の証拠を伴う炎症反応の亢進が雄でも観察され、VPAモデルでも同様に免疫系の調節異常が示唆された[47]。本研究では、VPA曝露動物と対照動物との血清サイトカインレベルに、オス・メスともに有意差は認められなかった(図7A,B)。にもかかわらず、Th関連サイトカインの相対量を比較すると、性差に依存した差異が観察された(図7C-F)。雄では異なるサイトカイン群間で差は認められなかったが、雌では、Th1およびTreg関連サイトカインの相対量は、VPA曝露動物では対照動物よりも高く、Th17関連サイトカインではその逆であった。IL-17A投与は、VPA曝露後に観察された変化を部分的に補正した。興味深いことに、これらのTh関連サイトカイン群の相対量は、コントロールのオスとメスで有意に異なり、コントロールのオスはVPA曝露メスの量に類似していた。また、IL-17Aを投与すると、男性では2つのサイトカインのみであったのに対し、女性では複数のサイトカインの血清中濃度が上昇したことから、以前から仮説が立てられていたように、ASDにおける男女間の免疫機能のベースラインの違いが示唆された[48]。これらの差は、以前に報告したASDモデルマウスにおいて、VPAに発達的に曝露された際の行動や前頭前野の遺伝子発現における性差に依存した差と一致する[33,34]。
IL-17Aが社会的行動に及ぼす影響は、以前に、母親の免疫活性化に影響されたマウスの子孫で観察されたように、体性感覚皮質(S1DZ)の神経細胞活性化の低下と関連していた [13]。本研究では、IL-17Aが成体海馬の神経新生に及ぼす影響の可能性を探った。これまでの研究で、私たちや他の研究者は、VPAに胎内曝露したマウスにおける成体海馬神経新生の障害を示している[26,27]。これらの研究では、神経前駆細胞の増殖低下、神経細胞の成熟低下、神経突起長の減少、歯状回の形態異常が報告されている。同様に、本研究では、歯状回の顆粒下帯における増殖神経前駆細胞の数が、男性では有意に減少しており、女性でも同様の傾向が見られたが有意ではなかった(図4C,D)。しかし、VPAに曝露した雌性では、コントロールと比較して、ダブルコルチン(DCX)を発現する新生ニューロンの数が増加した(図B)。それにもかかわらず、雌雄ともにDCX+の新生ニューロンは、神経突起の長さと樹状突起の複雑さが減少した異常な形態を示した(図5および図6)。海馬ニューロンの神経細胞新生障害は、ASDのBTBRマウスモデルでも以前に報告されている[49]。神経細胞新生の障害は、ASD患者で観察されるシナプス形成の異常と対応している[24,50]。IL-17Aによる処置は、以前に報告されたように、雄でも雌でも神経前駆細胞の増殖を増加させなかった(図4C,D)[31,32,51]。しかしながら、IL-17A投与は、以前の知見 [31]に従って、DCX+細胞の神経細胞新生を促進した(図5および図6)。同様に、ASD患者と対照患者から得られた人工多能性幹細胞由来のヒト神経前駆細胞は、外因性IL-17Aに応答して、in vitroで神経分化とシナプス形成の増加を示した[52]。
結論として、IL-17Aは脳の発達過程においてASDの免疫に関連した病態形成に重要な役割を果たす可能性があるが、我々の研究では、その後の年齢においても行動表現型を維持する役割を果たす可能性があることを示している。これらの結果は、母親の免疫活性化によって誘発された社会的欠損の神経発達モデルにおいて、IL-17Aの脳内投与後に社会的行動が増加したことを示したReedらの報告と一致する[13]。意外なことに、同様の現象は外傷性脳損傷モデルでも観察され、IL-17A KOマウスは対照マウスよりも損傷後の記憶保持課題の成績が悪かった [53]。このように、ASDにおけるIL-17の役割には、ASDの病態のメディエーターとして、またASDの行動障害を解決する重要な要素として、二重の役割がある可能性が示唆される。我々は、IL-17の神経新生、特に神経細胞新生に対する作用が、ASD様行動を緩和する重要なメカニズムであることを提案する。
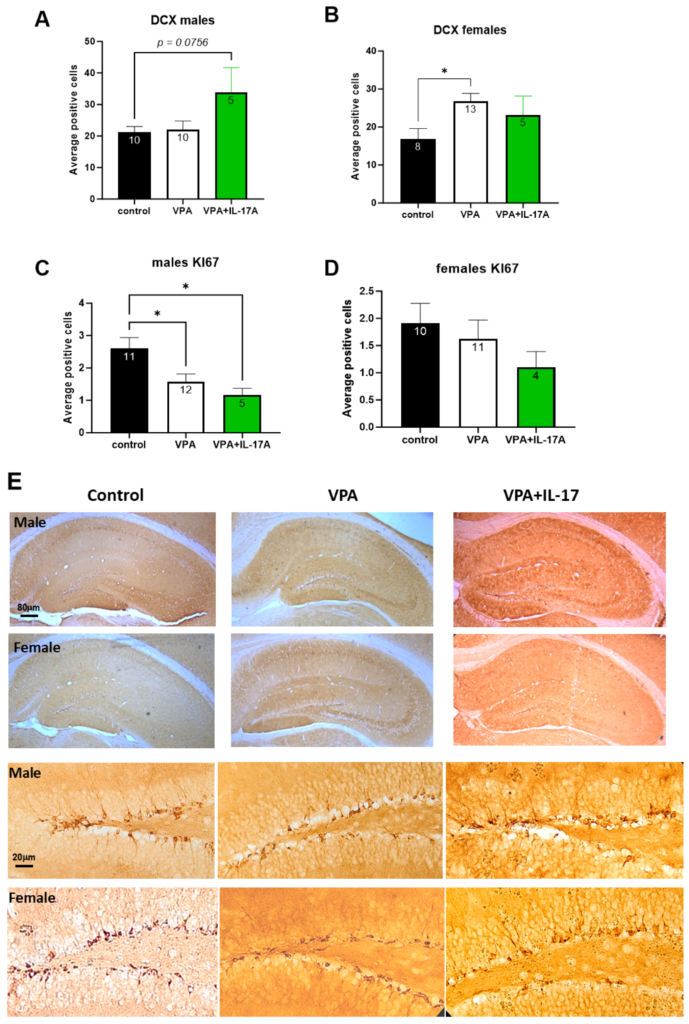
(A) このグラフは、雄マウスの海馬断面ごとの顆粒細胞層(GCL)における二重皮質遺伝子(DCX)を発現する初期分化ニューロン(DCX+細胞)の平均数を示している。
(B) このグラフは、雌マウスの海馬断面ごとのGCLにおけるDCX+細胞の平均数を示している。
(C) このグラフは、雄マウスの海馬断面ごとの歯状回の下顆粒層におけるKi67陽性核の平均数を示している。
(D) このグラフは、雌マウスの海馬断面ごとの歯状回の下顆粒層におけるKi67陽性核の平均数を示している。
(E) GCL内のDCX+細胞の低倍率および高倍率の顕微鏡写真。
コントロール群は、VPAに暴露されず、何の治療も受けていないマウス群を表す。VPA群は、ASDをモデル化したVPAに暴露されたが治療を受けていないマウス群を表す。VPA+IL-17群は、成人期にIL-17Aで治療されたVPA暴露マウスを表す。データは平均±標準誤差で示され、各バー内には各群のサンプル数が表示されている。* p < 0.05、one way-ANOVA。雄と雌の間で有意な差は観察されなかった(two-way ANOVA)。
