
Septin-Mediated Mechanobiological Reprogramming of T Cell Transmigration and 3D Motility (セプチンを介したT細胞の移動と3次元運動のメカノバイオロジー的リプログラミング)
doi: https://doi.org/10.1101/2022.01.18.476840
Alexander S. Zhovmer (Center for Biologics Evaluation & Research, U.S. Food and Drug Administration, Silver Spring, MD, USA)
ABSTRACT
T cells migrate in nearly every healthy, inflamed or diseased tissue. Such ‘all-terrain’ motility is achieved by a dynamic mechanobiological balance between amoeboid and mesenchymal-like migration modes. Here, we report that septin proteins function as a key regulator of migratory balance in T cells. We show that active septins compartmentalize the lymphocyte’s cortex into a peristaltically treadmilling ‘tube’ during avoidance response to mechanically crowding hindrances. T cell cortical peristaltism mechanically channels nucleus and cytoplasm between mechanically crowding 3D collagen fibers. Septins’ inactivation shifts T cell motility balance towards mesenchymal-like mode, characterized by distinct contact guidance and MAP4-, SEPT9-, HDAC6-mediated enhancement of microtubules and microtubule-associated dynein contractility. The non-stretchable microtubular cables secure structurally coherent cell passage through confining spaces and long-distance transmission of dynein-generated forces, which replace diminished actomyosin contractility. Thus, septins provide T cells with a structural and signaling molecular switch between actomyosin-driven amoeboid and dynein-driven mesenchymal-like migration.
T細胞は、健常組織、炎症組織、疾患組織のほぼ全てにおいて遊走する。このような「全地形的」移動は、アメーバ様移動様式と間葉様移動様式の間の動的な力学生物学的バランスによって達成される。ここで我々は、セプチンタンパク質がT細胞における遊走バランスの重要な制御因子として機能していることを報告する。我々は、機械的に混雑した障害物に対する回避反応において、活性型セプチンがリンパ球の皮質を蠕動運動する「チューブ」に区画化することを示した。T細胞皮質の蠕動運動は、機械的に混雑する3次元コラーゲン線維の間に核と細胞質を機械的に流す。セプチンの不活性化は、T細胞の運動バランスを間葉様モードへとシフトさせるが、これは、明確な接触誘導と、MAP4、SEPT9、HDAC6を介した微小管と微小管関連ダイニンの収縮性の増強によって特徴づけられる。非伸縮性の微小管ケーブルは、閉塞空間を通る構造的に首尾一貫した細胞通過と、ダイニンが発生する力の長距離伝達を確保し、アクトミオシン収縮力の低下に取って代わる。このように、セプチンはT細胞に、アクトミオシン駆動のアメーバ様移動とダイニン駆動の間葉様移動の間の構造的およびシグナル伝達的分子スイッチを提供している。
セプチンは、植物以外の全ての真核生物で発現しているGTP結合タンパク質である。さまざまなセプチンが互いに結合し、タンパク質複合体を形成する。こうした複合体はさらにフィラメント、リング、ガーゼ状の構造へと組み立てられ、他のタンパク質を局在させる機能を果たす。こうした局在化は、他のタンパク質が接着する足場を提供する、細胞のある区画から他の区画への分子の拡散を防ぐ障壁を形成する、もしくは細胞皮質で膜結合タンパク質の拡散を防ぐ障壁となる、といった手法で行われる。
セプチンは細胞分裂部位や繊毛や鞭毛などの特殊な構造体が細胞体に接着する部位の細胞膜へ細胞過程を局在させる役割を持つことが示唆されている。セプチンは酵母細胞の細胞分裂時に細胞を区画化し、隔壁(英語版)(septum)を構造的に支持する足場を構築することから、その名が付けられている。ヒト細胞での研究からは、セプチンは病原性細菌の周囲にカゴ状の構造を構築し、細菌を動けなくすることで他の細胞への侵入を防いでいることが示唆されている。セプチンはフィラメント形成タンパク質であるため、細胞骨格の一部であると考えられている[4]。極性を持たないフィラメントの形成に加えて、セプチンは細胞膜、細胞皮質、アクチンフィラメント、微小管と結合する。(Wkipedia)
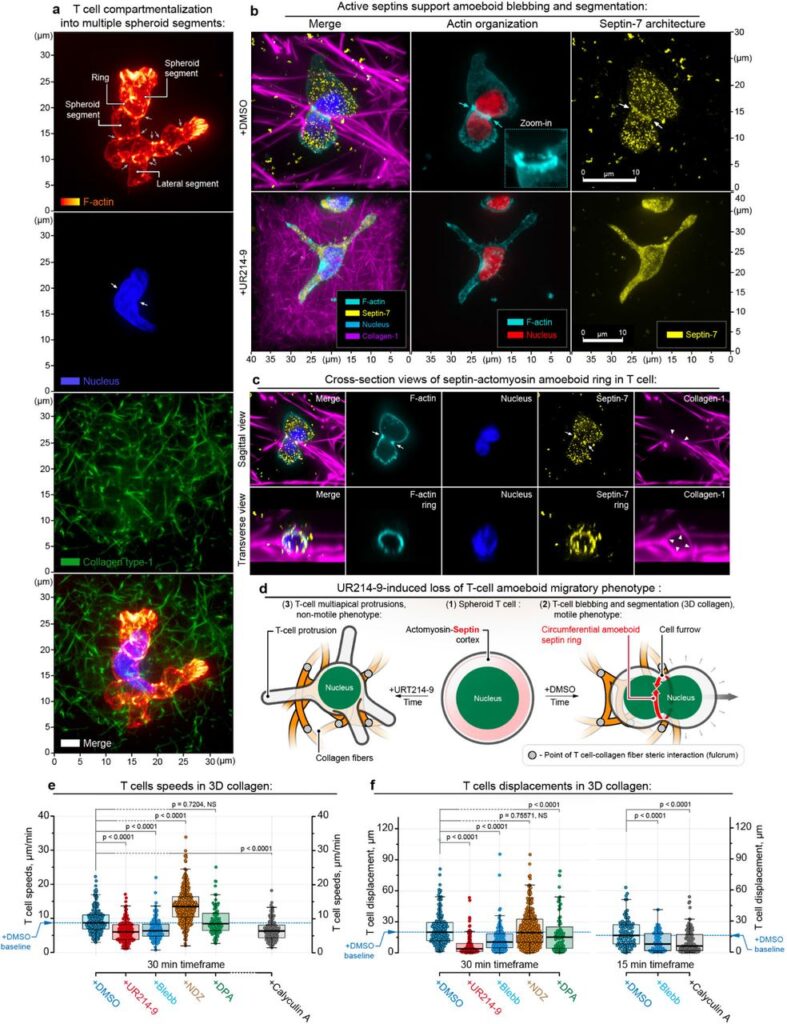
(a) ヒトCD4+ T細胞の区画化:コラーゲン(タイプI)3Dマトリックス内でのヒトCD4+ T細胞は、複数の球状セグメントに区画化される。これらのセグメントは、F-アクチンが豊富な皮質リング(ファロイジンF-アクチンチャンネルの矢印)によって分けられ、通過する核を変形させ、凹ませる(核チャンネルの矢印)。
(b) hCD4+ T細胞の運動:コントロール条件(+DMSO)下の3Dコラーゲンマトリックス内のhCD4+ T細胞は、セプチン陽性の先導皮質リング(セプチン-7免疫蛍光およびファロイジンイメージングの矢印)を保ちながらアメーバ様セグメンテーションを維持してアクティブに移動する。アメーバ様T細胞は、移動中にその変形可能な核を皮質リングを通過させる。また、コントロール条件下のT細胞では、セプチン-7が細胞質の小胞構造や細胞外の小胞(例:マイクロ小胞)にも豊富である。 一方、セプチン阻害(+UR214-9)下のhCD4+ T細胞はセプチンに基づく皮質リングを形成せず、皮質の区画化と移動行動が失われる。代わりにT細胞は伸長した非移動形態を取り、複数の突起を持つ。UR214-9はセプチンに富む細胞質および細胞外の小胞(セプチン-7免疫蛍光で示される)の減少を引き起こす。
(c) セプチン強化皮質リングの詳細な断面図:移動するT細胞内のセプチン強化(セプチン-7免疫蛍光)皮質リングの詳細な横断面および矢状断面図が示される。セプチンとF-アクチンの皮質リングは、制限されたコラーゲン腔内(矢印)で形成される。
(d) 細胞構造への反応の模式図:球状T細胞が複雑な立体環境内で移動するアメーバ様細胞へと移行する模式図、およびセプチン化学的抑制(UR214-9)に対するT細胞の構造的応答が示される。
Summary
- 研究の要約:T細胞は、ほぼすべての健康な組織や炎症、病気の組織で移動する能力を持っている。この「オールテレイン」の移動能力は、アメーバ様と中間葉様の移動モード間の動的なメカノバイオロジカルバランスによって達成される。
- セプチンの役割:セプチンタンパク質は、T細胞の移動バランスの重要な調節因子である。セプチンは、T細胞が密集した障害物を避ける際の応答として、リンパ球の皮質を蠕動運動する「チューブ」に区画化する。
- 移動モードの変化:セプチンの不活性化により、T細胞の移動モードはアメーバ様から、マイクロチューブとマイクロチューブ関連ダイニン収縮性を強化する中間葉様モードへと変化する。
Background
- 免疫細胞の運動:リンパ球は様々な物理的環境を感知し、その運動を最適化するために細胞骨格の構造を変える能力を持つ。リンパ球は、アメーバ様と中間葉様の移動モードを含む様々な運動メカニズムを利用する。
- 未解明の問題:リンパ球がこれらの移動メカニズムをどのようにバランスさせ、主要な細胞骨格システム(アクトミオシン、マイクロチューブ、セプチン)をどのように再編成するかはまだ十分に理解されていない。
Methods
- 研究方法:ヒトCD4+ T細胞のセプチンとアクトミオシンの再編成を調査する。移動中のT細胞の細胞骨格ダイナミクスの即時効果を検出するため、短期実験でのセプチン不活性化を目指す。
- 使用された手法:セプチン活性の急激な変化を実時間で検出するため、選択的なセプチン阻害剤を使用して、アクトミオシンとの相互作用を急速に失わせる。
Results
- T細胞の皮質区画化:T細胞は3Dコラーゲンマトリックス内で移動する際に、セプチンとF-アクチンが豊富な円周状皮質リングによって皮質を区画化する。これにより、細胞皮質は多段階に分かれた「チューブ」となり、核と細胞質がリングを通過する。
- 皮質リングの機能:T細胞の皮質リングは、細胞表面と周囲のコラーゲン繊維との間に一時的な固定を提供し、細胞質と核の蠕動移動を支援する。
Discussion
- セプチンの役割:セプチンはT細胞のアメーバ様から中間葉様運動への移行を制御するスイッチとして機能する。セプチンの不活性化は、T細胞の形態と移動におけるアメーバ様ダイナミクスの抑制と、2D接着誘導キューへの適合性向上をもたらす。
- マイクロチューブの役割:セプチンの抑制に伴い、T細胞ではマイクロチューブの密度と長さが増加し、これにより細胞の力学的な剛性が高まる。
この論文は、T細胞の移動機能におけるセプチンの重要な役割を明らかにし、免疫応答や疾患治療に関する新たな洞察を提供するものである。
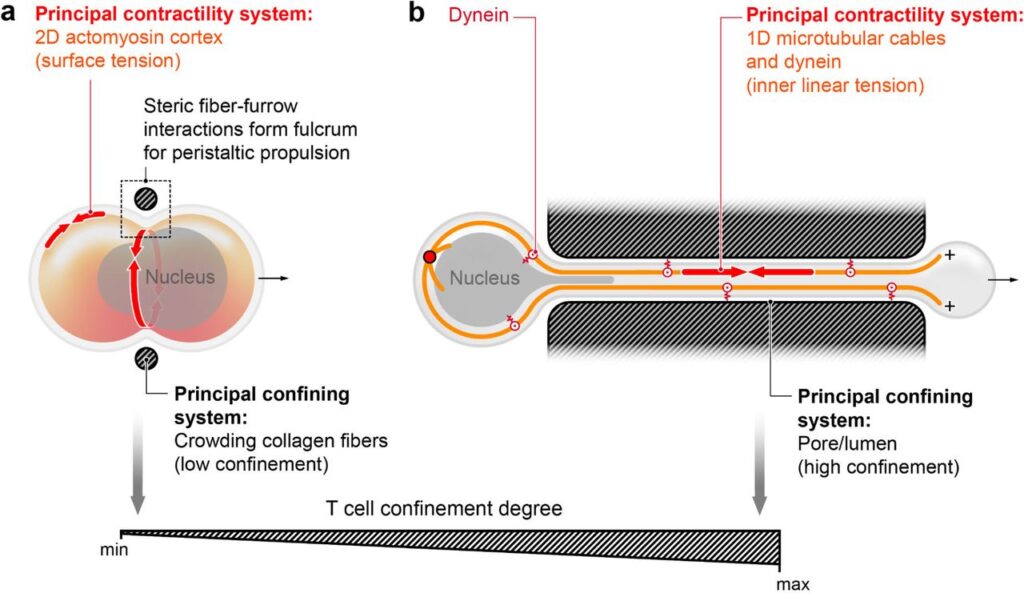
(a) セプチンによるアメーバ様皮質蠕動収縮:セプチンによって構造化されたアメーバ様の皮質蠕動収縮は、低制約条件下でのコラーゲン繊維間のT細胞移動を機械的にチャネル化する。
(b) 細胞質メセンキマル様越境移動:高い制約空間(細孔)を通るT細胞のメセンキマル様越境移動は、微小管ケーブルを介して主要なT細胞軸に沿って伝達されるダイニンによって生成される機械的力によって駆動される。

本ページの作成の一部にpaper interpreterを使用しています。