SCIENCE ADVANCES 8 Nov 2023 Vol 9, Issue 45
Immune activation state modulates infant engram expression across development (免疫活性化状態は、発達段階にわたって乳児のエングラム(記憶痕跡)発現を調節する)
Sarah D Power 1 2 3, Erika Stewart 1 2, Louisa G Zielke 1 2 4, Eric P Byrne 1, Aaron Douglas 1 2, Clara Ortega-de San Luis 1 2, Lydia Lynch 1 5, Tomás J Ryan 1 2 6 7
Affiliations
- 1School of Biochemistry and Immunology, Trinity College Dublin, Dublin, Ireland.
- 2Trinity College Institute for Neuroscience, Trinity College Dublin, Dublin, Ireland.
- 3Center for Lifespan Psychology, Max Planck Institute for Human Development, Berlin, Germany.
- 4Faculty of Psychology and Neuroscience, Maastricht University, Maastricht, Netherlands.
- 5Brigham and Women’s Hospital, Harvard Medical School, Boston, MA, USA.
- 6Florey Institute of Neuroscience and Mental Health, Melbourne Brain Centre, University of Melbourne, Melbourne, VIC, Australia.
- 7Child & Brain Development Program, Canadian Institute for Advanced Research (CIFAR), Toronto, ON, Canada.
トリニティ・カレッジは、ダブリン2区カレッジ・グリーンに本部を置くアイルランドの国立大学、ダブリン大学を構成する唯一のカレッジである。1592年に設置された。ダブリン大学トリニティ・カレッジとも称され、大学の略称はTCD。(Wikipedia)
乳幼児期を思い出せない理由〜日経サイエンス2014年10月号より
Abstract
Infantile amnesia is possibly the most ubiquitous form of memory loss in mammals. We investigated how memories are stored in the brain throughout development by integrating engram labeling technology with mouse models of infantile amnesia. Here, we found a phenomenon in which male offspring in maternal immune activation models of autism spectrum disorder do not experience infantile amnesia. Maternal immune activation altered engram ensemble size and dendritic spine plasticity. We rescued the same apparently forgotten infantile memories in neurotypical mice by optogenetically reactivating dentate gyrus engram cells labeled during complex experiences in infancy. Furthermore, we permanently reinstated lost infantile memories by artificially updating the memory engram, demonstrating that infantile amnesia is a reversible process. Our findings suggest not only that infantile amnesia is due to a reversible retrieval deficit in engram expression but also that immune activation during development modulates innate, and reversible, forgetting switches that determine whether infantile amnesia will occur.
幼児期健忘は、おそらく哺乳類において最も普遍的な記憶喪失の形態である。われわれは、エングラム標識技術と小児健忘モデルマウスを統合することにより、発生を通じて記憶がどのように脳に蓄積されるかを調べた。その結果、自閉症スペクトラム障害の母体免疫活性化モデルにおいて、オスの子どもは幼児期健忘を経験しないという現象を発見した。母性免疫活性化は、エングラムアンサンブルのサイズと樹状突起スパインの可塑性を変化させた。われわれは、幼児期の複雑な体験の際に標識された歯状回エングラム細胞を光遺伝学的に再活性化することによって、定型発達(NT)マウスにおいて、明らかに忘れてしまった幼児期の記憶と同じものを復活させた。さらに、人為的に記憶エングラムを更新することで、失われた幼児期の記憶を永続的に復活させ、幼児期の健忘が可逆的なプロセスであることを実証した。この結果は、幼児期健忘がエングラム発現の可逆的な検索欠損によるものであることだけでなく、発達過程における免疫活性化が、幼児期健忘が起こるかどうかを決定する、生得的で可逆的な忘却スイッチを調節することを示唆している。
Abstract
- この研究は、哺乳類において一般的な幼児期健忘症、つまり早期発達中に形成された記憶の急速な忘却に焦点を当てている。
- 研究者たちは、エングラムラベリング技術とマウスモデルを用いて、母親の免疫活性化(MIA)がこの種の記憶喪失に与える影響を調査している。
Background
- 幼児期健忘症は、人間を含む哺乳類で広く見られる現象で、幼少期に形成された文脈的および恐怖記憶の忘却が特徴である。
- この研究は、幼児期健忘症の基本的な神経生物学と、特定の記憶をエンコードするエングラム細胞アンサンブルへの影響について調べた。
Materials and Methods
- 研究者たちは、Creを用いたエングラムラベリング戦略を用いて、幼児マウスのエングラム細胞を全脳的にタギングした。
- これにより、幼児期に形成された恐怖記憶の保持と、エングラムラベリングとスパイン密度の増加を観察することが可能になった。
Results
- 幼児期の記憶とMIA: 研究では、幼児期に形成された恐怖記憶に対するMIA子孫の反応を調査しました。この結果、MIAモデルの雄の子孫は幼児期健忘症を経験せず、エングラムアンサンブルのサイズと樹状突起スパインの可塑性が変化していることが観察された。
- エングラムラベリングと記憶の回復: 研究者たちはエングラムラベリング技術を使用して、幼児期に形成された記憶の保持を観察しました。特に、幼児マウスでの恐怖記憶の保持と、エングラムラベリングとスパイン密度の増加が確認された。
- オプトジェネティック刺激による記憶の復活: オプトジェネティックに刺激された幼児ラベル付けされた歯状回DGエングラム細胞は、成体マウスで忘れ去られた記憶を急性かつ恒久的に再確立することができることが示された。
- 様々な記憶タイプへの影響: MIAの仔は空間や物体記憶の幼児期健忘症を示さず、これらの記憶タイプもコントロール子孫でオプトジェネティックに活性化することが可能であった。
- IL-17aの役割: IL-17aは、MIAが幼児期健忘症に与える影響にとって十分であり、必要であることが確認された。IL-17aをノックアウトしたマウスでは、MIAの効果が幼児期健忘症に及ばなかったことから、このサイトカインが重要な役割を果たしていることが示された。
Discussion
- 幼児期健忘症の先天性: 研究結果は、幼児期健忘症が出生後の特定の環境経験に影響されない、先天的な自然な忘却の形態であることを示唆しています。これは、胚発生中の免疫活性化が幼児期健忘症の自然な忘却プロセスを変更する可能性があることを意味する。
- MIAの影響と神経生物学的機構: MIAがエングラム細胞の構造と機能にどのように影響を与えるかについての洞察が提供されました。具体的には、MIAがエングラムアンサンブルのサイズと樹状突起スパインの可塑性を変化させることが示された。
- オプトジェネティック技術の応用: 成体マウスでの幼児期に形成された記憶の復活とその永続性についての議論がなされた。これは、幼児期健忘症が可逆的なプロセスであることを示唆する。
- IL-17aの重要性: IL-17aがMIAの効果にとって重要であることが示され、このサイトカインが幼児期健忘症の発生において重要な役割を果たしていることが強調された。
- 将来の研究と応用の可能性: これらの発見は、幼児期健忘症と記憶保持メカニズムに関するさらなる研究を促し、ロッドと人間での一生を通じた記憶と忘却に関する翻訳研究の可能性を提供する。
これらの結果と議論は、幼児期健忘症の理解を深め、発達初期の免疫活性化が記憶形成に与える影響に関する新たな洞察を提供する。
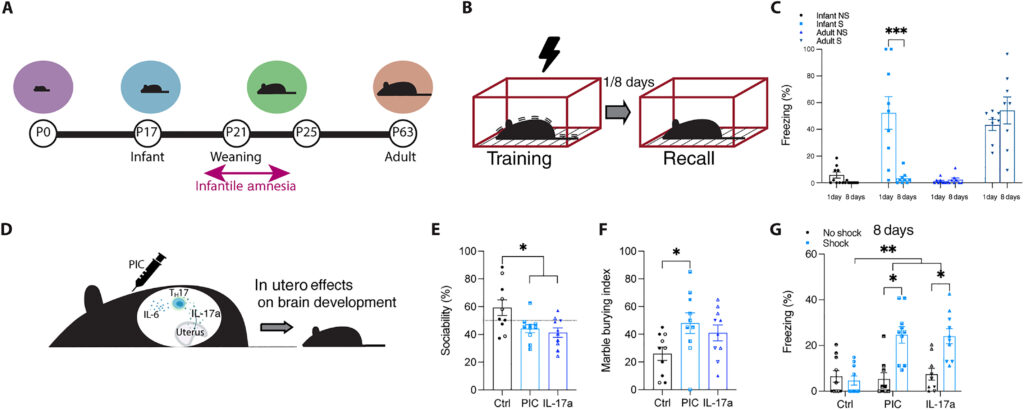
(A) 幼児マウスの発達軌跡。(B)行動スケジュール。黒い稲妻のシンボルは足によるショックを表す。マウスは文脈恐怖条件付け(CFC)を用いて文脈Aで訓練され、1日後または8日後に想起テストを受ける。Sはショック、NSはショックなし。(成体(P63)C57BL/6 J雄マウス(n = 8)は、訓練1日後と8日後の両方で、ショックなしの対照(n = 8)よりも、文脈Aで有意に多く固まった。幼児(P17)C57BL/6 J系雄性マウス(n=9)は、訓練1日後の想起時にショックなし対照群よりも有意に多く固まった。訓練8日後の想起テストでは、群間(n = 9)で凍りつきfreezingに有意差はなかった。(D)妊娠中のDamにおける母体免疫活性化(MIA)の代表図。E)MIA成体C57BL/6 J雄子供(n = 10)の社会的選好指数(全対象物調査時間のうち社会的刺激を探索した時間の割合)。(F) MIA成体C57BL/6 J雄子供(n = 10)のビー玉埋没行動。ビー玉埋没指数をy軸にプロットした。(G) C57BL/6雄性MIA子孫におけるP17でのCFC後の文脈Aでの記憶想起(n = 10)。P<0.05、P<0.01、P<0.001は、(C)二元配置分散分析(ANOVA)、または(E~G)入れ子ANOVAとボンフェローニ・ポストホック検定によって算出した。データは平均値±SEMで示した。IL-6、インターロイキン-6;IL-17a、インターロイキン-17a;TH17、Tヘルパー17。
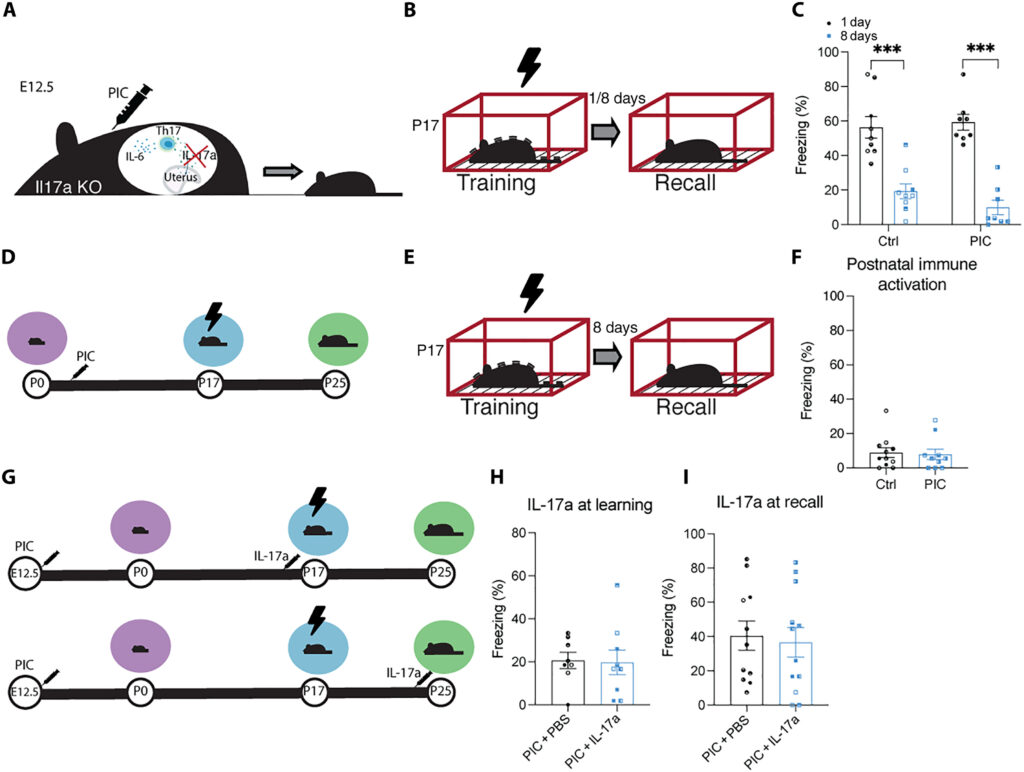
(A)IL17a KOマウスにおけるMIAの代表図。(B) Il17a KO雄マウスにおけるCFCの行動スケジュール。(C) Il17a KO雄性乳児マウスの訓練1日後または8日後の想起時の凍結freezingレベル。(D) C57BL/6 J 幼児マウスにおける生後免疫活性化の行動スケジュール。注射器の記号はP3、P7、P14におけるPIC注射を表す。(E)CFCの行動スキーマ。(F)訓練8日後の雄マウスの凍結レベル。(G) MIA C57BL/6 Jの子マウスにおいて、記憶の符号化(P17)または想起(P25)の3時間前にIL-17aを注射する行動スケジュール。(HおよびI) 訓練8日後に検査したときの雄マウス乳児の凍結レベル。P<0.05、P<0.01、P<0.001は、(F、H、I)入れ子のStudent’s t testまたは(C)入れ子のANOVAとBonferroni post hoc testにより算出。データは±SEMで示した。
Introduction
幼児期健忘とは、発達初期に形成された記憶を急速に忘れてしまうことであり、ヒトの全人口が罹患しているように見えるが、ほとんど無視されている記憶喪失の一形態である。ヒトだけの現象ではなく、このような健忘症はげっ歯類でも記録されており、乳児期に形成された文脈記憶や恐怖記憶の忘却を示す。乳児期健忘の基本的な神経生物学や、特定の記憶をエンコードするエングラム細胞アンサンブルへの影響についてはほとんど知られていない。活動依存的アンサンブル・ラベリングとオプトジェネティクスの統合により、健忘症の場合でも記憶エングラムが脳内にまだ存在するか、あるいは機能しているかを調べることが可能になった。この方法論を用いると、海馬や他の脳領域にあるエングラム細胞を光遺伝学的に活性化することで、健忘後に記憶の想起を誘導できることが示され、これらの記憶が脳内にまだ存在するだけでなく、回復可能であることが実証されている。この枠組みは、発達が幼児期の記憶の保存と検索にどのような影響を与えるかを調べる機会を提供する。環境条件は学習と忘却の両方の速度に強く影響するが、発達の軌跡が変化した場合に忘却がどのように起こるかについてはあまり知られていない。胎生期や出生後の発達期には、発達中の脳が環境からの影響に敏感になる時期がある(6, 13-18)。乳児期健忘は、γ-アミノ酪酸アゴニスト(19-21)やコルチコステロイド(6)、あるいはニューロトロフィンの異所性投与(22)を用いた生後の薬理学的介入によって予防可能であることが示されている。免疫系の活性化やそれに続くサイトカイン放出などの胚発生中の出来事は、自閉症スペクトラム障害(ASD)や統合失調症に関連する発達の軌道の変化を引き起こすことが知られているが、エングラム機能への影響については調べられていない。ここでは、動物の発達経験に起因する幼児期健忘症の自然発生的変異を同定し、次にエングラム細胞機能への影響を調べようとした。
Discussion
幼児期の健忘、エングラムの発現、子宮内の免疫活性化状態を三位一体とした一連の統合的な解析を行った。これらの知見を総合すると、さまざまな記憶タイプの幼児期健忘と、記憶の基質としてのエングラム細胞は、胎生期の被験者の免疫学的経験によって調節できることが示された。MIAの効果により、生後発達を経ても乳児エングラムの自然な検索性が維持される。さらに、MIAがエングラムの可塑性を構造レベルで直接調節し、エングラムのアンサンブルサイズとエングラム樹状突起スパイン密度を変化させることがわかった。さらに、MIA下では、想起時に非エングラム細胞の活動が著しく減少するため、エングラムの再活性化はより大きな潜在的特異性を示す。このことは、競合するアンサンブルの干渉が減少したことを反映しているのかもしれない(53, 54)。さらに、われわれのデータは、多くのタイプの幼児記憶は発達の過程で自然に抑制されるが、そのエングラムは持続し、成人期には光遺伝学的直接刺激によって急性に活性化できることを示している(31)。最後に、下流のサイトカインであるIL-17aが、乳児期健忘に対するMIAの効果に十分かつ必要であることを示す。
これらの知見は、光遺伝学的な幼児記憶の再活性化が恐怖条件付けに特異的なものではなく、より複雑なナビゲーションや認識タスクの記憶も救出できることを示している。さらに、エングラムを人為的に更新することで、行動レベルでも細胞レベルでも標的記憶への自然なアクセスが回復し、幼児期健忘が逆転した。また、乳幼児期に形成されたエングラム細胞間の特異的な結合パターンは、分散した脳領域にわたって、成人期になってもそのまま残っている。このような分散したエングラムの結合パターンは、他の種類の健忘症でも生き残ることが示されており、脳に保持される特定の記憶情報(エングラムそのもの)を説明できるかもしれない(8, 9, 45, 55-58)。
われわれの分析や他の分析によれば、乳児期の健忘は生得的な自然忘却の一形態であり、生後発達中の特定の環境経験によって調節されることはないようである。胎内での免疫活性化は、エングラムを形成する能力が変化した脳状態の発達をもたらし、乳児期健忘は起こらない。出生後の免疫活性化は乳児期健忘に影響を与えないようであり、生得的な所定の忘却スイッチが出生時から固定されていると考えるのが妥当である。しかし、MIAとASDの遺伝的危険因子との相互作用により、出生後の炎症が忘却率を変化させる可能性がある(52, 59)。
我々の知見は、ASDの免疫学的モデルにおいて、乳児期の健忘を可能にする脳の状態が存在しないことを示唆しており、これらの知見は、ASDの症例において長期記憶保持が改善されたという証拠を提供している遺伝子改変動物やヒトのレトロスペクティブ研究を想起させる(60, 61)。MIA児の脳の状態は、幼児期健忘を示さないと思われる前社会性の哺乳類のそれを反映している可能性が考えられる(4, 62)。幼児期健忘は、重要な時期に発達可塑性によって調節されうる、遺伝的に調整された自然忘却の一形態なのかもしれない。今後の研究では、幼児期健忘の発生時期を決定するスイッチングメカニズムの性質、免疫系との相互作用、エングラム細胞機能とエングラムアンサンブル発現に対する可逆的な影響を明らかにする必要がある。将来、MIAモデルは、げっ歯類やヒトの生涯にわたる記憶と忘却に関するトランスレーショナルな研究の機会を提供するかもしれない(63)。

*記事の作成の一部に、paper interpreterを使用しています。