Nature (2023) Published: 13 September 2023
A cross-species proteomic map reveals neoteny of human synapse development (種を超えたプロテオミクスマップにより、ヒトのシナプス発達のネオテニー性が明らかになった)
Li Wang, Kaifang Pang, Li Zhou, Arantxa Cebrián-Silla, Susana González-Granero, Shaohui Wang, Qiuli Bi, Matthew L. White, Brandon Ho, Jiani Li, Tao Li, Yonatan Perez, Eric J. Huang, Ethan A. Winkler, Mercedes F. Paredes, Rothem Kovner, Nenad Sestan, Alex A. Pollen, Pengyuan Liu, Jingjing Li, Xianhua Piao, José Manuel García-Verdugo, Arturo Alvarez-Buylla, Zhandong Liu & Arnold R. Kriegstein
Abstract
The molecular mechanisms and evolutionary changes accompanying synapse development are still poorly understood1,2. Here we generate a cross-species proteomic map of synapse development in the human, macaque and mouse neocortex. By tracking the changes of more than 1,000 postsynaptic density (PSD) proteins from midgestation to young adulthood, we find that PSD maturation in humans separates into three major phases that are dominated by distinct pathways. Cross-species comparisons reveal that human PSDs mature about two to three times slower than those of other species and contain higher levels of Rho guanine nucleotide exchange factors (RhoGEFs) in the perinatal period. Enhancement of RhoGEF signalling in human neurons delays morphological maturation of dendritic spines and functional maturation of synapses, potentially contributing to the neotenic traits of human brain development. In addition, PSD proteins can be divided into four modules that exert stage- and cell-type-specific functions, possibly explaining their differential associations with cognitive functions and diseases. Our proteomic map of synapse development provides a blueprint for studying the molecular basis and evolutionary changes of synapse maturation.
シナプス発生に伴う分子メカニズムや進化的変化は、まだ十分に解明されていない。ここでは、ヒト、サル、マウスの大脳新皮質におけるシナプス発達の種を超えたプロテオミクスマップを作成した。1,000個以上のシナプス後密度(PSD)タンパク質の変化を妊娠中期から成体期まで追跡することで、ヒトのPSD成熟は、異なる経路が支配する3つの主要な段階に分かれることがわかった。種間比較から、ヒトのPSDの成熟は他の種のPSDの約2~3倍遅く、周産期にはRhoグアニンヌクレオチド交換因子(RhoGEF)のレベルが高いことが明らかになった。ヒトの神経細胞におけるRhoGEFシグナル伝達の亢進は、樹状突起スパインの形態学的成熟とシナプスの機能的成熟を遅延させ、ヒトの脳発達の新生児的特徴の一因となっている可能性がある。さらに、PSDタンパク質は4つのモジュールに分けられ、ステージや細胞タイプに特異的な機能を発揮することから、認知機能や疾患との関連性の違いを説明できる可能性がある。シナプス発生のプロテオミクスマップは、シナプス成熟の分子基盤や進化的変化を研究するための青写真(ブループリント)となる。
Introduction
シナプスは、脳の情報処理を仲介する神経細胞ネットワークを構築する。シナプスの機能不全は、小児期から成人期にかけて発症するほとんどの脳疾患に関与している。従って、シナプスの形成、成熟、特異性を理解することは、ヒトの認知や精神疾患を理解する上で極めて重要である。
脳には興奮性のグルタミン酸作動性シナプスと抑制性のGABA作動性シナプスの2種類の化学シナプスが存在する。これらのシナプスは神経伝達物質、形態、分子組成、シナプス後の組織において異なっている。興奮性シナプスには、シナプス後膜の下にPSDという特殊な構造があり、これは抑制性シナプスのそれよりも顕著である。PSDは、シナプス内の組織化センターおよびシグナル伝達装置として機能し、1,000以上のタンパク質からなる高度なタンパク質複合体である9。これらのタンパク質の変化は、130以上の脳疾患に関連している。
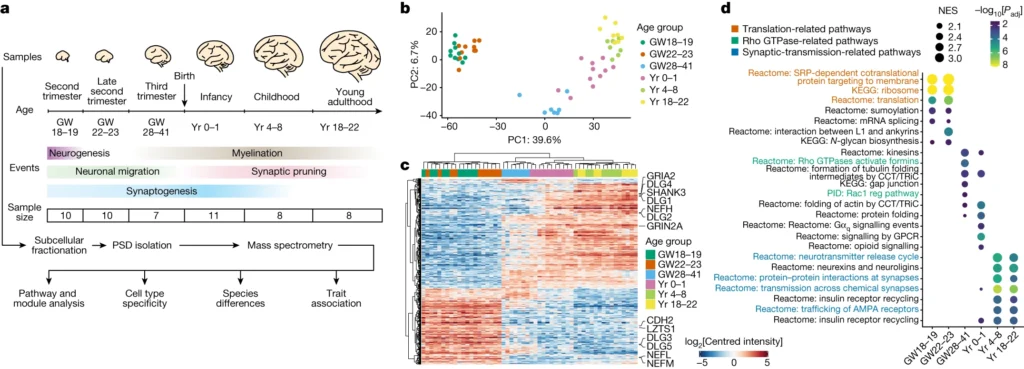
脳が発達する過程で、興奮性シナプスとそれに関連するPSDは、形態的・組成的に大きな変化を遂げる。例えば、グルタミン酸受容体サブユニットGRIN2BからGRIN2A、足場タンパク質DLG3からDLG4への発達的な移行は、シナプスの成熟に重要である。しかし、これらの発生的変化の研究は、成体脳で一般的に同定される数十種類のよく知られたPSDタンパク質に限られている。特にヒトでは、偏りのない系統的な特性解析は限られている。さらに、シナプスの密度、構成、成熟速度は種によって異なり、神経伝達特性、認知能力、行動レパートリーの進化的変化に寄与している可能性がある。例えば、ヒトのシナプスの成熟やネオテニーの延長は、ヒト特有の認知特性の出現を説明する可能性が示唆されている。とはいえ、その根底にある分子メカニズムについてはまだほとんどわかっていない。
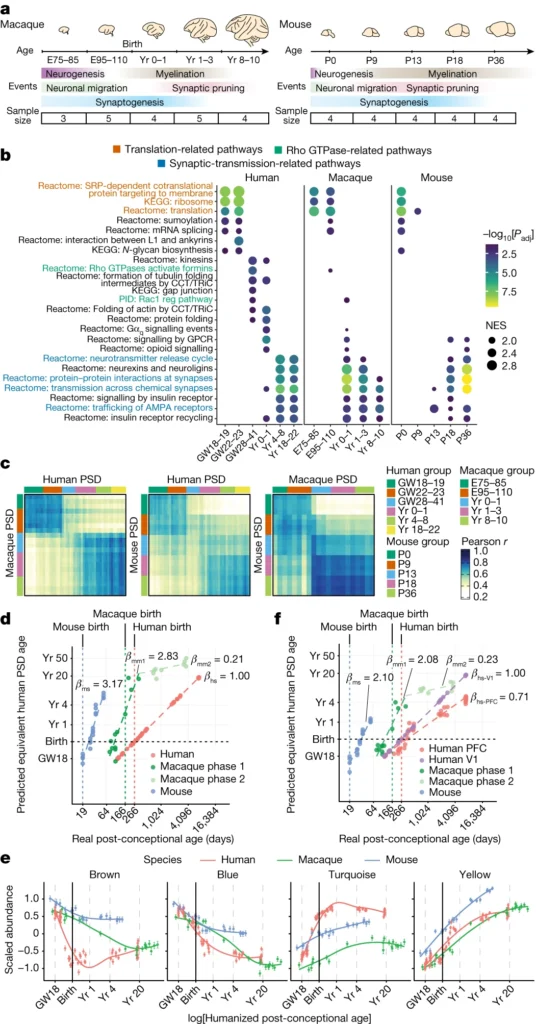
ここでは、大脳新皮質におけるシナプスの発達について、種を超えたプロテオミクスマップを作成した。このマップは、1,000以上のPSDタンパク質の動態と、シナプスの成熟を支配する分子経路を明らかにする。ヒトのPSDの成熟とマカクやマウスのPSDの成熟を比較したところ、ヒトのPSDの成熟は2〜3倍遅いことが明らかになった。この新生児期の特徴は、周産期にヒトのPSDにRhoGEFが多く存在することに起因している可能性がある。これらのデータをトランスクリプトームや遺伝子のデータと統合することで、シナプス成熟期の遺伝子制御ネットワーク、細胞タイプ特異性、疾患脆弱性を明らかにすることができる。我々のデータは、大脳新皮質におけるシナプス発達の時間的マップを提供し、ヒトにおけるシナプス新生の進化的メカニズムについての洞察を与えてくれる。
Discussion
本研究では、シナプス発生の種を超えたプロテオミクスマップを作成し、1,000以上のPSDタンパク質の時間的動態を明らかにした。その結果、ヒトのPSDは3つの主要な成熟段階を経ており、4つのタンパク質モジュールが段階特異的、細胞型特異的、種特異的な機能を発揮していることが明らかになった。さらに、ヒトのPSDは他の生物種に比べて2~3倍ゆっくりと成熟することがわかった。これはおそらく、ターコイズモジュールにRhoGEFタンパク質が多く存在するためであろう。ターコイズモジュールはまた、シナプス可塑性、ヒトの認知機能、精神障害にも関連している。これらのデータを組み合わせることで、ヒトにおけるシナプス成熟の分子的・進化的メカニズムを研究するための青写真が得られる。
シナプスの発達はRNAとタンパク質の両レベルで制御されている。異なるPSDモジュールがそれぞれ異なるRNAとタンパク質の一致を示すことから、モジュールに特異的な転写後制御や翻訳制御が行われていることが示唆された。RNAとタンパク質の一致率が高いモジュールに注目し、単一細胞のRNA配列決定データから神経細胞サブタイプに特異的なPSDシグネチャーを推定した。その結果、大脳新皮質における興奮性ニューロンと抑制性ニューロンのサブタイプ間で、PSDに大きな違いがあることが明らかになった。これは、PSDの構成がニューロンのサブタイプ間で多様であることを示した先行研究と一致している。さらに、抑制性ニューロンでは、RhoGAPをコードする遺伝子を含むブルーモジュール遺伝子のレベルが高く、興奮性ニューロンと抑制性ニューロンで観察されるスパイン密度の違いに寄与している可能性がある。この推測の限界の一つは、単一細胞のRNA配列決定には樹状突起のRNAが含まれないことである。今後、神経細胞のサブタイプに特異的なPSDのプロテオミクス的プロファイルを明らかにする研究が進めば、このような知見がさらに広がるだろう。
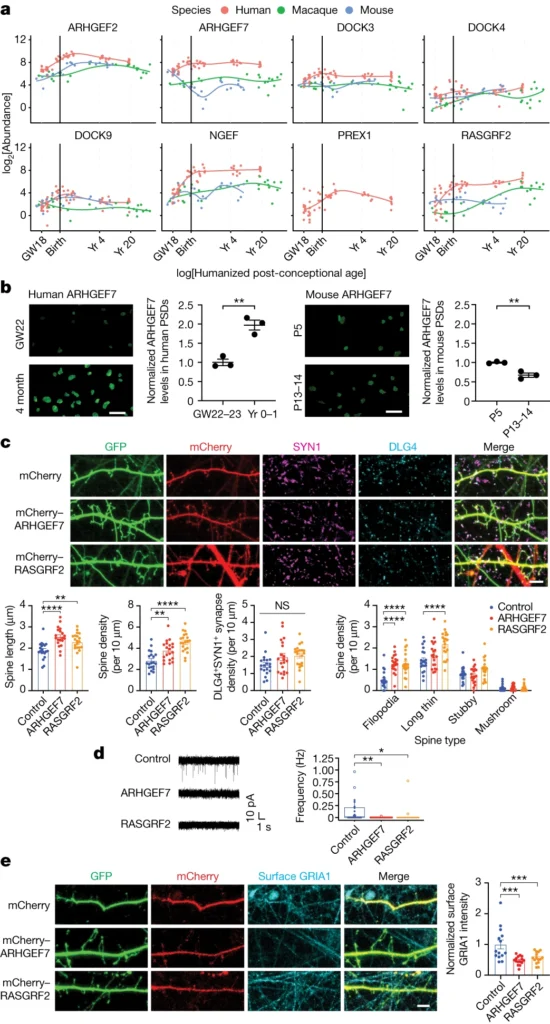
以前の研究では、シナプス成熟のヒト特異的遅延とシナプス密度の増加において、RhoGAPタンパク質であるSRGAP2が重要な役割を果たしていることが明らかにされている。祖先タンパク質であるSRGAP2AのRac1-GAP活性が、新皮質ニューロンのスパインネックの長さと密度を制限することが示されている。ヒトに特異的なSRGAP2の部分重複はSRGAP2Aの機能を阻害し、その結果、ヒトではスパインネックが長くなり、スパイン密度が高くなった。ヒトのPSDではRhoGEFタンパク質が増加しており、神経細胞でRhoGEFを過剰発現させるとスパイン密度が増加し、シナプスの成熟が遅れることがわかった。RhoGAPタンパク質とRhoGEFタンパク質の拮抗的な役割を考えると、今回の結果はこれまでの知見と一致し、シナプスRho GTPase活性の増加がヒトのシナプスの新生に寄与していることを示唆している。さらに、RhoGEFタンパク質はヒトの認知機能に関連するターコイズモジュールに濃縮されている。このように、我々の解析は、シナプスのネオテニーとヒトの認知機能の進化を結びつける分子的証拠を提供するものである。
この研究にはいくつかの限界がある。細胞内分画によるPSDの分離には、コンタミした分子が含まれる可能性がある。そのため、この影響を最小限にするため、厳密なデータフィルタリングを行った。さらに独立した検証を行うことで、新たなPSD構成要素を確認することができるだろう。さらに、アイソフォームとalternative splicingはシナプスの発達に役割を果たしているが、我々の解析では技術的な制約からアイソフォームの定量は行わなかった。さらに、PSDは不均一であり、おそらく個々のシナプスで異なるが、我々のデータは組織レベルで平均化されたプロファイルを表している。最後に、ターコイズモジュールにおける活動依存性タンパク質の濃縮は、ヒトではなくラットのニューロンの実験データに基づいている。新たな手法の開発により、今後、さまざまな脳領域、細胞種、生物種にわたって、シナプスプロテオームの発達的変化と活動依存的変化をアイソフォームレベルで決定する研究が進めば、脳の発達、進化、疾患のメカニズムについて、さらなる洞察が得られるだろう。
