Nature volume 609, pages622–629 (2022)
Organizing structural principles of the IL-17 ligand–receptor axis (構造生物学:IL-17リガンド–受容体軸の構造原理の構築)
Steven C. Wilson, Nathanael A. Caveney, Michelle Yen, Christoph Pollmann, Xinyu Xiang, Kevin M. Jude, Maximillian Hafer, Naotaka Tsutsumi, Jacob Piehler & K. Christopher Garcia
- Department of Molecular and Cellular Physiology, Stanford University School of Medicine, Stanford, CA, USA
- Department of Structural Biology, Stanford University School of Medicine, Stanford, CA, USA
- Howard Hughes Medical Institute, Stanford University School of Medicine, Stanford, CA, USA
Abstract
The IL-17 family of cytokines and receptors have central roles in host defence against infection and development of inflammatory diseases1. The compositions and structures of functional IL-17 family ligand–receptor signalling assemblies remain unclear. IL-17E (also known as IL-25) is a key regulator of type 2 immune responses and driver of inflammatory diseases, such as allergic asthma, and requires both IL-17 receptor A (IL-17RA) and IL-17RB to elicit functional responses2. Here we studied IL-25–IL-17RB binary and IL-25–IL-17RB–IL-17RA ternary complexes using a combination of cryo-electron microscopy, single-molecule imaging and cell-based signalling approaches. The IL-25–IL-17RB–IL-17RA ternary signalling assembly is a C2-symmetric complex in which the IL-25–IL-17RB homodimer is flanked by two ‘wing-like’ IL-17RA co-receptors through a ‘tip-to-tip’ geometry that is the key receptor–receptor interaction required for initiation of signal transduction. IL-25 interacts solely with IL-17RB to allosterically promote the formation of the IL-17RB–IL-17RA tip-to-tip interface. The resulting large separation between the receptors at the membrane-proximal level may reflect proximity constraints imposed by the intracellular domains for signalling. Cryo-electron microscopy structures of IL-17A–IL-17RA and IL-17A–IL-17RA–IL-17RC complexes reveal that this tip-to-tip architecture is a key organizing principle of the IL-17 receptor family. Furthermore, these studies reveal dual actions for IL-17RA sharing among IL-17 cytokine complexes, by either directly engaging IL-17 cytokines or alternatively functioning as a co-receptor.
インターロイキン(IL)17ファミリーのサイトカインと受容体は、感染に対する宿主防御や炎症性疾患の発症に中心的な役割を担っている。IL-17ファミリーのリガンド–受容体の機能的なシグナル伝達集合体の組成や構造は明らかになっていない。IL-17E(別名IL-25)は、2型免疫応答の重要な調節因子、およびアレルギー性喘息などの炎症性疾患の駆動因子であり、機能的応答を引き起こすにはIL-17受容体A(IL-17RA)とIL-17RBの両方を必要とする。今回我々は、クライオ電子顕微鏡法、単一分子画像化法、細胞ベースのシグナル伝達手法の組み合わせを用いて、IL-25–IL-17RB二重複合体およびIL-25–IL-17RB–IL-17RA三重複合体について調べた。IL-25–IL-17RB–IL-17RA三重シグナル伝達集合体はC2対称の複合体であり、この中でIL-25–IL-17RBホモ二量体は「翼のような」2つのIL-17RA共受容体によって「先端と先端が向き合う」形で挟まれていて、これがシグナル伝達の開始に必要とされる重要な受容体間相互作用である。IL-25はIL-17RBとのみ相互作用して、IL-17RB–IL-17RAの先端と先端が向き合う界面の形成をアロステリックに促進する。結果として生じる膜近傍レベルでの受容体間の大きな分離は、シグナル伝達のために細胞内ドメインが接近するのを制限していることを反映する可能性がある。IL-17A–IL-17RA複合体とIL-17A–IL-17RA–IL-17RC複合体のクライオ電子顕微鏡構造から、この先端と先端が向き合う構造が、IL-17受容体ファミリーの重要な構造化原理であることが明らかになった。さらに、これらの研究は、IL-17サイトカイン複合体間で共通するIL-17RAには2つの作用があり、IL-17サイトカインと直接結合する、あるいは共受容体として別の機能を持つことを明らかにしている。(Nature Japan)
Introduction
IL-17ファミリーのサイトカインは、免疫系において多くの調節機能を発揮し、非常に強力な炎症性メディエーターである。IL-17サイトカインは、一方ではバリア組織の恒常性維持に必須であるが、他方では様々な自己免疫疾患のドライバーとして作用する。IL-17が誘導するシグナル伝達カスケードの活性化は、炎症部位でのケモカインの誘導につながる。シスチン結び目サイトカインのIL-17ファミリーは6つのメンバーからなる: IL-17A-Fは、IL-17RA-Eの5つのレセプターに異なる結合特異性を示す。最もよく研究されているIL-17サイトカインであるIL-17AとIL-17Fは、Tヘルパー17(TH17)細胞によって産生され、炎症に伴って上昇する。そのため、IL-17AとIL-17AとIL-17Fの受容体であるIL-17RAの活性を阻害するモノクローナル抗体は、尋常性乾癬やその他の自己免疫疾患に対して米国FDAの承認薬となっている8。もう一つのファミリーメンバーであるIL-25は、2型免疫の重要な調節因子であり、アレルギー性喘息やアトピー性皮膚炎を含むTH2駆動性疾患の重要な治療標的である。
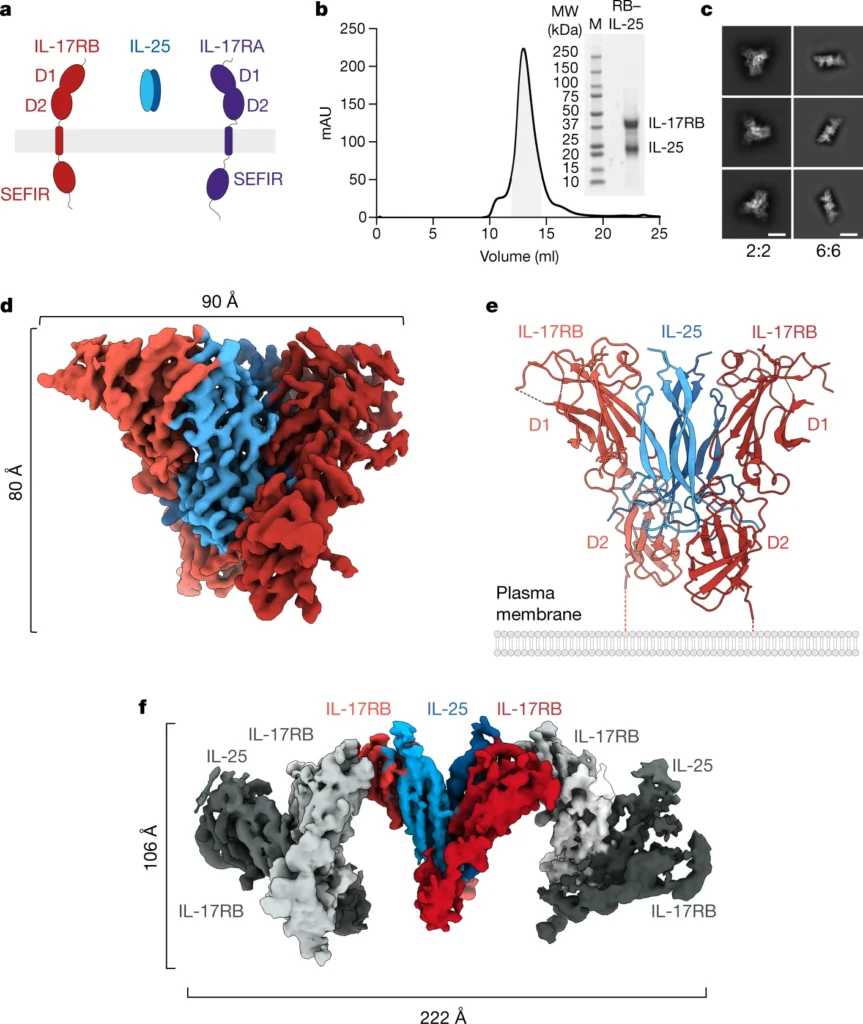
われわれは、低温電子顕微鏡(cryo-electron microscopy: cryo-EM)、単一分子イメージング、細胞ベースの構造機能シグナリング実験という相補的アプローチを用いて、完全なヘテロ二量体IL-17-IL-17Rシグナル伝達複合体の組成と構造を解明した。IL-25-IL-17RB非シグナル伝達複合体およびIL-25-IL-17RB-IL-17RAシグナル伝達複合体の低温電子顕微鏡構造では、IL-25はIL-17RBおよびIL-17RAと予想されるヘテロ二量体複合体を形成しない。その代わりに、IL-25はIL-17RBとホモ二量体複合体を形成し、IL-17RBはIL-17RAとヘテロ二量体2:2:2三量体複合体を形成し、レセプターはその膜遠位先端を介して相互作用する。これらの構造を用いて、IL-25がIL-25シグナル伝達に必要なIL-25-IL-17RB-IL-17RA三元複合体の形成をアロステリックに誘導することを示すために、構造誘導機能研究を行った。さらに、この特異な構造の一般性を明らかにするために、さらにIL-17-IL-17R複合体の低温電子顕微鏡研究を行い、先端から先端へのレセプター-レセプター会合様式が他のIL-17-IL-17Rにも及ぶことを見出した。このように、IL-17RAは、IL-17リガンドに対する直接受容体として、あるいは共受容体として働くことによって、膜におけるIL-17ファミリーのシグナル伝達を仲介する組織化ハブの役割を果たしている
Discussion
この研究は、IL-17ファミリーのレセプター生物学にさらなる洞察を与えるいくつかの結論を与えている。第一に、IL-17RAは、IL-25複合体においてサイトカインに関与しない共受容体として、あるいはIL-17AやIL-17F複合体において見られたような、サイトカインに直接関与する受容体として、より古典的な役割を果たすという非常に珍しい能力を持っている。第二に、我々の結果は、IL-17RAがIL-17ファミリーの中心的なシグナル伝達ハブであり、ほとんどの既知のIL-17ファミリーメンバーによるシグナル伝達に必要であるという考え方をさらに支持するものである。共有シグナル伝達レセプターの使用は、JAK-STATサイトカインの特徴でもあり、例えば、共通ガンマ鎖はIL-17RAと類似の役割を果たしている。しかし、リガンド特異的受容体サブユニットとヘテロ二量体として対をなす共通γ鎖とは対照的に、IL-17RAはサイトカインと直接結合してシグナルを伝達するか、あるいは共受容体として作用する。
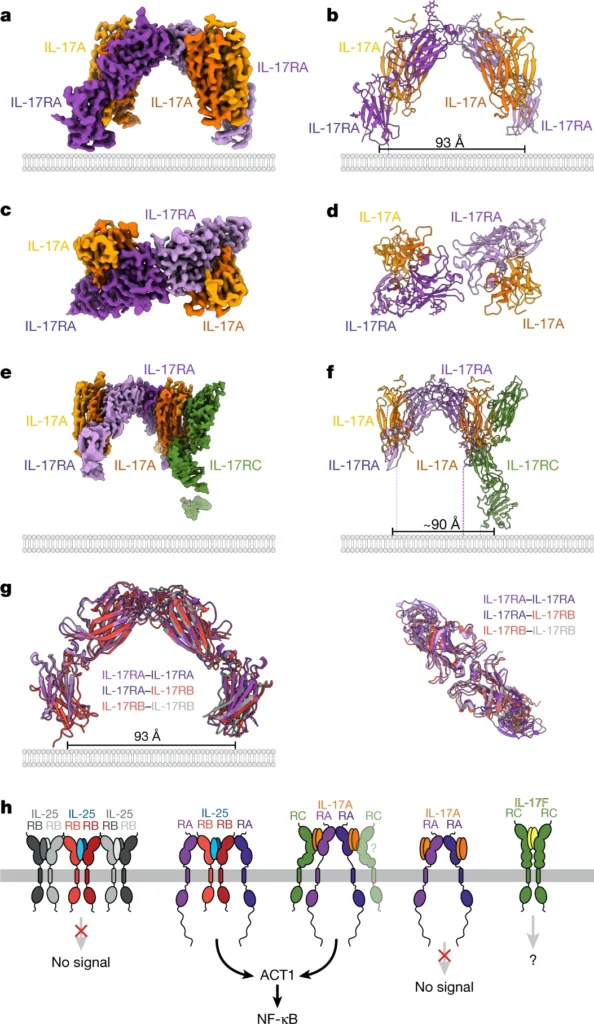
われわれの研究から得られた第三の発見は、先端から先端への二量体集合は、おそらくIL-17ファミリーのメンバーがシグナル伝達複合体に集まる際の構造的組織化原理を表しているということである。IL-17RA-IL-17RA二量体の低温電子顕微鏡構造(図5a-d)と、IL-17RCがIL-17Aの1コピーに結合したIL-17RA-IL-17RA二量体の先端から先端までの構造(図5e,f)には、先端から先端までのレセプター構造が存在した。これらのIL-17Aを含む構造の先端から先端までの界面は、配列したIL-25-IL-17RBとIL-25-IL-17RB-IL-17RAの三元構造に重ね合わせることができる(図5g)。また、IL-17RA-IL-17F24、IL-17RA-IL-17A26およびIL-17RA-IL-17A/F25複合体の結晶構造の電子密度マップを調査したところ、すべての結晶でIL-17RA-IL-17RAの先端から先端までの界面が見つかった(Extended Data Fig.) IL-25がIL-17RBのIL-17RAへの結合を増強する能力に基づいて、IL-17Aの結合がIL-17RAの膜遠位先端を安定化し、IL-17RA-IL-17RAの二量体化を可能にするという仮説を立てた(Extended Data Fig.) さらに、ホモ二量体IL-17F-IL-17RC複合体23の結晶構造には、IL-17RCの膜遠位端に負電荷を帯びた9アミノ酸ループが挿入されている可能性があるため、先端から先端への界面が存在しない(Extended Data Fig.9)。
シグナル伝達能を持つIL-17-IL-17Rヘテロマー複合体は、IL-17RAの膜貫通ドメインが互いに離れている形状をとるが、シグナル伝達能を持たないと推定されるIL-25-IL-17RBとIL-17F-IL-17RCホモ二量体レセプター複合体は、膜貫通ドメインが接近している(図5h)。われわれの構造におけるリガンドIL-17RAの間隔は、おそらく細胞内アダプター・タンパク質のサイズに対応するために、リガンド結合時にIL-17RAの間隔が広がることを示した以前の知見と一致している31。われわれは、先端から先端までの構造が、ホモ型IL-17R-SEFIR-ACT1相互作用とシグナル伝達に必要なIL-17R細胞内ドメインの最適な配置を提供しているという仮説を立てた(図5h)。先端から先端への構造がIL-17-IL-17R複合体の間隔と形状、およびACT1シグナル伝達にどのような影響を与えるかについては、さらなる研究が必要である。
抗IL-17Aモノクローナル抗体拮抗薬secukinumabとixekizumab、およびほとんどのIL-17ファミリーサイトカインを遮断する抗IL-17RAモノクローナル抗体brodalumabの使用は、重症の尋常性乾癬の治療に成功している。IL-17Rの先端から先端への相互作用の構造的特徴は、例えば喘息や乾癬におけるIL-25の異常なシグナル伝達を阻害するための低分子ターゲティングに適合する。IL-17ファミリーのサイトカインシグナル伝達の構造的・組織的原理は、アンタゴニストとアゴニストの両方の治療薬を開発するためのブループリントを提供する。
構造生物学:IL-17リガンド–受容体複合体の構造とその構築原理
2022年9月15日 Nature 609, 7927
インターロイキン(IL)17ファミリーのサイトカインとその受容体(IL-17R)は、17型ヘルパーT(Th17)細胞が仲介する自己免疫性炎症性疾患の主要なドライバーである。K Garciaたちは今回、IL-25–IL-17RB–IL-17RAとIL-17A–IL-17RC–IL-17RAの両方の複合体のクライオ電子顕微鏡構造について報告している。彼らは、受容体の膜から離れた位置で「先端と先端が向き合っている」という保存された構造を実証しており、この構造化原理がアロステリック機構を介したIL-17受容体ファミリーのシグナル伝達に必要であることを示している。
Th17細胞のエフェクター機能
