Nature Neuroscience (2023) Article Published: 10 August 2023
Modeling idiopathic autism in forebrain organoids reveals an imbalance of excitatory cortical neuron subtypes during early neurogenesis (前脳オルガノイドを用いた孤発性自閉症のモデル化は、神経発生初期における興奮性皮質ニューロンのサブタイプの不均衡を明らかにする)
Alexandre Jourdon, Feinan Wu, Jessica Mariani, Davide Capauto, Scott Norton, Livia Tomasini, Anahita Amiri, Milovan Suvakov, Jeremy D. Schreiner, Yeongjun Jang, Arijit Panda, Cindy Khanh Nguyen, Elise M. Cummings, Gloria Han, Kelly Powell, Anna Szekely, James C. McPartland, Kevin Pelphrey, Katarzyna Chawarska, Pamela Ventola, Alexej Abyzov & Flora M. Vaccarin
- Child Study Center, Yale University School of Medicine, New Haven, CT, USA
- Department of Neuroscience, Yale University School of Medicine, New Haven, CT, USA
- Kavli Institute for Neuroscience, Yale University, New Haven, CT, USA
Abstract
Idiopathic autism spectrum disorder (ASD) is highly heterogeneous, and it remains unclear how convergent biological processes in affected individuals may give rise to symptoms. Here, using cortical organoids and single-cell transcriptomics, we modeled alterations in the forebrain development between boys with idiopathic ASD and their unaffected fathers in 13 families. Transcriptomic changes suggest that ASD pathogenesis in macrocephalic and normocephalic probands involves an opposite disruption of the balance between excitatory neurons of the dorsal cortical plate and other lineages such as early-generated neurons from the putative preplate. The imbalance stemmed from divergent expression of transcription factors driving cell fate during early cortical development. While we did not find genomic variants in probands that explained the observed transcriptomic alterations, a significant overlap between altered transcripts and reported ASD risk genes affected by rare variants suggests a degree of gene convergence between rare forms of ASD and the developmental transcriptome in idiopathic ASD.
孤発性の自閉スペクトラム症(ASD)は非常に異質であり、罹患者の生物学的プロセスがどのように収束して症状を引き起こすのかは不明である。ここでは、皮質オルガノイドと単一細胞トランスクリプトミクスを用いて、13家族の孤発性ASD男児とその非罹患父親との前脳発達における変化をモデル化した。大型の脳をもつ発端者(probands)および正常な脳サイズの発端者におけるASDの発症には、①背側皮質板の興奮性ニューロンと、②プレプレートから初期に生成されるニューロンなどの間のバランスの不均衡が関与していることが、トランスクリプトームの変化から示唆された。この不均衡は、大脳皮質の初期発生における細胞運命を駆動する転写因子の発現の相違に起因している。観察されたトランスクリプトームの変化を説明するようなゲノム変異は発端者には見つからなかったが、変化した転写産物と、まれな変異体によって影響を受けたASDリスク遺伝子との間に有意な重複がみられたことから、ASDの稀なタイプと孤発性ASDにおける発達トランスクリプトームとの間に、ある程度遺伝子が収斂していることが示唆された。
Main
ASDは多遺伝子性であり、その病像は異質であるため、今のところ、予後や治療法の指針となるような収束した病態生理学は現れていない。ASDの危険因子には、複数のまれな遺伝性あるいはde novoの一塩基変異体や構造変異体が含まれる。死後脳のトランスクリプトーム研究、ゲノム変異の全エクソームおよび全ゲノム解析により、ヒト胎児の皮質神経形成時に働く重要なASDリスク遺伝子として、いくつかの転写因子(TF)とクロマチン修飾因子が同定されている。人工多能性幹細胞(iPSC)由来のヒト脳オルガノイドは、これらの発生初期段階をin vitroで再現できるという利点があり、神経細胞の多様性を完全に再現することには限界があるものの、定型および非定型の脳発生における遺伝子発現動態を遡及的に調べることができる唯一のモデルである。
巨頭症は、ASD児の縦断的・横断的研究において、重症度の増加や転帰の悪化と関連している頻度の高い表現型であり、一般的な体格の過成長を伴うこともあれば、伴わないこともある。ASDにおける大頭症は、初期の脳発達の違いに根ざしている可能性が高いため、ASDを研究する際、私たちや他の研究者はこの表現型を考慮してきた。大頭症を伴うASD家族由来の終脳オルガノイドを用いて、我々は以前に、特発性大頭症ASDプロバンドにおける増殖、分化、神経突起伸長、FOXG1発現の増加を報告した。しかし、大頭症を伴うASDと伴わないASDの基礎生物学を直接比較した研究はこれまでなかった。
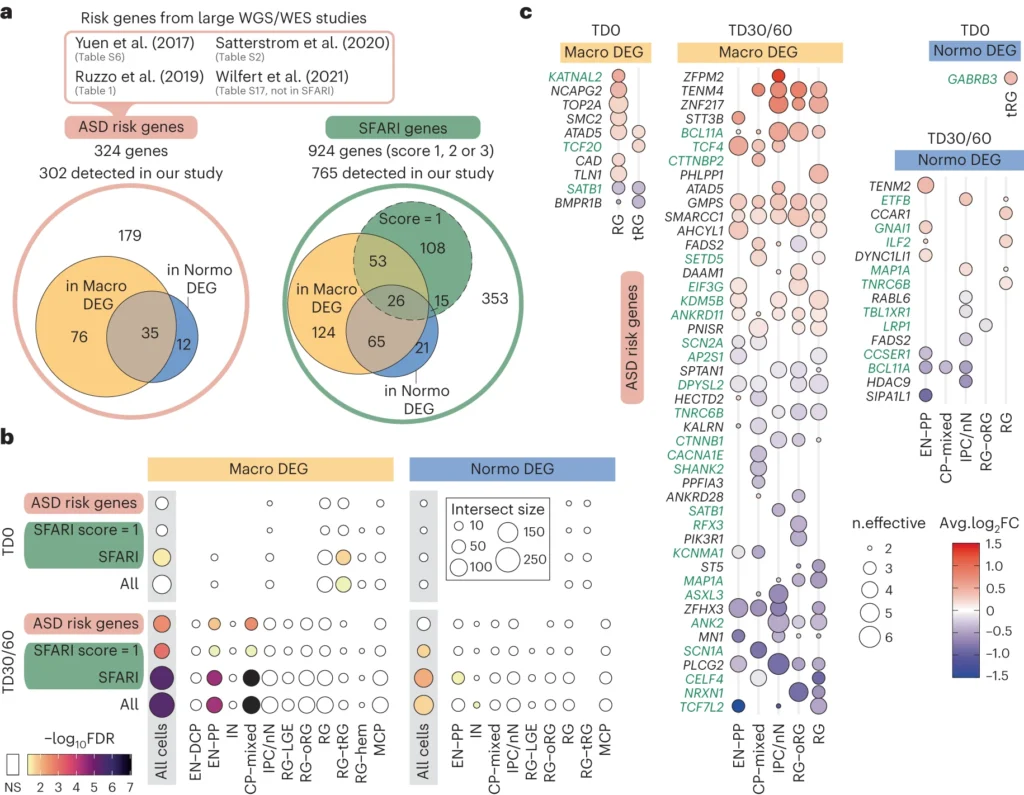
本研究では、大頭症または正常頭症のASD発端者を持つ13家族から前脳オルガノイドの単一細胞トランスクリプトームデータセットを作成し、各細胞タイプにおいてASD男児とその父親との間で差次発現遺伝子(DEG)を比較した。その結果、大頭症のASD男児は、正常頭症のASD男児とは別のメカニズムでASDが発症する可能性があることがわかった。これには、背側皮質板(dorsal cortical plate: DCP)の興奮性ニューロン(EN)と、皮質下板や辺縁帯の前駆体であるpreplateと推定される初期生成ニューロンなどの他の系統との間のバランスの不均衡が関係している。このようなアンバランスは、2つの頭部サイズのASDコホート間で、発達初期における皮質板転写調節因子の調節異常から生じていた。DEG(発現量に差がある遺伝子)のほとんどは、我々のコホートにおけるまれなコード化ゲノム変異では説明できず、発端者におけるトランスクリプトーム変化は、一般的な変異および/または上流のノンコード領域におけるエピゲノム修飾に由来することが示唆された。
Discussion
初期脳発達のオルガノイド・モデルは、ヒトの脳生物学の重要な法則を明らかにし、神経発達障害における変化した分子メカニズムの解明に利用できる。ここでは、発達中のヒト前脳の神経細胞の多様性を再現するために、ガイド付きオルガノイド・アプローチを用いた。putative preplateのexcitatory neurons (EN)(EN-PP)と背側皮質板(DCP)のEN(EN-DCP)の生成について説明し、オルガノイドにおけるこれらの系統分化プログラムの変化が、大頭症の有無にかかわらずASDの病態生理をどのように区別するかを明らかにした。その結果、大脳皮質発達初期における細胞運命を駆動する転写調節因子TFの発現の相違に起因して、大脳皮質ASD患者と正常ASD患者で、EN-PPとEN-DCPのバランスが正反対に崩れていることが観察された。さらに、変化した転写産物と、稀な変異体によって影響を受けたASDリスク遺伝子との間に有意な重複が見られたことから、ASDの稀な型と特発性ASDの発達トランスクリプトームとの間に、ある程度遺伝子が収斂していることが示唆された。
ASDはすべての神経精神疾患の中で最も遺伝性の高い疾患の一つであることが知られているが、30,000人以上を対象としたこれまでで最大のゲノムワイド関連研究では、ASDに関連する遺伝子座はわずかであった。異質な遺伝的背景による未知の影響を軽減するため、ASD男性患者とその父親をペアファミリーデザインで比較した。ペアを同時に処理することで、オルガノイドの調製と配列決定に特徴的なバッチ効果も最小限に抑えた。
大型の頭部をもつASDコホートと通常サイズの頭部ASDコホートをまとめて調査したところ、いくつかの共通のトランスクリプトームシグネチャーが見つかったが、これらのシグネチャーは、病態生理学的意義が限定的ないくつかの遺伝子に収束した。これは、ASDにおけるメッセンジャーRNAの結合、スプライシング、翻訳を示唆する他のトランスクリプトーム研究と一致している。また、RNAプロセシングは、大規模な全ゲノム配列決定(WGS)研究を通じて同定された、まれな遺伝性ASD遺伝子とも以前から関連していた。この収束点とは別に、ASD発端者の頭囲に基づいてコホートを分けたところ、神経発達における2つの大きく異なる変化が明らかになり、頭囲がASDの2つの異なるサブタイプを定義している可能性が示唆された。
2つの頭部サイズのASDコホートにおける大きな相違点は、興奮性神経新生がどのように阻害されるかにあった。それぞれの対照群と比較して、大頭型ASD症例では、皮質板のEN(EMX1およびFEZF2陽性のEN-DCP)が過剰に産生され、初期preplate(EN-PP)とINの系統は損なわれていた。逆に、正常脳ASDコホートでは、EN-PPが増加し、EN-DCPシグネチャーが減少するという逆のパターンが現れた。2つのASDコホートにおいて、分化の促進や遅延の証拠は認められなかった。しかし、大脳ASDでは、自己再生を促進する遺伝子が発現上昇され、分化を促進する遺伝子が発現低下されていた。これらの観察結果は、正常脳ASD発端者由来の前駆細胞は、より多くのプレプレートのニューロンを生成することを選択し、サイクルを早期に終了するのに対し、大脳ASD発端者由来の前駆細胞は、RGの拡大と皮質板興奮性ニューロンの神経新生に運命選択を偏らせるというモデル(Extended Data Fig.10)を裏付けている。以上のことから、本研究は、大脳皮質形成の初期段階における前駆細胞の細胞運命選択を規定する初期転写プログラムの変化が、ASD患者における神経発達の軌跡の変化の原因であることを示唆している。ASDは以前、リスクのある乳児を対象とした縦断的画像研究において、皮質表面積の増加と関連しており、この表現型は乳児期および就学前のASD重症度と直接関連している13。今回の知見から、ASDにおける皮質表面積の増大と大頭症は、生後1年目に現れるものの、RGの増殖と分化の選択において、より早い時期に調節不全が生じ、胎児期に拡大する可能性があることが示された。
この研究は、特発性ASDの発達をモデル化した研究としては間違いなく最大規模であるが、研究対象者の数(n=26)はまだ限られている。また、より多くの家族を研究に含めるため、同じ個体から採取した姉妹クローンを調査することができず、個体の表現型におけるクローン間の変異を調査することができなかった。しかしながら、われわれのトランスクリプトーム解析結果では、初期化法、生検時の年齢、その他の技術的変異の原因による大きな影響は除外され、先行研究と一致するように、細胞分化プログラムに対する遺伝的背景の影響が、サンプル間の細胞組成と遺伝子発現の差異の最も強いドライバーであることが示された。以上の限界から、脳の大きさと特発性ASDおよびその臨床的重症度を関連付ける神経生物学的メカニズムを確認するため、より大規模なコホートでのさらなる調査が必要である。
オルガノイドやASD患者の死後大脳皮質を用いたASD遺伝子の研究では、ENとINの神経新生における一般的な変化が提唱されている。成人の死後ASD脳のトランスクリプトーム研究で差次的に発現した遺伝子の約半数は、我々の研究でも差次的に発現していた。ひとつ興味深い点は、オルガノイドにおいて皮質領域特異的な転写産物が全般的に減少していることである(Extended Data Fig. しかし、発達初期と成人期では細胞の状況が大きく異なり、また成人の死後データでは頭囲も評価する必要があるため、適切な比較のためにはさらなるメタアナリシスが必要である。
最近のゲノム研究やSFARIデータベースから得られたリスク遺伝子は、大頭症ASDのDEGsの中で濃縮されており、特に初期の神経細胞で濃縮されていた。しかしながら、われわれはASDコホートにおいて、症候性ASD遺伝子を含む劇症型コード変異を同定したが、ASDプロバンドのコホートにおいて観察されたトランスクリプトーム変化を、コード変異のみが牽引している可能性は除外した。したがって、ASDオルガノイドにおける遺伝子発現の差は、ほとんどが複数の共通および/またはノンコーディングバリアントの変化とその下流の結果によって引き起こされているという仮説を立て、ASDの表現型に関連する原因バリアントを同定するために、神経発達初期におけるゲノム制御を解読することの重要性を強調した。われわれのオルガノイドモデルは、そのようなバリアントを同定し、特発性ASDと症候性ASDの両方の発達神経生物学的メカニズムに関連付けるためのプラットフォームとなると信じている。今後、特発性ASDと症候性ASDの大規模コホートにおいて、表現型観察とオルガノイドにおける分子変化、ゲノム解析、出生後の神経画像、臨床的表現型データを組み合わせた研究を行うことは、オルガノイド研究で観察された神経発達調節カスケードのスペクトルが、どのようにして小児の自閉症のスペクトルを作り出しているのかを明らかにする上で極めて重要である。
Mini-Brains’ Reveal Autism’s Neuronal Imbalance Origins
