Nature Neuroscience (2023) Published:
Gradients of neurotransmitter receptor expression in the macaque cortex (マカク大脳皮質における神経伝達物質受容体発現の勾配)
Sean Froudist-Walsh, Ting Xu, Meiqi Niu, Lucija Rapan, Ling Zhao, Daniel S. Margulies, Karl Zilles, Xiao-Jing Wang & Nicola Palomero-Gallagher
- Institute of Neuroscience and Medicine (INM-1), Research Centre Jülich, Jülich, Germany
- Cécile and Oskar Vogt Institute for Brain Research, Medical Faculty, University Hospital Düsseldorf, Heinrich Heine University Düsseldorf, Düsseldorf, Germany
Abstract
Dynamics and functions of neural circuits depend on interactions mediated by receptors. Therefore, a comprehensive map of receptor organization across cortical regions is needed. In this study, we used in vitro receptor autoradiography to measure the density of 14 neurotransmitter receptor types in 109 areas of macaque cortex. We integrated the receptor data with anatomical, genetic and functional connectivity data into a common cortical space. We uncovered a principal gradient of receptor expression per neuron. This aligns with the cortical hierarchy from sensory cortex to higher cognitive areas. A second gradient, driven by serotonin 5-HT1A receptors, peaks in the anterior cingulate, default mode and salience networks. We found a similar pattern of 5-HT1A expression in the human brain. Thus, the macaque may be a promising translational model of serotonergic processing and disorders. The receptor gradients may enable rapid, reliable information processing in sensory cortical areas and slow, flexible integration in higher cognitive areas.
神経回路のダイナミクスと機能は受容体を介した相互作用に依存している。したがって、皮質領域にわたる受容体組織の包括的なマップが必要である。本研究では、in vitro受容体オートラジオグラフィーを用いて、マカク大脳皮質の109領域における14種類の神経伝達物質受容体の密度を測定した。この受容体データを、解剖学的、遺伝学的、機能的結合データと統合し、共通の皮質空間を構築した。その結果、神経細胞あたりの受容体発現の主な勾配が明らかになった。これは感覚皮質から高次認知領域までの皮質階層と一致している。セロトニン5-HT1A受容体によって駆動される第二の勾配は、前帯状回、デフォルトモード、サリエンス(salience)ネットワークにピークがある。ヒトの脳でも同様の5-HT1A発現パターンが見られた。従って、マカクはセロトニン作動性プロセッシングと障害の有望なトランスレーショナルモデルとなりうる。受容体勾配は、感覚皮質領域では迅速で確実な情報処理を可能にし、高次認知領域ではゆっくりとした柔軟な統合を可能にするのかもしれない。
Main
神経科学における重要な課題は、比較的静的な脳の解剖学的構造が、いかにして変化する世界に適応できるかを見出すことである。脳の結合性(Connection)はその重要な要素である。種を超えた脳の結合性(コネクトーム)を網羅的にマッピングすることは、現在進行中の大きな進歩である。しかし、神経結合だけでは、脳機能の根底にある神経回路のダイナミクスを説明するには不十分である。シナプス結合の機能的影響は受容体に依存する。したがって、受容体の種類を無視した結合性のアプローチは、大脳皮質の計算能力を理解するのに十分ではないかもしれない。現在進行中のコネクトームのマッピングを補完するためには、大脳皮質全体の受容体密度の系統的なマップが必要である。これは、大脳皮質の分子組織とシステム組織との間に重要なつながりをもたらすだろう。
大脳皮質は、マカクとヒトで非常によく似た領域と層状の受容体プロファイルを示す。神経解剖学者は、マカク皮質全体のメゾスコピックおよびミクロスコピックな解剖学的詳細を定量的にマッピングしている。これは現在、ヒトの解剖学的知識を凌駕している。対照的に、マカクにおけるin vivo神経画像はヒトよりも進んでいない。それにもかかわらず、マカク神経イメージングの最近の発展は、種間比較や翻訳を加速させる可能性がある。しかし、in vitro神経解剖学とin vivo神経イメージングを統合した研究はまだほとんどない。特に、受容体のデータは通常切片上で表示され、オープンに利用できることはほとんどない。大脳皮質全体の受容体発現マップを作成し、神経画像データと統合することで、神経科学の種やレベルを超えた翻訳をスピードアップできる可能性がある。
微小回路のレベルでは、大脳皮質のさまざまな領域が共通の組織を共有している。しかしその特性は、巨視的な勾配という形で、大脳皮質全体で異なっている。結合性の勾配は、大脳皮質の組織構造を示すために用いられてきた。脳の大規模な神経伝達物質と受容体の組織についても、同様の理解が生まれつつある。マウスの脳では、皮質下の神経調節中枢が「コネクターハブ」となっている。ヒトの脳における受容体の発現は、生体内の結合パターンや機能的活動パターンと関連している。しかし、受容体の発現が、マカク大脳皮質で測定できる解剖学的組織とどのように関連しているかは、まだわかっていない。
本研究では、マカク大脳皮質の109領域にわたって14種類の神経伝達物質受容体の密度を測定した。これらのデータと複数のタイプの解剖学的・機能的データを共通の皮質空間上にマッピングした。これらのデータには、ニューロン密度、樹状突起のサイズ、スパイン、トラクトレース連結性、遺伝子発現、構造的・機能的磁気共鳴画像法(MRI)などが含まれる。我々は、マカク皮質の受容体構造は、少数の勾配によってよく記述できることを発見した。主要な受容体勾配は、推定上の皮質階層を定義している。勾配の高い皮質領域は、ニューロンあたりのレセプター密度が高く、樹状突起が大きく、ミエリンが少ない。受容体勾配は機能的ネットワークも分離していた。このことは、皮質階層に沿って、また高次の認知ネットワーク間で活動を伝播する神経調節因子の潜在的役割を示唆している。

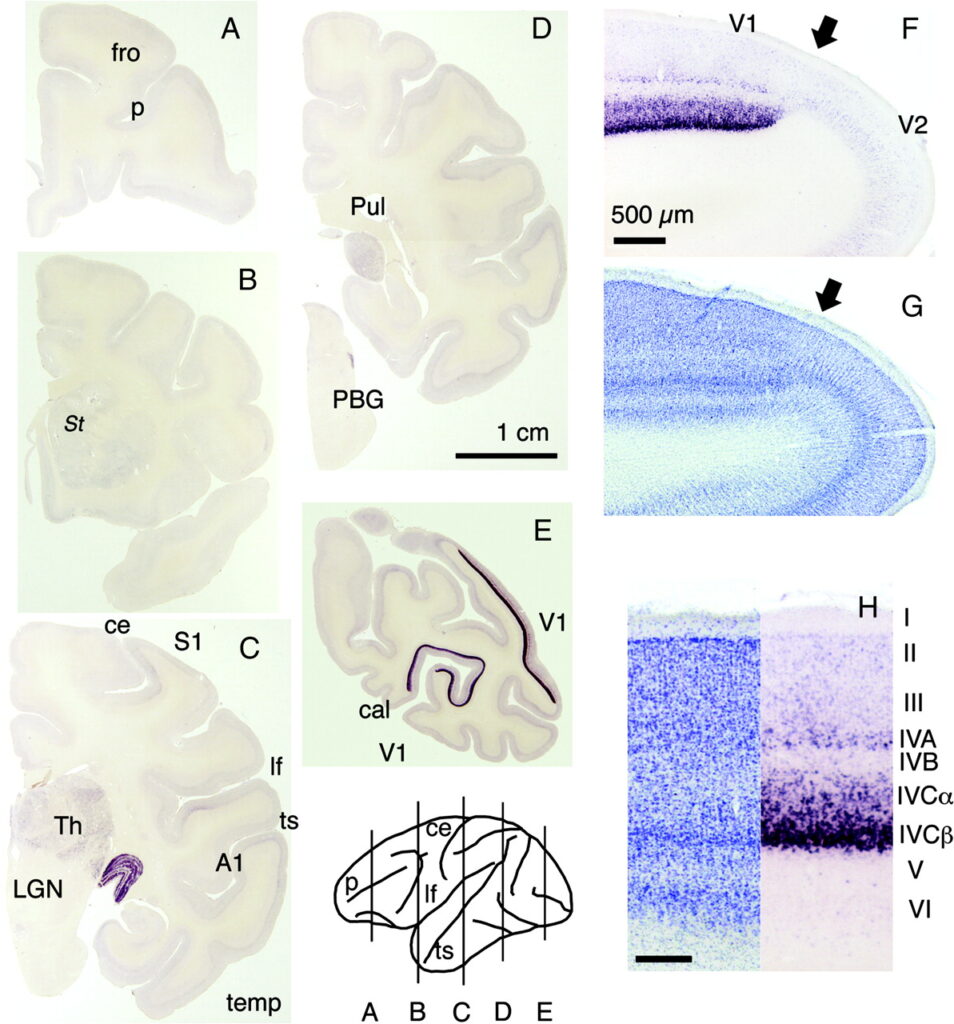
Discussion
本研究では、マカク皮質全体の受容体発現を測定し、一般的な組織原理を明らかにした。我々は、皮質階層に沿って受容体発現が増加する主要な勾配を発見した。この受容体勾配は、感覚ネットワークと認知ネットワークを分けている。錐体細胞の樹状突起の大きさは、この勾配に沿って受容体発現が増加するにつれて大きくなることを示した。対照的に、ミエリンと受容体の発現は、脳領域や脳層を超えて反相関している。第二の受容体勾配は、セロトニン5-HT1A受容体によって駆動される。我々は、大脳皮質全体における5-HT1A受容体の発現は、マカクとヒトの間で非常に類似していることを示した。第二の受容体勾配は、背側注意をデフォルト・モード・ネットワークとサリジェンス・ネットワークから分離している。第二の受容体勾配はまた、社会情動と数-空間機能からの活動を分離している。このことは、外的注意と内的注意の切り替えにセロトニン作動性の基盤がある可能性を示唆しており、研究モデルとしてのマカクザルの妥当性を強調している。
主受容体の勾配は、大脳皮質全体に機能的多様性を出現させるのに役立つかもしれない。1950年代から1960年代にかけて、SanidesとBraitenbergは、大脳皮質は勾配で組織化されていると主張した。最近では、神経結合性、細胞種、受容体、遺伝子発現の勾配が見つかっている。これらの特性の多くは、大脳皮質の階層に沿った軸に沿って変化している。謎なのは、解剖学的勾配がどのようにして大脳皮質全体で異なる機能の出現につながるのかということである。我々は古典的な神経伝達物質に対する受容体の代表的なサブセットを分析することにした。ヒトの脳では、これらの受容体の分布は皮質のタイプと機能システムを分離している。我々はマカク皮質において、階層に沿って増加する主要な受容体勾配を発見した。主要な受容体勾配に沿って、受容体の発現は4倍増加することがわかった。そのため、より多くの情報源からの情報を統合することができる。これは、高次領域のニューロンがより長い時間スケールで情報を統合し、ダイナミックレンジを拡大する解剖学的根拠となる可能性がある。このような大規模で多様な受容体の発現により、高次皮質領域のニューロンは柔軟に行動できるのだろう。対照的に、初期感覚皮質のニューロンは比較的少数の受容体を発現している。このことは、感覚刺激が異なる文脈においても確実に処理されることを保証しているのかもしれない。しかし、樹状突起の特性に関する我々の解析は、第3層錐体細胞の基底樹状突起にのみ焦点が当てられていた。この樹状突起は、持続的な活動を可能にする皮質の反復接続の部位であるため、特に興味深い。この活動は、ワーキングメモリーや意思決定など、多くの機能を支えていると考えられている。将来的には、他の層の錐体細胞や介在ニューロンにも樹状突起の特性の勾配が存在するかどうかを明らかにすることが重要であろう。V1に比べて前頭皮質では樹状突起の長さとスパインの数が増加することが、マカクでは第3層錐体細胞の頂端樹状突起と基底樹状突起で示されているが、マウスでは示されていない。受容体の発現と機能の勾配も、霊長類とげっ歯類で異なる可能性がある。
第二の受容体勾配は、うつ病の異なる治療法間の関連を明らかにする。第二の受容体勾配は、セロトニン5-HT1A受容体の発現が支配的であることがわかった。これは、受容体ポジトロン断層撮影法(PET)と5-HT1A受容体の完全拮抗薬である[11C]6BPWAYを用いたマカクザルのin vivoでのパターンに類似している。この勾配は、ヒトの脳でみられる吻側-尾側勾配と類似している19,51。この勾配が高い領域は、情動研究で活性化された領域と強く重なっている(図8)。この勾配は帯状皮質でピークを示し、顎下帯状皮質で高い発現を示す。これはうつ病治療のための脳深部刺激の主要な標的である。うつ病患者ではセロトニン放出が低下している可能性がある。興味深いことに、脳深部刺激と選択的セロトニン再取り込み阻害薬(SSRI)の脳血流に対する作用はほとんど同じである。SSRIは5-HT1A受容体の活性化を増加させる。SSRIは脳梁下帯状回りの神経活動を低下させる。このことは、うつ病患者においてこの領域でみられるグルコース代謝の亢進を打ち消す。5-HT1A受容体の発現を解析した結果、帯状回皮質下刺激とSSRIは同じ脳内ネットワークを標的としていることが示唆された。
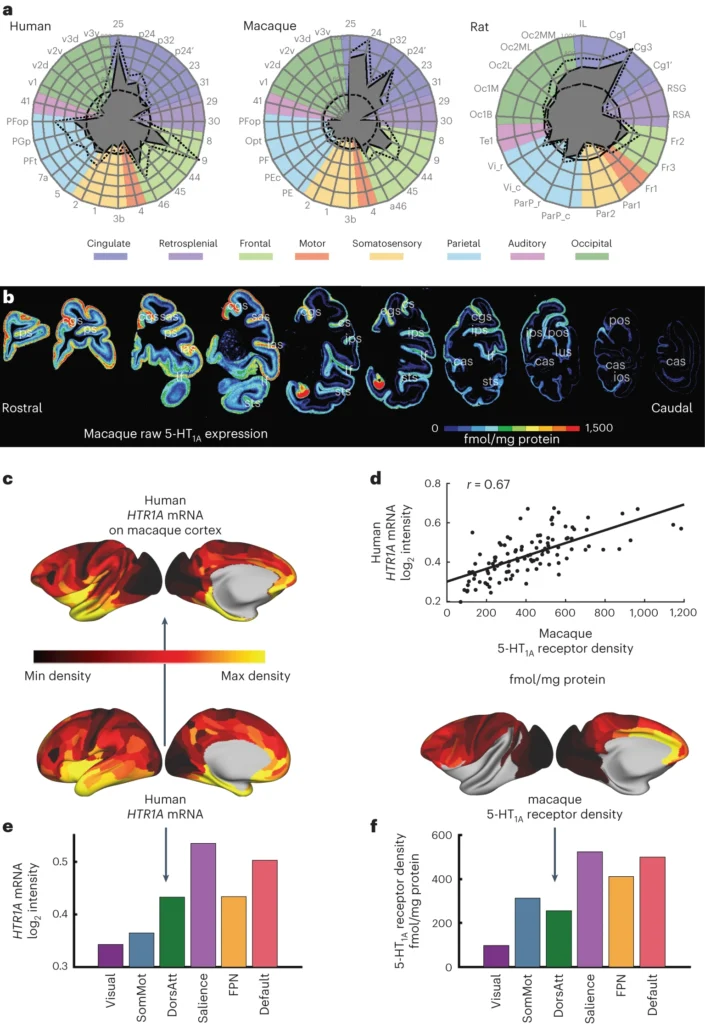
マカクは、セロトニン作動性機能および関連疾患の有望な動物モデルとなりうる。ここで、in vitroオートラジオグラフィーを用いて、マカクの5-HT1A受容体密度がヒトのHTR1A遺伝子発現および受容体発現と非常に類似していることを見いだした(図7および補足図7)。遺伝子発現は必ずしも受容体発現の良い予測因子ではない。しかし、以前の研究(PETを用いた)で、ヒトでは5-HT1A受容体と遺伝子発現は高い相関があることがわかった。ここでは、5-HT1Aはすべての受容体の中で最も高い遺伝子-受容体相関を示した(補足図11)。これは他の著者によるヒト脳における遺伝子-受容体相関の同時期の解析と一致している。ラットでは、5-HT1A受容体の発現も帯状皮質でピークを示した。しかし、その発現勾配はマカクやヒトの脳よりも平坦であった。注目すべきは、ラットでは層状の受容体発現パターンがヒトやサルの皮質で観察されたパターンと異なっていることである。セロトニンや他の神経調節物質に対する受容体も、げっ歯類と霊長類では発現する細胞型が異なる可能性がある。セロトニン受容体の発現が種によって異なることを認識することは、セロトニン作動性機能や障害の動物モデルを解釈する際に重要であろう。
二次受容体勾配は、背側注意ネットワークをデフォルト・モード・ネットワークとサリエンス・ネットワークから分離している。連合皮質は4つのネットワーク(背側注意、サリジェンス、前頭頭頂、デフォルト)に分けられる。これらのネットワークはそれぞれ前頭葉、頭頂葉、側頭葉の一部を占めている。大脳皮質のいくつかのパッチにおいて、これらのネットワークは一貫した順序で現れる17。高次認知ネットワークのうち、背側注意ネットワークは感覚野に最も近い。背側注意ネットワークは、外界の刺激に注意が向けられているときに活性化する。デフォルト・モード・ネットワークは感覚野から最も離れている。デフォルト・モード・ネットワークは、注意が外界に集中していないときに活性化する。これには自伝的記憶や想像力が含まれる。これら2つのネットワークの活動はしばしば反相関関係にあり32,33、認知における相反する役割と一致している。前頭頭頂ネットワーク(多重要求システム、認知制御ネットワーク、中枢実行ネットワークとしても知られる)は、解剖学的にこれら2つのネットワークの中間に位置する。前頭頭頂ネットワークは、課題の要求に応じて、他の2つのネットワークのいずれかと結合することがある61。この役割に沿うように、前頭頂ネットワークは、二次受容体勾配に沿って、背側注意ネットワークとデフォルトモードネットワークの間に位置していることがわかった(図6)。
セロトニンとノルアドレナリンの放出は、脳を内的注意状態から外的注意状態へと移行させる可能性がある。背側注意ネットワークとデフォルト・モード・ネットワーク間の拮抗のメカニズムは不明である。抑制性ニューロンへの長距離投射に起因する可能性がある。ここで我々は、セロトニン放出がデフォルト・モード・ネットワークとサリジェンス・ネットワークの5-HT1A受容体に関与するはずであることを示した。ノルアドレナリンα1受容体も同様に、これらのネットワークでピークを示す。サリエンスネットワークは、脳をデフォルトモードネットワークから前頭頭頂および背側注意ネットワーク優位の活動に切り替えることができる34。意外な刺激などいくつかの刺激は、サリエンスネットワークを活性化し、セロトニンとノルアドレナリンの放出も誘導する。このことは、今回発見された解剖学的結果を支持する、これらのシステム間の機能的関連を示唆している。5-HT1A受容体はセロトニンに対して高い親和性を持つ。このため、通常、皮質のセロトニン処理は5-HT1A受容体が支配的である。対照的に、極端な状況下でセロトニンが大量に放出されると、5-HT2A受容体が関与する。このような状況とは、注意を外界の刺激に急速に向ける必要がある場合である。我々は、5-HT2A受容体の興奮作用が、背側注意ネットワークと前頭頭頂ネットワークを興奮させることによって、5-HT1Aの作用を補完する可能性があることを示している(補足図11)。したがって、セロトニンとノルアドレナリンの放出は、比較的安定した状態の間で活動をシフトさせる可能性がある。このことは、神経調節受容体の遺伝子が、時間の経過とともに脳の状態の流れに影響を与える可能性のある皮質部位で発現しているという最近の知見と一致する。このことは、脳が枢要な認知ネットワーク間で活動をシフトさせる神経調節メカニズムの可能性を示唆している。
V1における高いニューロン密度は、その高い受容体発現の根底にある。最近、ヒトの大脳皮質で受容体の発現勾配が発見された。ヒトの受容体勾配は、マカクの脳の主要な受容体勾配に似ている。サルの大脳皮質を研究する利点は、標準的な侵襲的解剖データと比較できることである。例えば、ニューロン密度の包括的なマップは、現在のところヒトでは入手できない。我々は受容体とニューロン密度のデータを比較した。その結果、V1ではニューロン密度が高いため、いくつかの受容体が高発現していることが明らかになりました。我々が提供した受容体マップは、時間のスナップショットに過ぎない。今後、性別による変化、脳疾患に伴う病理学的変化、経時的変化など、多くの発見が残されている。
本研究は、マカクザルの脳における6つの古典的な神経伝達系からの14の受容体の密度と皮質階層との関係についての洞察を提供するものである。数十年にわたる研究にもかかわらず、現在利用可能なすべてのリガンドが異なる受容体タイプを完全に分離できるわけではないため(例えば、D1受容体とD5受容体;補足表4)、これらの受容体全体において、いくつかの方法論的考察を考慮しなければなりません。興味深いことに、NMDA受容体拮抗薬[3H]MK-801は、開口孔をブロックすることによってヒトのニコチン性アセチルコリン受容体を阻害することがわかりました。ニコチン受容体チャネルが開くにはアセチルコリンが必要であり、結合プロトコルのプレインキュベーションの段階ですべての内因性物質が除去されたため、ここで[3H]MK-801で標識された結合部位にニコチン性コリン作動性受容体が含まれている可能性は極めて低い。ここで分析されたすべての受容体タイプについて、より特異的な放射性リガンドの開発、特徴づけ、分布の定量化を行うには、今後の研究が必要であろう。
最近の大規模記録法の発展により、認知機能の分布的性質が浮き彫りになってきた。しかし、皮質の活動パターンがどのように機能を可能にするかについての理論的理解は、まだ限られている。ここで紹介した受容体データは、結合データ3とともに、脳機能の大規模モデルや理論に解剖学的基礎を提供することができる。将来、脳機能に関する大規模な理論が、主要な受容体勾配に沿ってどのように柔軟な高次認知機能が出現するかを明らかにするかもしれない。
Reference