Science. 2022 Jan 21;375(6578):326-331. doi: 10.1126/science.abf6154. Epub 2022 Jan 20.

Structural and functional insight into regulation of kinesin-1 by microtubule-associated protein MAP7 (微小管結合タンパク質MAP7によるキネシン-1の制御に関する構造的・機能的知見)
Luke S Ferro # 1, Qianglin Fang # 1, Lisa Eshun-Wilson # 1, Jonathan Fernandes # 2, Amanda Jack 3, Daniel P Farrell 4, Mert Golcuk 5, Teun Huijben 6, Katelyn Costa 7, Mert Gur 5, Frank DiMaio 4, Eva Nogales 1 3 8 9, Ahmet Yildiz 1 3 9 10
- 1Department of Molecular and Cell Biology, University of California, Berkeley, CA, USA.
- 2Department of Chemistry, University of California, Berkeley, CA, USA.
- 3Biophysics Graduate Group, University of California, Berkeley, CA, USA.
- 4Department of Biochemistry, University of Washington, Seattle, WA, USA.
- 5Department of Mechanical Engineering, Istanbul Technical University, Istanbul, Turkey.
- 6Department of Imaging Physics, Delft University of Technology, Delft, Netherlands.
- 7Press West Illustrations, Boston, MA, USA.
- 8Howard Hughes Medical Institute, University of California, Berkeley, CA, USA.
- 9Molecular Biophysics and Integrative Bioimaging Division, Lawrence Berkeley National Laboratory, Berkeley, CA, USA.
- 10Physics Department, University of California, Berkeley, CA, USA.
#Contributed equally.
Biphasic regulation of kinesin-1 by MAP7
Motor proteins are differentially regulated by microtubule-associated proteins (MAPs) to deliver intracellular cargos to their destinations. MAP7 recruits the molecular motor kinesin-1 to microtubules and activates subsequent motility, but the underlying mechanism is unclear. Using cryo–electron microscopy, Ferro et al. determined a near-atomic structure of MAP7 on the microtubule. They found that the microtubule-binding site of MAP7 overlaps with kinesin. However, by tethering kinesin-1 to the microtubule, the MAP7 projection domain enabled the motor to diffuse to available sites on microtubules partially decorated by MAP7. These results reveal the mechanistic basis of MAP7-mediated activation of kinesin motility despite their competing binding to tubulin. —SMH
MAP7によるキネシン-1の二相性制御機構
モータータンパク質は、微小管結合タンパク質(MAP)によって制御され、細胞内の荷物を目的地まで運搬することができる。MAP7は分子モーターであるキネシン-1を微小管に引き寄せ、その後の運動を活性化させるが、その基本的なメカニズムは不明である。今回、Ferroらは、微小管上のMAP7のほぼ原子レベルでの構造を、低温電子顕微鏡を用いて決定した。その結果、MAP7の微小管結合部位はキネシンと重なっていることがわかった。しかし、キネシンはMAP7プロジェクションドメインによって微小管に固定されることで、MAP7で部分的に装飾された微小管上の利用可能な部位に拡散することが可能になった。これらの結果は、チューブリンとの結合が競合しているにもかかわらず、MAP7がキネシンの運動を活性化する仕組みの根幹を明らかにするものである。
Abstract
Microtubule (MT)–associated protein 7 (MAP7) is a required cofactor for kinesin-1–driven transport of intracellular cargoes. Using cryo–electron microscopy and single–molecule imaging, we investigated how MAP7 binds MTs and facilitates kinesin-1 motility. The MT-binding domain (MTBD) of MAP7 bound MTs as an extended α helix between the protofilament ridge and the site of lateral contact. Unexpectedly, the MTBD partially overlapped with the binding site of kinesin-1 and inhibited its motility. However, by tethering kinesin-1 to the MT, the projection domain of MAP7 prevented dissociation of the motor and facilitated its binding to available neighboring sites. The inhibitory effect of the MTBD dominated as MTs became saturated with MAP7. Our results reveal biphasic regulation of kinesin-1 by MAP7 in the context of their competitive binding to MTs.
微小管結合タンパク質7(MAP7)は、キネシン1による細胞内物質輸送に必要な補因子である。我々は、MAP7が微小管に結合し、キネシン1の運動を促進する仕組みを低温電子顕微鏡と単一分子イメージングを用いて研究した。MAP7 の MT 結合ドメイン(MTBD)は、プロトフィラメントリッジと横方向の接触部位の間で拡張した α ヘリックスとして MT に結合していた。予想に反して、MTBDはキネシン-1の結合部位と一部重なり、キネシン-1の運動を阻害していた。しかし、MAP7のプロジェクションドメイン(突起部位)は、キネシン-1をMTBDにつなぎとめることで、モーターの解離を防ぎ、隣接する利用可能な部位への結合を促進させることがわかった。MTBDの抑制効果は、MTがMAP7で飽和するにつれて優勢になった。この結果は、MAP7によるキネシン-1の制御が、MTへの競合的な結合という文脈の中で二相的に行われていることを明らかにするものである。
微小管結合タンパク
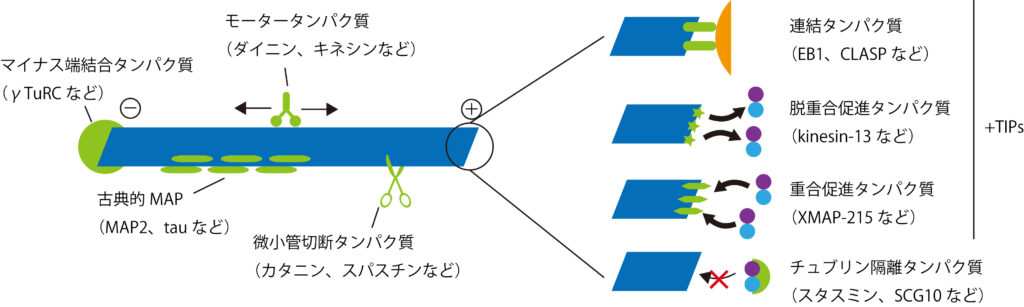
古典的MAP(Microtubule Associating Protein)もしくは構造的MAPに属するタウやMAP2は微小管を安定化させることにより動態を変化させる[9][10]。なおMAP1A/Bの軽鎖サブユニットLC3はオートファゴソーム膜に局在する(オートファジーの項目参照)。
微小管のプラス端に結合するものは+TIPsと総称される[11]。+TIPsには、重合を促進するもの(例:XMAP215)、重合を阻害するもの(例:CLASP)、脱重合を促進するもの(例:キネシン-13)、膜や細胞骨格など他の構造と微小管との連結をするもの(例:EB1)等がある。
マイナス端に結合するタンパク質には、γ-チュブリンの他にnineinやNezha/Patroninなどがあり、脱重合を防いだり重合開始点を特定の部位に局在化したりしている[12][13]。https://bsd.neuroinf.jp/wiki/%E5%BE%AE%E5%B0%8F%E7%AE%A1 (脳科学辞典)
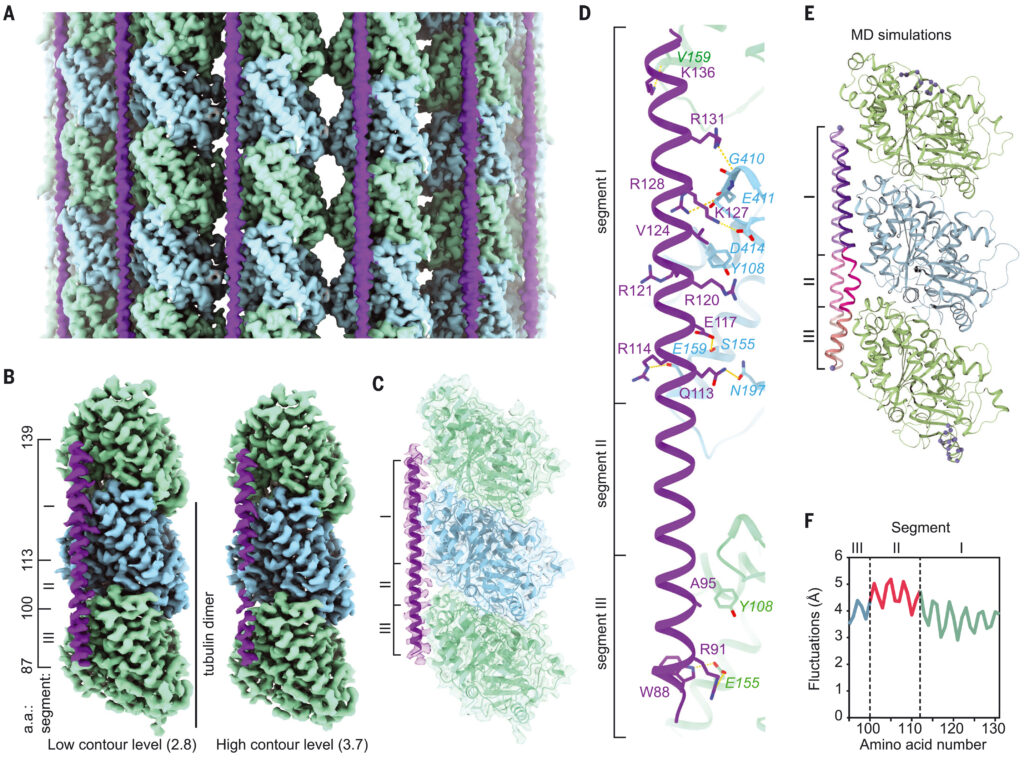
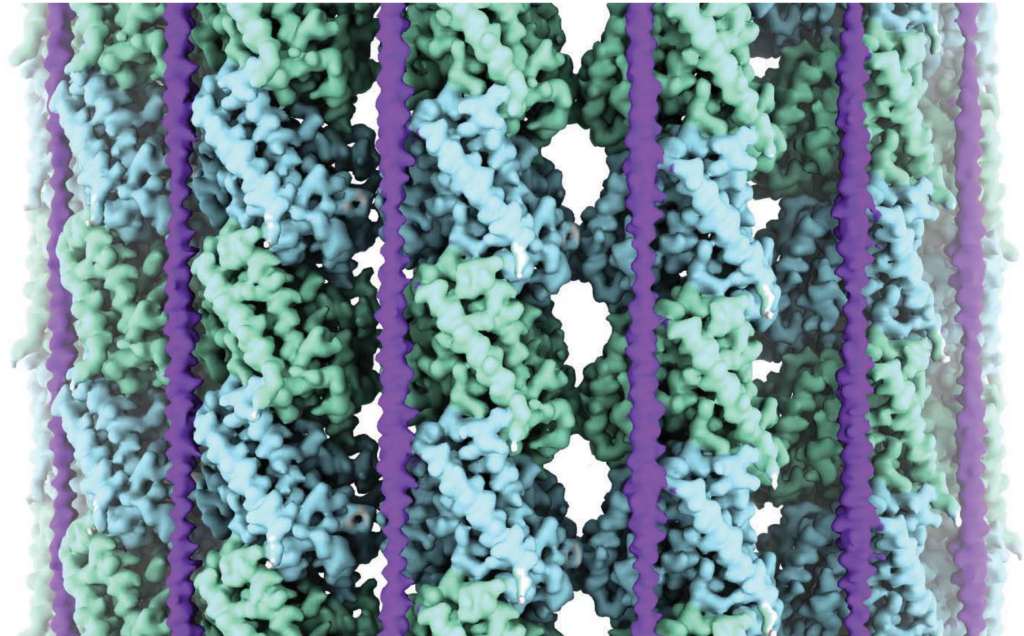
(A) Cryo-EM map (without symmetry expansion) of an MT decorated with MAP7; α-tubulin, β-tubulin, and MAP7 are shown in green, blue, and purple, respectively. (B) Improved MAP7-MT cryo-EM map after symmetry expansion and protofilament-based density subtraction (see methods). MAP7 binds across both inter- and intradimer interfaces. Weaker density is seen for the region over the intradimer interface (segment II), indicative of more flexibility and weaker interaction. Only one repeat of MAP7 and its neighboring tubulins are shown for clarity. a.a., amino acids. (C) Ribbon diagram for MAP7 and tubulin with the improved cryo-EM density map shown in gray. (D) Details of the interacting residues between MAP7 and its neighboring tubulins. Tubulin residues are shown in italics. (E) Initial and final MAP7-tubulin conformations obtained from an example all-atom MD simulation. Beads represent constrained atoms in MAP7 and tubulin. (F) Average root mean squared fluctuations of MAP7 Cα atoms from the cryo-EM structure coordinates within 200 ns (n = 4 simulations). Single-letter abbreviations for the amino acid residues are as follows: A, Ala; C, Cys; D, Asp; E, Glu; F, Phe; G, Gly; H, His; I, Ile; K, Lys; L, Leu; M, Met; N, Asn; P, Pro; Q, Gln; R, Arg; S, Ser; T, Thr; V, Val; W, Trp; and Y, Tyr.
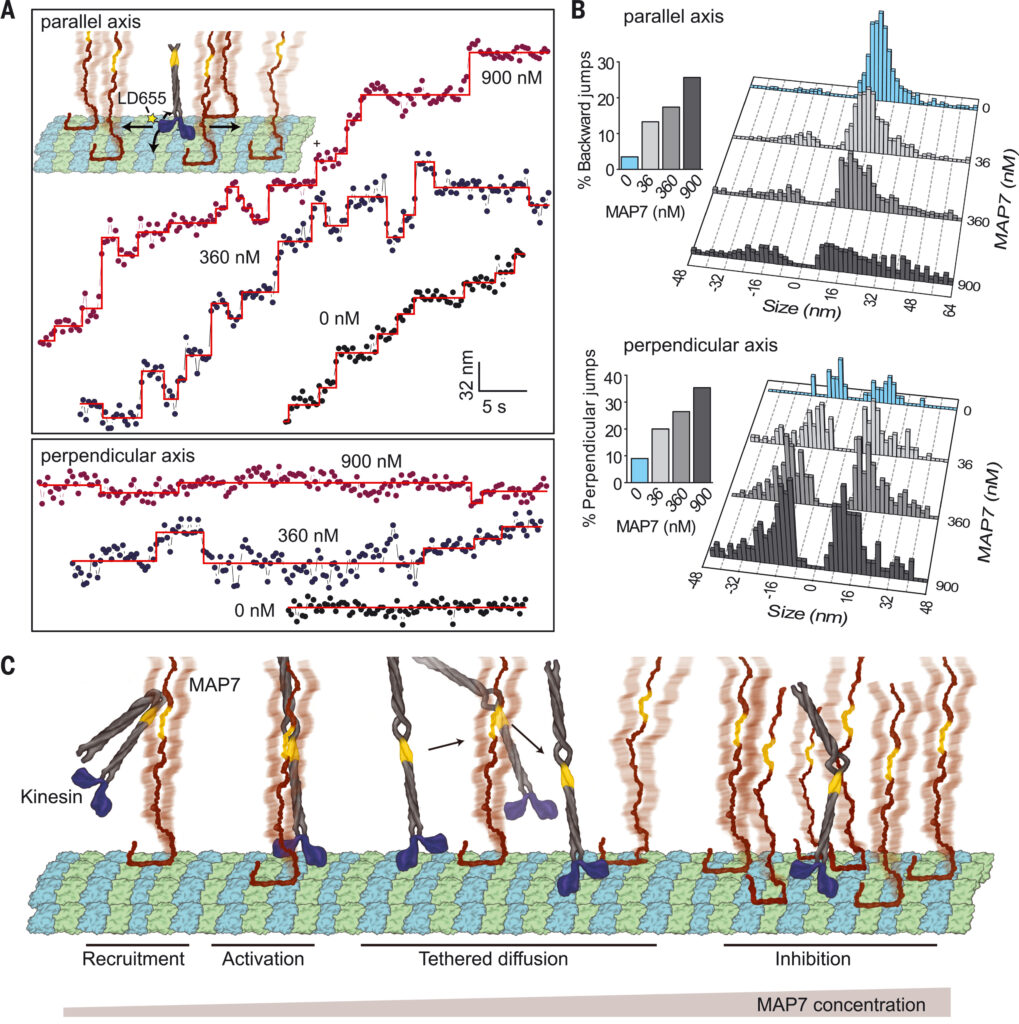
(A) (Inset) K560 was labeled with LD655 at its N terminus, and its stepping was tracked in parallel (straight arrows) and perpendicular (curved arrows) axes of MTs under different MAP7 concentrations. Representative traces of K560 motility along parallel (top) and perpendicular (bottom) directions. Horizontal lines represent a fit to a step-finding algorithm. (B) Histograms reveal the percentage of instantaneous jumps in backward and perpendicular directions under different MAP7 concentrations (bar graphs). From top to bottom, n = 437, 580, 502, and 331 for parallel and 43, 145, 195, and 181 for perpendicular directions. (C) Model for regulation of kinesin by MAP7. The MAP7 projection domain rescues kinesin from autoinhibition and tethers the motor to the MT. When kinesin encounters an MTBD obstacle, it dissociates from the MT, remains tethered to MAP7, and rebinds to an available tubulin site on another protofilament. Kinesin is inhibited at high MAP7 concentrations due to the scarcity of available binding sites.
今回の結果と過去の報告に基づき、我々はキネシンがMAP7で装飾されたMTをステップするモデルを提案する。MAP7はキネシン1を微小管(MT)にリクルートし、その後の運動性を活性化する。MAP7がMTに結合すると、キネシンがプロトフィラメントに沿ってステップすることが妨げられ、その結果、キネシンがMTから解離する。しかし、MAP7のプロジェクションドメインはキネシンをMT表面につなぎとめ、MTBDによってブロックされていない近くの部位でMTに再接続することを可能にする。このキネシンの「拘束された拡散」は、軌道上の大きな前方、側方、後方への変位として現れる。MT表面がMAP7でほぼ飽和すると、モーターが解離した後に再結合できる空のチューブリン部位が少なくなるため、キネシンの走行頻度と長さが減少する(図4C)。MAP7はキネシン-1と異なり、MTBDがダイニン結合部位と重なるためダイニンの運動を阻害するが、そのプロジェクションドメインはダイニンをMTに繋ぎとめることはない。
この二相制御機構により、細胞内MT上のMAP7密度を変化させることで、キネシン1駆動の輸送を正確に制御することができるかもしれない。MAP7は多くの細胞種でキネシン1駆動のプロセスに必要であるが、MAP7の高密度局在はラット神経細胞のブランチジャンクションでのオルガネラ輸送を遅くし停止させることが示された。MAP7の集積が進むと、キネシンのMTトラックからの離脱が促進され、これらの接合部で隣接するMTに再結合することにより、目的地への輸送が再ルートされる可能性がある。