SCIENCE ADVANCES 13 Oct 2021 Vol 7, Issue 42
Deformation of microtubules regulates translocation dynamics of kinesin (微小管の変形がキネシンの移動ダイナミクスを制御する)
Syeda Rubaiya Nasrin, Christian Ganser, Seiji Nishikawa, Arif Md. Rashedul Kabir, Kazuki Sada, Takefumi Yamashita, Mitsunori Ikeguchi, Takayuki Uchihashi, Henry Hess, Akira Kakugo*
Faculty of Science, Hokkaido University, Sapporo, Hokkaido 060-0810, Japan. (北海道大学大学院理学研究院)
Graduate School of Chemical Sciences and Engineering, Hokkaido University, Sapporo, Hokkaido 060-0810, Japan. (北海道大学 大学院総合化学院)
Roles: Conceptualization, Data curation, Formal analysis, Funding acquisition, Investigation, Methodology, Project administration, Resources, Supervision, Validation, Visualization, Writing – original draft, and Writing – review & editing.
責任著者:角五 彰 准教授 (北海道大学大学院・理学研究院化学部門・物質化学研究室
北海道大学大学院・総合化学院総合化学専攻・物質化学研究室)
Point
- 微小管が力学ストレスを感知することで、モータータンパク質(キネシン)の運動性が変調。
- モータータンパク質の運動性の変化は、引張や圧縮、曲げなどによる微小管の構造変化に起因。
- 細胞内物質輸送の障害に起因する神経疾患研究への波及効果等に期待。
https://www.rcast.u-tokyo.ac.jp/ja/news/release/20211014.html
Abstract
Microtubules, the most rigid components of the cytoskeleton, can be key transduction elements between external forces and the cellular environment. Mechanical forces induce microtubule deformation, which is presumed to be critical for the mechanoregulation of cellular events. However, concrete evidence is lacking. In this work, with high-speed atomic force microscopy, we unravel how microtubule deformation regulates the translocation of the microtubule-associated motor protein kinesin-1, responsible for intracellular transport. Our results show that the microtubule deformation by bending impedes the translocation dynamics of kinesins along them. Molecular dynamics simulation shows that the hindered translocation of kinesins can be attributed to an enhanced affinity of kinesins to the microtubule structural units in microtubules deformed by bending. This study advances our understanding of the role of cytoskeletal components in mechanotransduction.
概要
細胞骨格の中で最も剛直な構成要素である微小管は、外力と細胞環境との間の重要な伝達要素になり得る。機械的な力は微小管の変形を誘発し、この変形が細胞イベントのメカノレギュレーションに重要であると推測される。しかし、その具体的な証拠は乏しい。本研究では、高速原子間力顕微鏡を用いて、微小管の変形が、細胞内輸送を担う微小管結合モータータンパク質キネシン-1の移動をどのように制御しているかを明らかにした。その結果、曲げによる微小管の変形が、それに沿ったキネシンの移動ダイナミクスを阻害することが明らかになった。分子動力学シミュレーションの結果、キネシンの移動が妨げられるのは、曲げによって変形した微小管ではキネシンが微小管構造単位への親和性を高めていることに起因することが明らかになった。この研究により、メカノトランスダクションにおける細胞骨格成分の役割について理解が深まった。
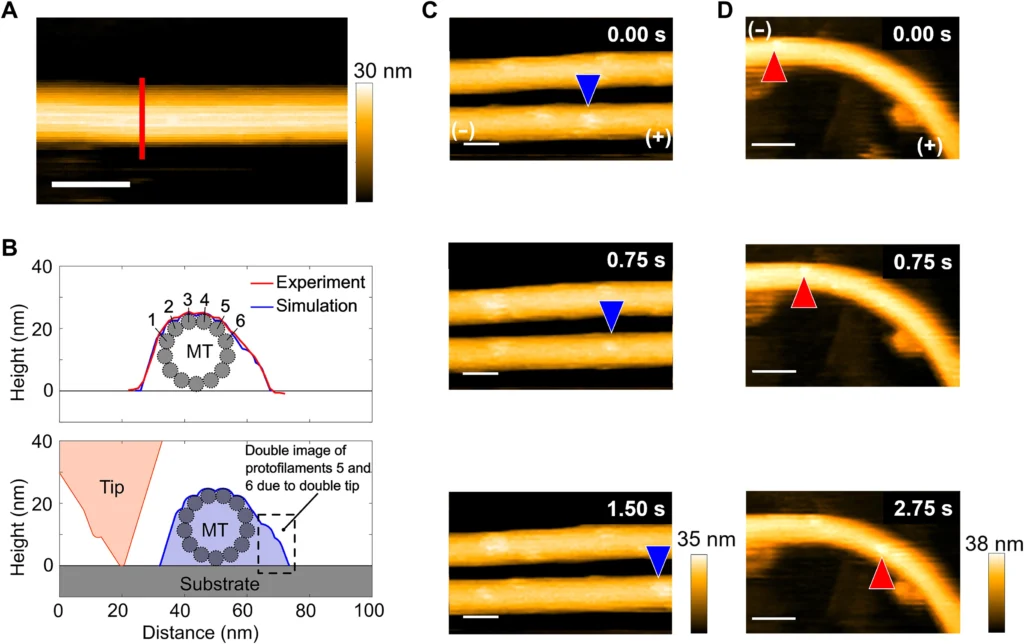
Fig. 1. High-resolution observation of kinesin translocation along microtubules using the HS-AFM.
(A) HS-AFM image of a straight microtubule on a mica-supported lipid bilayer. Scale bar, 50 nm. The red vertical line is drawn to obtain the height profile of the microtubule. (B) The height profile of the microtubule in (A) along the vertical line is shown using the solid red line (top). The height of ~25 nm corresponds to the microtubule diameter. The asymmetry in the line profile can be explained by tip-sample dilation simulation to identify the protofilaments from a line profile of microtubule using a tilted double tip (bottom). From comparing the experimentally obtained line profile of the microtubule with that obtained from the tip-dilation simulation, protofilaments 1 to 6 can be identified by overlapping the measured and simulated line profiles. The two bumps on the right side are caused by the double tip and are ghost images of protofilaments 5 and 6. (C) Time-lapse images showing translocation of single kinesin along a straight microtubule. Positions of one kinesin along the microtubule are shown using the blue arrowheads. Plus and minus ends of the microtubule are shown in the first image of the series. Scale bars, 50 nm. The concentrations of ATP and kinesin are 5.0 μM and 40.0 nM, respectively. (D) Time-lapse images showing motility of a single kinesin along a bent microtubule. Positions of one kinesin along the microtubule are shown using the red arrowheads. Plus and minus ends of the microtubule are shown in the first image of the series. Scale bars, 50 nm. The concentrations of ATP and kinesin are 5.0 μM and 40.0 nM, respectively.
〇東京大学プレスリリース
世界初!微小管がメカノセンサーであることを実証~微小管の構造変化がモータータンパク質のダイナミクスを変調させることを解明~
〇北海道大学プレスリリース
世界初!微小管がメカノセンサーであることを実証~微小管の構造変化がモータータンパク質のダイナミクスを変調させることを解明~(理学研究院:化学部門 准教授 角五 彰)
d27eefb7bf6ed43e6e409815c861628f本日はジャーナルクラブの後、医学群医学類のYWさんがプログレスレポートしました。
bbd63d3162cbb5b96561b2129e708642