Molecular Psychiatry Published: 02 May 2022
A common epigenetic mechanism across different cellular origins underlies systemic immune dysregulation in an idiopathic autism mouse model (特発性自閉症マウスモデルにおける全身性免疫異常の背景にある、異なる細胞起源にまたがる共通のエピジェネティックメカニズム)
Chia-Wen Lin, Dian E. Septyaningtrias, Hsu-Wen Chao, Mikiko Konda, Koji Atarashi, Kozue Takeshita, Kota Tamada, Jun Nomura, Yohei Sasagawa, Kaori Tanaka, Itoshi Nikaido, Kenya Honda, Thomas J. McHugh & Toru Takumi
- Laboratory for Mental Biology, RIKEN Brain Science Institute, Wako, Saitama, 351-0198, Japan
- Department of Physiology and Cell Biology, Kobe University School of Medicine, Chuo, Kobe, 650-0017, Japan
- RIKEN Center for Biosystems Dynamics Research, Chuo, Kobe, 650-0047, Japan
Abstract
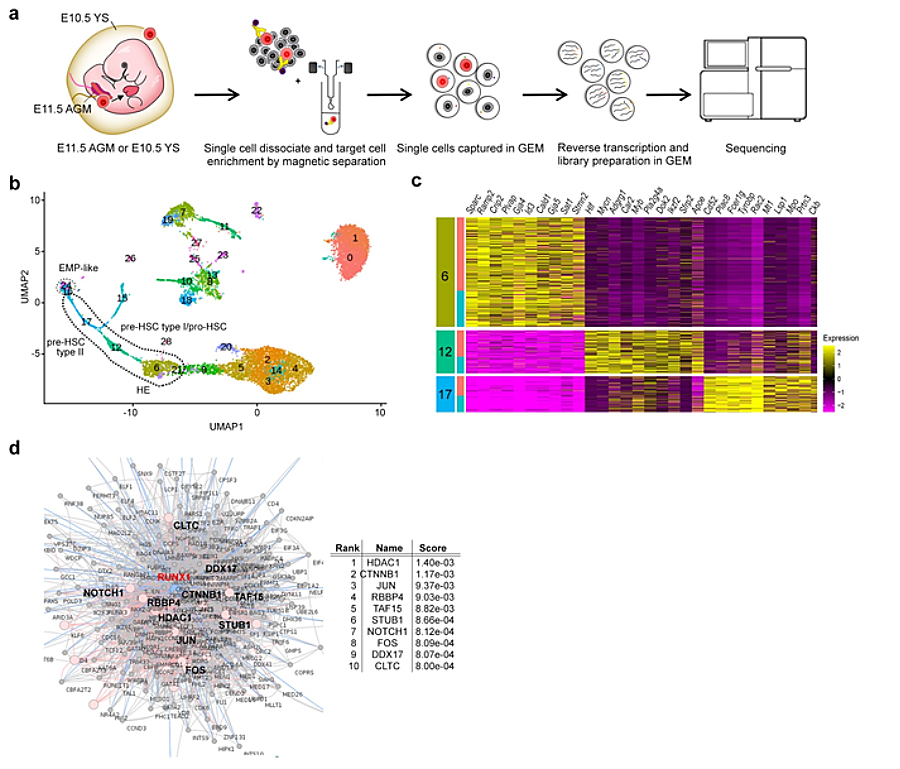
Immune dysregulation plays a key role in the pathogenesis of autism. Changes occurring at the systemic level, from brain inflammation to disturbed innate/adaptive immune in the periphery, are frequently observed in patients with autism; however, the intrinsic mechanisms behind them remain elusive. We hypothesize a common etiology may lie in progenitors of different types underlying widespread immune dysregulation. By single-cell RNA sequencing (sc-RNA seq), we trace the developmental origins of immune dysregulation in a mouse model of idiopathic autism. It is found that both in aorta-gonad-mesonephros (AGM) and yolk sac (YS) progenitors, the dysregulation of HDAC1-mediated epigenetic machinery alters definitive hematopoiesis during embryogenesis and downregulates the expression of the AP-1 complex for microglia development. Subsequently, these changes result in the dysregulation of the immune system, leading to gut dysbiosis and hyperactive microglia in the brain. We further confirm that dysregulated immune profiles are associated with specific microbiota composition, which may serve as a biomarker to identify autism of immune-dysregulated subtypes. Our findings elucidate a shared mechanism for the origin of immune dysregulation from the brain to the gut in autism and provide new insight to dissecting the heterogeneity of autism, as well as the therapeutic potential of targeting immune-dysregulated autism subtypes.
免疫異常は自閉症の病態に重要な役割を担っている。脳の炎症から末梢の自然免疫・適応免疫の乱れまで、全身レベルで起こる変化は自閉スペクトラム症(ASD)患者で頻繁に観察されるが、その背後にある本質的なメカニズムはまだ解明されていない。我々は、広範な免疫調節異常の根底にある異なるタイプの前駆細胞に共通の病因があるのではないかと考えている。そこで、single cell-RNAシーケンス(sc-RNA seq)により、特発性自閉症モデルマウスにおける免疫制御異常の発生起源を追跡した。その結果、大動脈性腺発生(大動脈-生殖腺-中隔膜; aorta-gonad-mesonephros: AGM)および卵黄嚢(yolk sac: YS)前駆細胞において、HDAC1を介したエピジェネティックな装置の制御異常が胚発生中の決定的な造血を変え、ミクログリア発生に関わるAP-1複合体の発現を低下させることが判明した。その後、これらの変化は免疫系の制御異常を引き起こし、腸内細菌の異常や脳内のミクログリアの過活動につながる。さらに、制御不能な免疫プロファイルが特定の微生物叢の構成と関連していることを確認し、免疫制御不全のサブタイプの自閉症を特定するバイオマーカーとして役立つ可能性があることを示した。著者らのこの研究結果は、自閉症の免疫異常が脳から腸に至る共通のメカニズムを明らかにし、自閉症の不均一性を解明するとともに、免疫異常のある自閉症サブタイプを標的とした治療の可能性に新たな知見を与えるものである。
https://www.eurekalert.org/multimedia/932340
Summary
〇ASDに見られる脳および末梢臓器での異常は、免疫細胞の祖先である造血幹細胞系のエピジェネティックな異常によって引き起こされる。
〇ヒストン脱アセチル化酵素1(HDAC1)の亢進による転写抑制は、血管内皮細胞から造血幹細胞の産生への過程(endothelial-to-hematopoietic transition; EHT)に影響を与える。卵黄嚢(Yolk sac)の赤血球・骨髄球系前駆細胞(erythromyeloid progenitor; EMP)は、ミクログリアを活性化して脳内炎症に影響を与える。AGM(aorta-gonad-mesonephros)の前造血幹細胞(pre-HSC)は、骨髄(BM)にて分化し、変化を受けた免疫系は腸内細菌叢(腸内フローラ)に影響を与える。
〇本研究成果は、ASDにおける全身性の免疫異常を明らかにし、環境リスク要因の異なるASDモデルに共通する原因としてエピジェネティックな障害が果たす役割を示唆している。ASDの治療法を発展させるためには、発症メカニズムに応じたASDのサブタイプ分類が必要であり、ASD治療の新たな道を開拓する道標を与えるものである。
https://research-er.jp/articles/view/110320
Does autism begin in the womb?
