Natuer Article Published: 23 February 2022 Nature volume 603, pages138–144
The lung microbiome regulates brain autoimmunity (肺細菌叢が脳の自己免疫を調節する)
Leon Hosang, Roger Cugota Canals, Felicia Joy van der Flier, Jacqueline Hollensteiner, Rolf Daniel, Alexander Flügel & Francesca Odoardi
Institute for Neuroimmunology and Multiple Sclerosis Research, University Medical Center Göttingen, Göttingen, Germany (ゲッティンゲン大学:ドイツのニーダーザクセン州ゲッティンゲンの大学。ハノーファー選帝侯ゲオルク・アウグストによって1737年に設立された)
Center for Biostructural Imaging of Neurodegeneration, University Medical Center Göttingen, Göttingen, Germany
Abstract
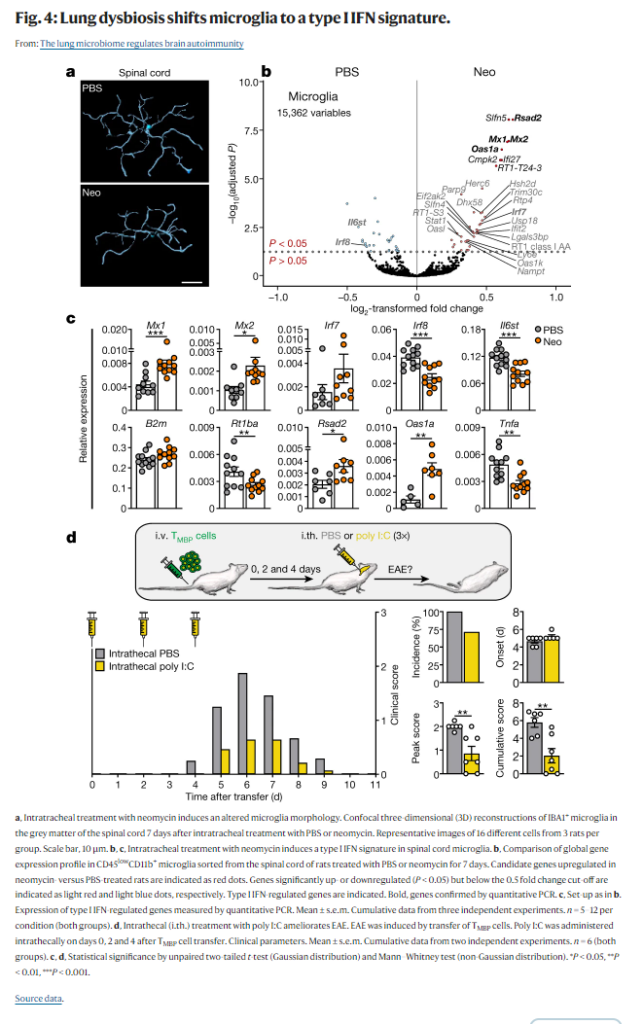
Lung infections and smoking are risk factors for multiple sclerosis, a T-cell-mediated autoimmune disease of the central nervous system1. In addition, the lung serves as a niche for the disease-inducing T cells for long-term survival and for maturation into migration-competent effector T cells2. Why the lung tissue in particular has such an important role in an autoimmune disease of the brain is not yet known. Here we detected a tight interconnection between the lung microbiota and the immune reactivity of the brain. A dysregulation in the lung microbiome significantly influenced the susceptibility of rats to developing autoimmune disease of the central nervous system. Shifting the microbiota towards lipopolysaccharide-enriched phyla by local treatment with neomycin induced a type-I-interferon-primed state in brain-resident microglial cells. Their responsiveness towards autoimmune-dominated stimulation by type II interferons was impaired, which led to decreased proinflammatory response, immune cell recruitment and clinical signs. Suppressing lipopolysaccharide-producing lung phyla with polymyxin B led to disease aggravation, whereas addition of lipopolysaccharide-enriched phyla or lipopolysaccharide recapitulated the neomycin effect. Our data demonstrate the existence of a lung–brain axis in which the pulmonary microbiome regulates the immune reactivity of the central nervous tissue and thereby influences its susceptibility to autoimmune disease development.
肺の感染と喫煙は、T細胞を介した中枢神経系の自己免疫疾患である多発性硬化症のリスクファクターである。また、肺は疾患誘導性T細胞の長期生存と遊走能を有するエフェクターT細胞への成熟のためのニッチとして機能している。 なぜ特に肺組織が脳の自己免疫疾患においてこのように重要な役割を果たすのかは、まだ分かっていない。今回、我々は、肺の微生物叢と脳の免疫反応性の間に密接な相互関係があることを発見した。肺のマイクロバイオームの異常は、ラットが中枢神経系の自己免疫疾患を発症しやすいかどうかに大きく影響することがわかった。ネオマイシン*の局所投与により、リポポリサッカライド(LPS)に富む微生物叢にシフトさせると、脳内常在のミクログリア細胞にタイプIインターフェロンがで刺激された状態が誘発された。その結果、自己免疫に支配的なタイプIIインターフェロンの刺激に対する応答性が損なわれ、炎症性反応、免疫細胞の動員、臨床症状の減少につながった。ポリミキシンB(ポリペプチド系の抗生物質。細菌の細胞膜をこわして殺菌的に作用する。特に緑膿菌などグラム陰性菌に強い抗菌力を発揮する)でリポ多糖産生肺門を抑制すると、疾患が悪化したが、リポ多糖が豊富な門またはリポ多糖を追加すると、ネオマイシン効果が再現されました。私たちのデータは、肺マイクロバイオームが中枢神経組織の免疫反応性を調節し、それによって自己免疫疾患の発症に対する感受性に影響を与える肺脳軸の存在を示している。
*ネオマイシンー1948年にウクライナ出身のセルマン・ワクスマンにより発見されたアミノグリコシド系抗生物質。放線菌の一種であるStreptomyces fradiaeが生産する。
まとめ
気管にネオマイシンを注入するとLPSを発現する細菌種が増加し、LPSは脳内でTLR3を介してtype1インターフェロンを誘導する。この結果ミクログリアの性質が変化して、自己免疫性炎症の維持が出来ず、脳炎が治まる。