Nature Article Published: 02 February 2022
Autism genes converge on asynchronous development of shared neuron classes (自閉症関連遺伝子は共通したニューロンクラスの非同期発生に収斂する)
Bruna Paulsen, Silvia Velasco, Amanda J. Kedaigle, Martina Pigoni, Giorgia Quadrato, Anthony J. Deo, Xian Adiconis, Ana Uzquiano, Rafaela Sartore, Sung Min Yang, Sean K. Simmons, Panagiotis Symvoulidis, Kwanho Kim, Kalliopi Tsafou, Archana Podury, Catherine Abbate, Ashley Tucewicz, Samantha N. Smith, Alexandre Albanese, Lindy Barrett, Neville E. Sanjana, Xi Shi, Kwanghun Chung, Kasper Lage, Edward S. Boyden, Aviv Regev, Joshua Z. Levin & Paola Arlotta
Department of Stem Cell and Regenerative Biology, Harvard University, Cambridge, MA, USA
Stanley Center for Psychiatric Research, Broad Institute of MIT and Harvard, Cambridge, MA, USA
Nature volume 602, pages268–273 (2022)
Paola Arlotta (パオラ・アルロッタ)博士は、ハーバード大学の幹細胞・再生生物学の教授であり、HSCRBの議長を務めている。また、ハーバード幹細胞研究所の主要教員であり、神経科学プログラムの共同リーダー、ブロード研究所の研究所員、ブロード研究所スタンレー精神医学研究センターの準メンバーでもある。アルロッタ博士は、人間の脳の大脳皮質の誕生、分化、組み立てを支配する分子法則の解明に興味を持っている。脳の複雑さに魅了され、発生学と進化学の知識を統合して、脳の修復や神経精神疾患のモデル化のための治療法を研究したいと考えている。アルロッタ氏は、イタリアのトリエステ大学で生化学の修士号を、英国のポーツマス大学で分子生物学の博士号を取得した。その後、ハーバード・メディカル・スクールで神経科学のポスドクとして研修を受けた。
Abstract
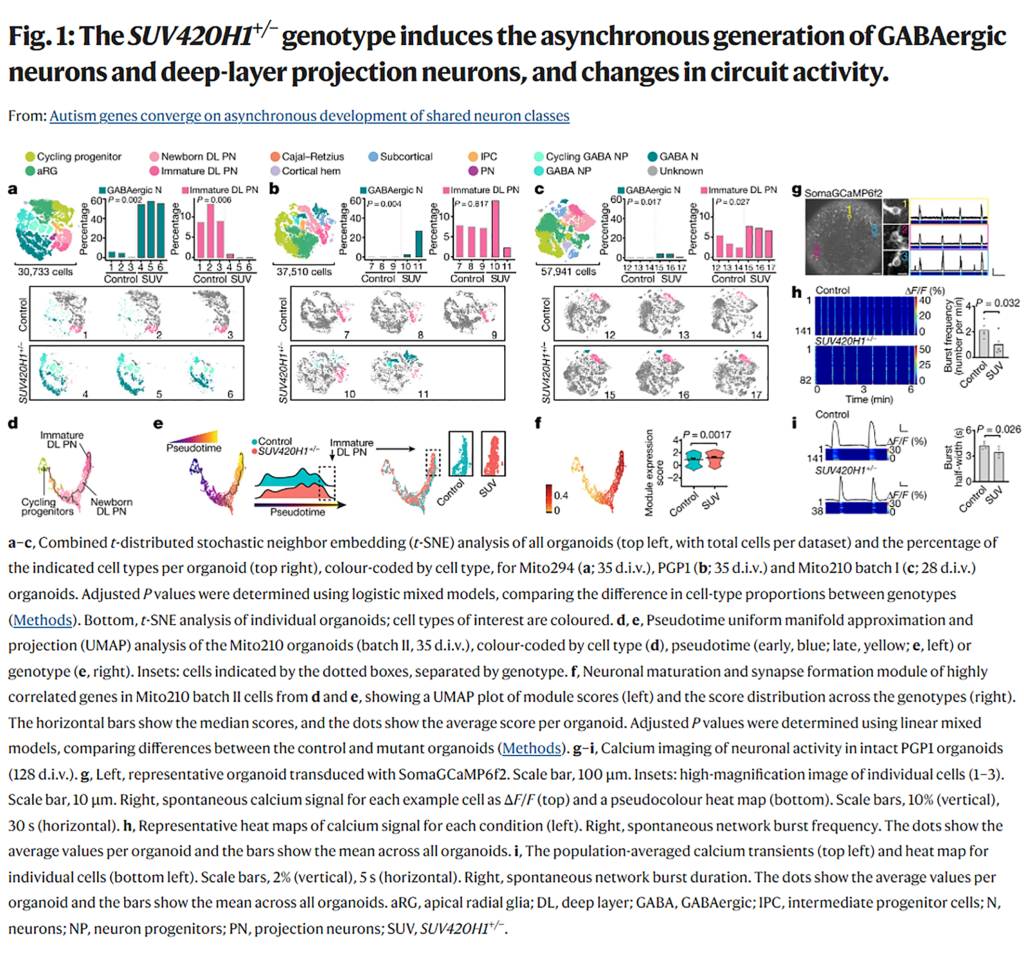
自閉症スペクトラム障害(ASD)の遺伝的リスクには、幅広い生物学的機能を持つ数百もの遺伝子が関連している。しかし、これらの遺伝子の変異によって生じるヒトの脳の変化は、まだ明らかになっていない。さらに、その表現型は個人によって異なる。ここでは、ヒト大脳皮質のオルガノイドモデルを用いて、異なるドナーからの複数の細胞株において、3つのASDリスク遺伝子(SUV420H1(別名KMT5B)、ARID1B、CHD8)のハプロ不全に起因する細胞タイプ特異的な発生異常を、745,000個以上の細胞のシングルセルRNA-sequencing(scRNA-seq)解析と個々のオルガノイドのプロテオミクス解析により明らかにし、表現型の収束を確認した。3つの変異はそれぞれ、γ-aminobutyric-acid-releasing(GABA)ニューロンと深層興奮性投射ニューロンという2つの主要な皮質ニューロン系統の発達を非同期にさせるが、ほとんど異なる分子経路を介して作用する。これらの表現型は細胞株間で一貫しているが、その発現は個々のゲノムコンテクストに影響され、リスク遺伝子と発生上の欠陥の両方に依存している。無傷のオルガノイドを用いたカルシウムイメージングにより、これらの発生初期段階の変化に続いて、回路の異常な活動が起こることがわかった。本研究では、ASDのリスク遺伝子に共通する細胞型特異的な神経発達異常が、ヒトのゲノムコンテクストによって細かく調節されていることを明らかにし、異なるリスク遺伝子がASDの病態にどのように寄与しているかという神経生物学的基盤に収束点を見出した。
Discussion
ASDリスク遺伝子の変異が、この多面的な疾患の神経生物学に収束していく過程は、まだ明らかになっていない。本研究では、局所的な皮質回路の2つのニューロンクラス(GABA作動性ニューロンと深層投射ニューロン)が特異的に影響を受ける集団であることを明らかにした。大脳皮質微小回路の興奮性/抑制性の不均衡は、ASDの病因の主要な仮説であり、これまでの研究では、ASD患者や実験モデルにおいて、GABA作動性およびグルタミン酸作動性の大脳皮質ニューロンの調節障害が関与していることが示唆されている。注目すべきは、リスク遺伝子と各変異によって引き起こされる特異的な異常の両方に基づいて、異なるヒトのゲノムコンテクストが表現型の発現を調節することを示していることである。多くのASDリスク遺伝子の変異は、ヒトにおいて様々な臨床症状を示すので、これは興味深いことである。
異なるASDリスク遺伝子が、神経細胞の非同期的な発達という表現型に収束するが、分子標的のレベルでは多くの分岐を示すという著者らの発見は、これらの遺伝子に共通する臨床病理が、神経細胞の分化や回路の配線といった高次のプロセスに由来する可能性を示唆している。これらの結果は、共通の分子経路に加えて、共通の機能不全回路の特性を調節することを目的とした治療法の検討を促すものである。