SCIENCE 27 Aug 2021 Vol 373, Issue 6558 DOI: 10.1126/science.abf3002
RESEARCH ARTICLE
Prenatal maternal infection promotes tissue-specific immunity and inflammation in offspring (出生前の母体感染は、子の組織特異的免疫性と炎症を促進する)
Ai Ing Lim1, Taryn McFadden1, Verena M. Link1, Seong-Ji Han1, Rose-Marie Karlsson2, Apollo Stacy1,3,
Taylor K. Farley1,4, Djalma S. Lima-Junior1, Oliver J. Harrison1†, Jigar V. Desai5, Michail S. Lionakis5, Han-Yu Shih6, Heather A. Cameron2, Yasmine Belkaid1,7*
1Metaorganism Immunity Section, Laboratory of Immune System Biology and Laboratory of Host Immunity and Microbiome, National Institute of Allergy and Infectious Diseases, National Institutes of Health, Bethesda, MD 20892, USA.
2Section on Neuroplasticity, Mood and Anxiety Disorders Program, National Institute of Mental Health, National Institutes of Health, Bethesda, MD 20892, USA.
3Postdoctoral Research Associate Training Program, National Institute of General Medical Sciences, Bethesda, MD 20892, USA.
4Kennedy Institute of Rheumatology, Nuffield Department of Orthopaedics, Rheumatology and Musculoskeletal Sciences, University of Oxford, Oxford OX3 7FY, UK.
5Fungal Pathogenesis Section, Laboratory of Clinical Immunology and Microbiology, National Institute of Allergy and Infectious Diseases, National Institutes of Health, Bethesda, MD 20892, USA.
6Neuro-Immune Regulome Unit, National Eye Institute, National Institutes of Health, Bethesda, MD 20892, USA.
7NIAID Microbiome Program, National Institute of Allergy and Infectious Diseases, National Institutes of Health, Bethesda, MD 20892, USA. *国立衛生研究所(National Institutes of Health:NIH)傘下機関の国立アレルギー感染症研究所
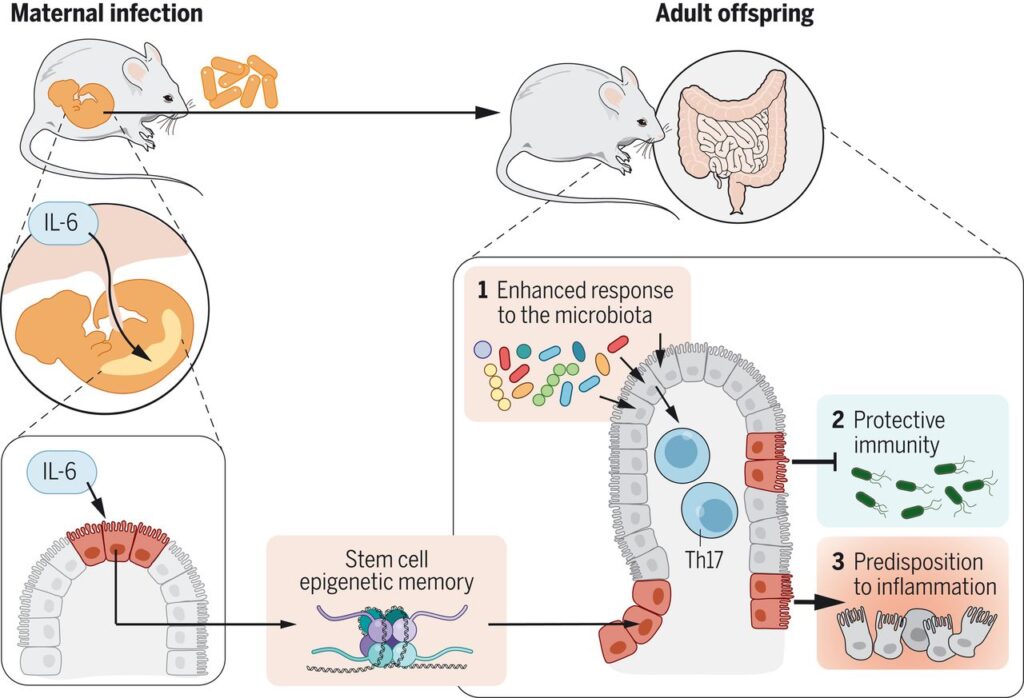
Mom’s IL-6 rewires baby’s gut immunity (母親のIL-6は子の腸管免疫を再配線する)
Most infections that occur during pregnancy are mild and transient. However, whether such pathogen encounters can shape the long-term trajectory of the offspring’s immune system remains unclear. Lim et al. infected pregnant mice with the common food-borne pathogen Yersinia pseudotuberculosis (YopM) (see the Perspective by Amir and Zeng). Although the infection was maternally restricted and short-lived, the offspring harbored greater numbers of intestinal T helper 17 cells into adulthood. Interleukin-6 (IL-6) mediated this tissue-restricted effect by acting on the fetal intestinal epithelium during development. Although offspring from mothers infected with YopM or injected with IL-6 showed enhanced resistance to oral infection with Salmonella Typhimurium, they also exhibited higher susceptibility toward enteric inflammatory disease.
妊娠中に発生する感染症の多くは、軽度で一過性のものである。しかし、このような病原体との出会いが、子孫の免疫系の長期的な軌道を形成するかどうかは、まだ不明である。Limらは、一般的な食品媒介病原体であるYersinia pseudotuberculosis(YopM; Yersinia 属菌はグラム陰性の桿菌で腸内細菌科に属してiいる)を妊娠中のマウスに感染させた(AmirとZengによる展望を参照)。感染は母親に限定されていて短期間であったが、子孫は成人になっても腸内Tヘルパー17細胞の数が多かった。この組織制限効果は、インターロイキン6(IL-6)が発生過程で胎児の腸管上皮に作用することによって媒介されていた。YopMを感染させた母親やIL-6を注射した母親から生まれた子供は、Salmonella Typhimurium (サルモネラ菌)の経口感染に対する抵抗性が高まる一方で、腸炎性疾患にかかりやすくなることがわかった。
Science, abf3002, this issue p. eabf3002; see also abl3631, p. 967
Abstract
The immune system has evolved in the face of microbial exposure. How maternal infection experienced at distinct developmental stages shapes the offspring immune system remains poorly understood. Here, we show that during pregnancy, maternally restricted infection can have permanent and tissue-specific impacts on offspring immunity. Mechanistically, maternal interleukin-6 produced in response to infection can directly impose epigenetic changes on fetal intestinal epithelial stem cells, leading to long-lasting impacts on intestinal immune homeostasis. As a result, offspring of previously infected dams develop enhanced protective immunity to gut infection and increased inflammation in the context of colitis. Thus, maternal infection can be coopted by the fetus to promote long-term, tissue-specific fitness, a phenomenon that may come at the cost of predisposition to inflammatory disorders.
免疫系は、微生物にさらされながら進化してきた。しかし、母親の感染が子孫の免疫系にどのような影響を与えるのかについては、まだよくわかっていない。今回、私たちは、妊娠中に母親が感染を制限することで、子孫の免疫に永続的かつ組織特異的な影響を与えることを明らかにした。メカニズム的には、感染に反応して産生された母親のインターロイキン6が、胎児の腸管上皮幹細胞に直接エピジェネティックな変化を与え、腸管免疫のホメオスタシスに長期的な影響を与えることになる。その結果、過去に感染したことのある母親から生まれた子供は、腸管感染に対する防御免疫が強化され、大腸炎の炎症が増加する。このように、母親の感染は胎児に利用され、長期的な組織特異的なフィットネスを促進することができるが、この現象は炎症性疾患の素因を犠牲にしている可能性がある。