本日は医療科学類の留学生が研究進捗報告を、同じく医療科学類国際医療科学専攻3年生が論文紹介をする…はずでしたが急遽お休みとのことでした。医学類1年生の方が自己紹介をしてくれました。若い方から元気をもらって年度末を乗り切りたいものです(業務がめちゃくちゃです💦)。
Journal of Autism and Developmental Disorders, 2023年(Accepted: 2022年5月25日、Online published: 2022年6月15日)
Layer-Specific Changes in the Prefrontal Glia/Neuron Ratio Characterizes Patches of Gene Expression Disorganization in Children with Autism (自閉スペクトラム症児における遺伝子発現異常パッチは、前頭前野の層特異的なグリア/ニューロン比の変化によって特徴づけられる)
Livia Nascimento Rabelo et al. (Graduate Program in Neuroengineering, Edmond and Lily Safra International Institute of Neuroscience, Santos Dumont Institute, Brazil)
Abstract
Autism spectrum disorder (ASD) is manifested by abnormal cell numbers and patches of gene expression disruption in higher-order brain regions. Here, we investigated whether layer-specific changes in glia/neuron ratios (GNR) characterize patches in the dorsolateral prefrontal cortex (DL-PFC) of children with ASD. We analyzed high-resolution digital images of postmortem human brains from 11 ASD and 11 non-ASD children obtained from the Autism Study of the Allen Human Brain Atlas. We found the GNR is overall reduced in the ASD DL-PFC. Moreover, layers II-III belonging to patches presented a lower GNR in comparison with layers V-VI. We here provide a new insight into how brain cells are arranged within patches that contributes to elucidate how neurodevelopmental programs are altered in ASD.
Background
ASDは社会性障害や反復行動を特徴とし、発達早期から脳の過成長や皮質構造異常が報告されている。DL-PFCは社会的認知や作業記憶に関与し、ASDではニューロン数増加やグリア減少が示唆されてきた。一方、Courchesneらにより、ASD児の大脳皮質には特定遺伝子の発現が欠損する「パッチ」が存在することが報告されているが、その細胞組成学的特徴は未解明であった。
Abstract
自閉スペクトラム症(ASD)では、高次脳領域における細胞数異常や遺伝子発現の局所的破綻(パッチ)が報告されている。本研究では、ASD児の背外側前頭前野(DL-PFC)において、層特異的なグリア/ニューロン比(GNR)の変化が遺伝子発現異常パッチを特徴づけるかを検討した。ASD児11例と非ASD児11例の死後脳デジタル画像を解析した結果、DL-PFC全体でGNRはASD群で低下していた。特にパッチ領域では、層II–IIIにおけるGNRが層V–VIよりも有意に低かった。これらの結果は、ASDにおける神経発達プログラムの異常を理解する新たな視点を提供する。
Methods
- 対象:ASD児11例、年齢一致非ASD児11例
- 材料:Allen Human Brain Atlas(Autism Study)由来のDL-PFC高解像度デジタル画像
- 染色・マーカー:Nissl染色、ISH(CALB1、RORB、PCP4)
- 解析:
- パッチ領域をISHマーカーの発現欠損で同定(5–7 mm)
- 層II–III(上層)と層V–VI(下層)を区別
- ニューロン数とグリア数を形態学的特徴からカウント
- グリア/ニューロン比(GNR)を算出
Results
本研究では、ASD児および非ASD児の背外側前頭前野(DL-PFC)におけるグリア/ニューロン比(GNR)を解析した結果、DL-PFC全体(層I–VI)でASD群のGNRは非ASD群に比べて有意に低く、ASDでは2.18±0.34、非ASDでは2.72±0.47であり、約20%の低下が認められた(t(20)=3.08, p=0.006)。層II–IIIおよび層V–VIに分けて解析すると、ASD群はいずれの層でも非ASD群より低いGNRを示したが、この段階では有意差には達しなかった。次に、ASD脳を遺伝子発現異常パッチ領域、非パッチ領域、非ASD脳の3群で比較すると、DL-PFC全体では群間に有意差が認められ(F(2,28)=11.85, p=0.0002)、ASDパッチ(1.91±0.34)およびASD非パッチ(2.05±0.39)のGNRはいずれも非ASD(2.72±0.47)より有意に低かった。一方、層II–IIIに限定した解析では群間差がさらに顕著となり(F(2,28)=20.27, p<0.0001)、ASDパッチ領域のGNR(1.23±0.37)はASD非パッチ(1.87±0.44)および非ASD(2.28±0.33)の両者より有意に低く、ASD非パッチも非ASDより低値を示した。これに対し、層V–VIでは3群間に有意差は認められなかった。さらに、パッチを有するASD症例10例について同一個体内でパッチと非パッチを直接比較したところ、層II–IIIにおいてパッチ領域のGNRは非パッチ領域に比べて平均34%低下しており(t(9)=5.22, p=0.0005)、この差はDL-PFC全体や層V–VIでは認められなかった。また層間比較では、非ASD脳およびASD非パッチ領域では層II–IIIと層V–VIのGNRに差はなかったのに対し、ASDパッチ領域では層II–IIIのGNRが層V–VIより平均32%低く(t(9)=3.52, p=0.006)、10例中9例で同様の傾向が確認された。年齢、死後経過時間(PMI)、RNA integrity number(RIN)を共変量とした解析では、これら因子の有意な影響は認められなかった。
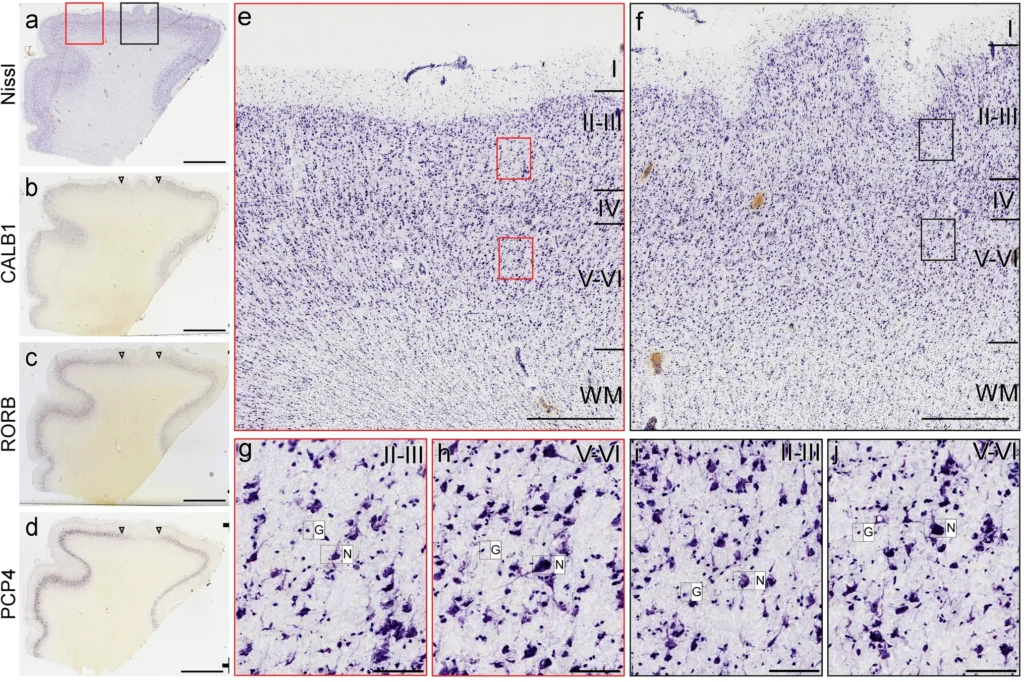
複数の層特異的ISHマーカーを用いてパッチを定義する方法
Nissl像を基盤とした皮質層区分(II–III vs V–VI)
パッチ/非パッチ × 上層/下層という4条件での細胞カウント手法
Discussion
本研究では、自閉スペクトラム症(ASD)児の背外側前頭前野(DL-PFC)において、グリア/ニューロン比(GNR)が非ASD児に比べて低下していること、さらにその低下が遺伝子発現異常パッチにおける上層(層II–III)で特に顕著であることを示した。GNRの低下は、面積あたりでニューロンが相対的に多い、あるいはグリアが相対的に少ない状態、もしくはその両方を反映している可能性があるが、GNRは比率指標であるため、細胞数そのものの変化だけでなく、ニューロンやグリアのサイズ変化が形態学的カウントに影響している可能性も否定できない。
これらの結果は、先行研究で報告されてきたASD児DL-PFCにおけるニューロン過剰やグリア変化と整合的である。Courchesneらは、設計ベースのステレオロジーによりASD児DL-PFCでニューロン数が79%増加していると報告したが、その後のStonerらやFalconeら、そして本研究では、そこまで大きな差は再現されていない。著者らは、この違いはドナー集団や解析手法の差による可能性が高いとしつつも、複数の独立した研究が一貫して「DL-PFCにおけるニューロン過剰方向の変化」を示している点を強調している。
特に重要なのは、本研究がStonerらによって同定された「皮質パッチ」に焦点を当て、層特異的に細胞組成を解析した点である。Stonerらは、パッチ領域においてもニューロン密度やグリア密度、細胞サイズに大きな差はないと報告していたが、本研究では全層平均ではパッチと非パッチのGNRに大きな差が見られない一方で、層II–IIIに限定すると、パッチ領域でGNRが著しく低下していることを明らかにした。これは、パッチが「明瞭な皮質構築異常を伴わない」領域であっても、上層皮質においては細胞組成の比率という形で異常が顕在化していることを示唆している。
また、Falconeらが報告した、前頭前野における層IIニューロンの増加およびアストロサイト・オリゴデンドロサイト比の低下という結果とも一致しており、上層皮質におけるニューロン過剰とグリア相対不足は、年齢を超えて持続するASDの特徴である可能性が示される。実際、本研究でもASDパッチ領域のほとんどの症例で、層II–IIIが層V–VIより低いGNRを示しており、この層間非対称性は非ASD皮質やASD非パッチ領域では観察されなかった。
著者らは、こうした所見を出生前の皮質発生過程の異常と結びつけて解釈している。ニューロンとグリアの数的バランスは、胎児期の神経新生・グリア新生、前駆細胞の分化・増殖・移動プログラムによって規定されるため、GNRの変化はASDの病因が出生前に始まっていることを支持する。ASDに関連するゲノムワイド関連解析で、胎児期皮質形成に関与する遺伝子群が同定されている点や、Stonerらが提唱した「特定の前駆細胞サブセットにおける遺伝的・エピジェネティック異常がパッチを生む」という仮説とも整合的である。
一方で、パッチでは深層マーカー(PCP4など)の発現も乱れていることから、著者らは、異常が皮質発生の後期だけでなく、より早期の増殖段階に及んでいる可能性も示唆している。例えば、放射状グリアにおける遺伝子発現の喪失が、明確な細胞数変化を伴わずに起こり、その結果として上層に移行する細胞の数や比率が局所的に変化する可能性が考えられる。こうした仮説は、動物モデルにおいて上層ニューロンの過剰産生がASD様行動を引き起こすことや、ASD由来iPSCの神経前駆細胞が短い細胞周期で増殖しやすいという報告とも一致している。
最終的に著者らは、DL-PFCにおける上層皮質でのGNR低下、とくに遺伝子発現異常パッチに集中した変化が、ニューロン–グリア相互作用の異常を介して局所過結合を生み出し、ASDに特徴的な社会性や言語機能の障害に寄与する可能性があると結論づけている。本研究は、ASD脳における遺伝子発現異常と細胞組成異常を結びつける解剖学的根拠を提示し、ASDの神経発達病態を理解する上で重要な一段階を提供するものである。






