本日は医学類の学生の方が論文紹介を、医療科学類の学生の方が自己紹介をしてくれました。研究室見学に来てくれたM3の学生も参加しました。
Cell. 2025 Apr 3:S0092-8674(25)00279-X. doi: 10.1016/j.cell.2025.03.006. Online ahead of print.
Brain-wide mapping of immune receptors uncovers a neuromodulatory role of IL-17E and the receptor IL-17RB (免疫受容体の脳全体におけるマッピングにより、IL-17Eと受容体IL-17RBの神経調節作用が明らかになる)
Yunjin Lee 1, Tomoe Ishikawa 2, Hyeseung Lee 3, Byeongjun Lee 2, Changhyeon Ryu 2, Irene Davila Mejia 2, Minjin Kim 1, Guangqing Lu 1, Yujin Hong 1, Mengyang Feng 2, Hyeyoon Shin 1, Sylvain Meloche 4, Richard M Locksley 5, Ekaterina Koltsova 6, Sergei I Grivennikov 7, Myriam Heiman 3, Gloria B Choi 8, Jun R Huh 9
- Picower Institute for Learning and Memory, Massachusetts Institute of Technology, Cambridge, MA, USA; Department of Brain and Cognitive Sciences, Massachusetts Institute of Technology, Cambridge, MA, USA.
- Department of Immunology, Blavatnik Institute, Harvard Medical School, Boston, MA, USA; Human Biology Microbiome Quantum Research Center (Bio2Q), Keio University, Tokyo, Japan; Lurie Center for Autism, Massachusetts General Hospital, Lexington, MA, USA.
Summary
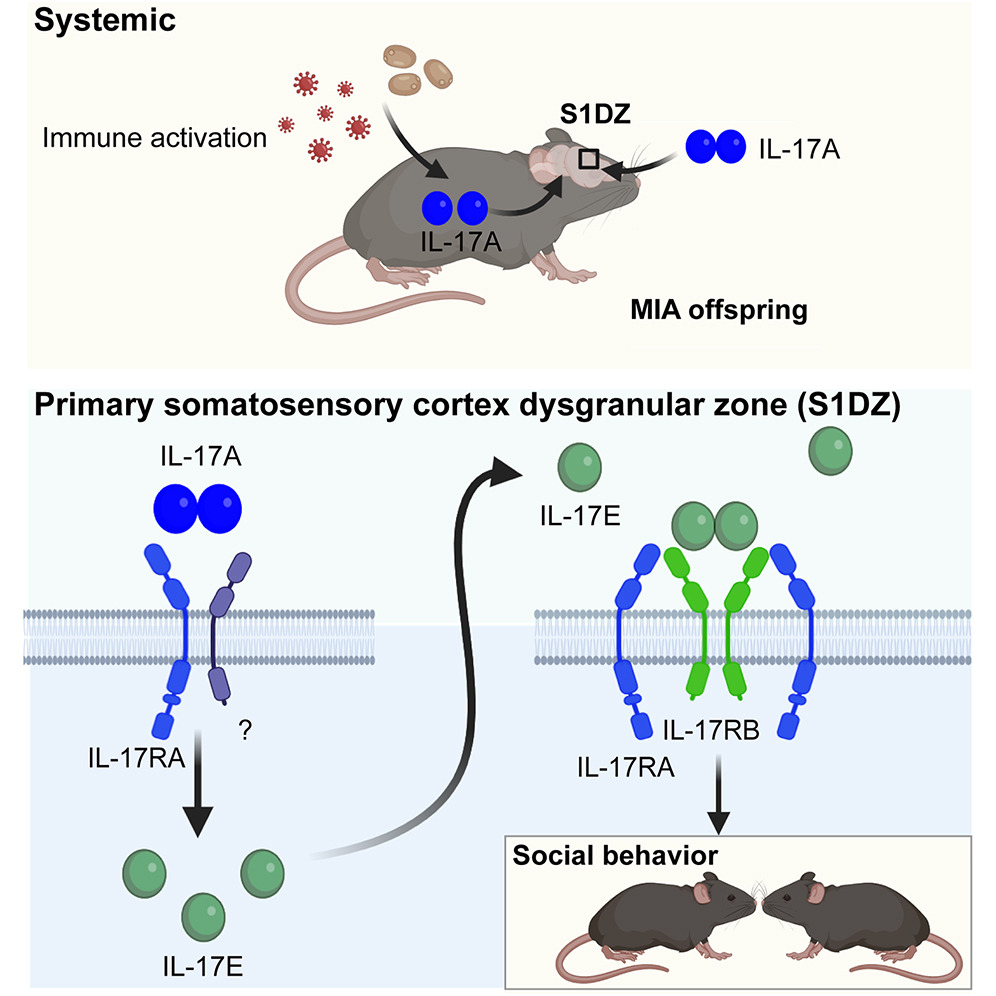
Cytokines interact with their receptor complexes to orchestrate diverse processes—from immune responses to behavioral modulation. Interleukin-17A (IL-17A) mediates protective immune responses by binding to IL-17 receptor A (IL-17RA) and IL-17RC subunits. IL-17A also modulates social interaction, yet the role of cytokine receptors in this process and their expression in the brain remains poorly characterized. Here, we mapped the brain-region-specific expression of all major IL-17R subunits and found that in addition to IL-17RA, IL-17RB—but not IL-17RC—plays a role in social behaviors through its expression in the cortex. We further showed that IL-17E, expressed in cortical neurons, enhances social interaction by acting on IL-17RA- and IL-17RB-expressing neurons. These findings highlight an IL-17 circuit within the cortex that modulates social behaviors. Thus, characterizing spatially restricted cytokine receptor expression can be leveraged to elucidate how cytokines function as critical messengers mediating neuroimmune interactions to shape animal behaviors.
サイトカインは、その受容体複合体と相互作用し、免疫反応から行動の調節に至るまで、多様なプロセスを調整する。インターロイキン-17A(IL-17A)は、IL-17受容体A(IL-17RA)およびIL-17RCサブユニットに結合することで、防御免疫反応を媒介する。IL-17Aはまた、社会的相互作用も調節するが、このプロセスにおけるサイトカイン受容体の役割や、脳における発現については、まだ十分に解明されていない。 ここでは、主要なIL-17Rサブユニットのすべてについて、脳領域特異的な発現をマッピングし、IL-17RAに加えて、IL-17RB(ただしIL-17RCは含まない)が大脳皮質での発現を通じて社会的行動に役割を果たしていることを発見した。さらに、大脳皮質ニューロンで発現するIL-17Eが、IL-17RAおよびIL-17RBを発現するニューロンに作用することで、社会的相互作用を促進することも示しました。これらの発見は、社会的行動を調節する大脳皮質内のIL-17回路を明らかにするものです。したがって、空間的に限定されたサイトカイン受容体の発現を特徴づけることは、神経免疫相互作用を媒介する重要なメッセンジャーとしてサイトカインが動物行動を形作る仕組みを解明する上で役立つ可能性があります。
Highlights
- IL-17受容体サブユニットは、脳内で異なる神経細胞発現パターンを示す
- IL-17RBとIL-17Eの相互作用が、S1DZにおける社会的行動を促進する
- IL-17Eは、大脳皮質ニューロンの神経調節因子として機能する
Abstract:
本研究では、IL-17受容体の脳全体における発現をマッピングし、IL-17Eとその受容体IL-17RBが社会的行動を調節する神経調節因子として機能することを明らかにした。特に、一次体性感覚野(S1DZ)において、IL-17EがIL-17RAおよびIL-17RBを発現する神経細胞に作用して社会的相互作用を促進する。これにより、サイトカインが神経免疫相互作用を介して行動を形成するメッセンジャーとして機能することが示唆された。
Background:
IL-17ファミリーのサイトカインは主に免疫系の効果器として知られるが、最近では神経系にも影響を及ぼすことが示されている。特にIL-17Aは、脳の発達や行動にも関与するが、脳におけるIL-17受容体の発現とその行動への影響は不明だった。
Methods:
5種類のIL-17受容体(RA, RB, RC, RD, RE)を発現するマウス系統をCRISPRまたは相同組換えで作成し、AAVウイルスを用いてCre依存性にEGFPを発現させた。さらに、翻訳リボソーム親和性精製(TRAP)法やRNA-seqを用いて、S1DZ領域でのIL-17R発現細胞のトランスクリプトーム解析を行った。
Results:
IL-17RAとIL-17RBがS1DZで強く発現し、IL-17RCはほとんど発現しなかった。TRAP解析により、IL-17RB陽性細胞は神経伝達物質分泌などに関与する遺伝子を高発現していた。さらに、IL-17AとIL-17Eの投与でMIAマウスの社会的欠陥が回復し、特にIL-17Eが神経興奮性を低下させることで社会行動を促進することが示された。
Discussion:
IL-17EはIL-17RBを介して神経細胞の興奮性を抑制し、社会的行動を正常化する神経調節因子として機能する。IL-17AはIL-17Eの発現を促進し、その効果を間接的に発揮する。IL-17RAとIL-17RBの共発現細胞がこの作用の鍵を握っている。IL-17受容体の脳全体でのマッピングと、IL-17Eの神経調節因子としての直接的機能を初めて示した。特に、IL-17A→IL-17E→IL-17RB経路による社会行動制御のメカニズムを新たに提案している。IL-17Eの放出メカニズムやNF-kB以外の経路の関与は未解明であるので、今後の研究の進展が期待される。IL-17E-IL-17RB経路を標的とした新たな神経発達障害(例:自閉症)の治療法の開発が期待される。また、サイトカイン受容体の脳内マッピングを通じて、他の免疫-神経インターフェースの解明にも応用可能である。





