Nature Protocols volume 6, pages1391–1411 (2011) Protocol Published: 25 August 2011
High-throughput, detailed, cell-specific neuroanatomy of dendritic spines using microinjection and confocal microscopy (マイクロインジェクションと共焦点顕微鏡を用いた樹状突起スパインのハイスループットで詳細な細胞特異的神経解剖学)
Dani Dumitriu 1, Alfredo Rodriguez, John H Morrison
Fishberg Department of Neuroscience, Mount Sinai School of Medicine, New York, New York, USA. dani.dumitriu@mssm.edu
Abstract
樹状突起スパインのサイズ、形状、密度などの形態学的特徴は、重要なシナプス機能特性や可塑性の可能性を反映することが示されている。ここでは、蛍光色素のマイクロインジェクション、高分解能共焦点顕微鏡、デコンボリューション、NeuronStudioによる画像解析を用いて、スパインの詳細な形態学的解析を得るためのプロトコルを詳細に説明する。最近の技術的な進歩としては、組織の保存性が向上し、マイクロインジェクションが長期間可能になったこと、すべての光学イメージングに内在する残留Z-スミア(z-smear)を補正するアルゴリズムが改良されたことなどが挙げられる。共焦点イメージング・パラメーターは、最適な解像度と最高の効率を特定するために系統的に検討された。この方法を組み合わせることで、透過型電子顕微鏡による連続切片観察に匹敵するサイズと密度の測定が、わずかな時間で可能になった。被験者8人ずつの3つの実験グループを含む実験では、速度を最適化すれば1ヶ月程度、最高の解像度と形態学的な詳細を追求すれば4~5ヶ月程度で済む。
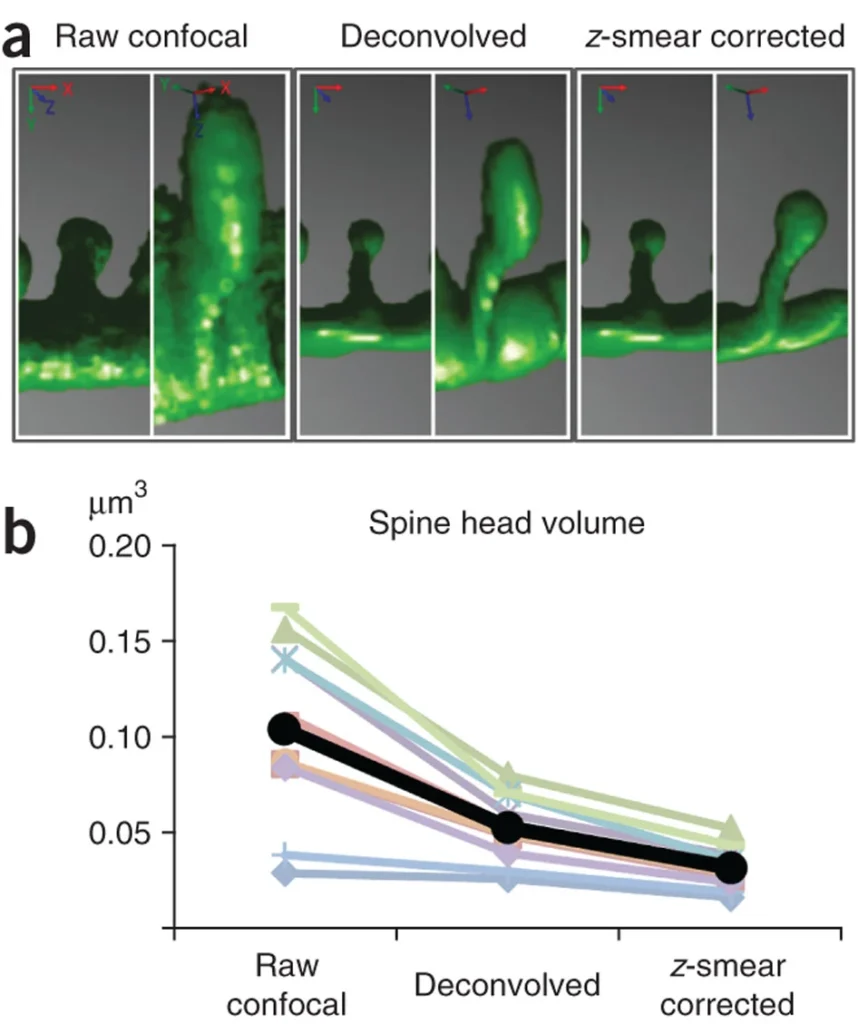
(a)デコンボリューション後およびz-スミア補正後の、生の共焦点画像における樹状突起棘の側面像と軸方向像。デコンボリューションは横方向と軸方向の解像度を向上させるが、Z-スミア補正は最適なデコンボリューションを行った後でも残っている軸方向の歪みのみを対象としている。(b)10個の棘(様々な色)とそのグループ平均(黒線)について、3D解像度の2段階改善をプロットしたもの。デコンボリューションによって体積が49%減少し、z-smear補正によってさらに40%改善した(paired t test, P < 0.001 for each step)。別の言い方をすれば、生の共焦点スタックの棘は、平均して実際の体積より226%大きい(ここに示した10個の棘の範囲は77~294%)。
〇背景
この研究は、樹状突起スパインが成人期を通じて高い運動性を保持していることを示している。そのサイズ、形、数は多様な刺激に反応して変化する。これには、学習や感覚の豊かさの変化、さまざまな疾患モデルでの変化が含まれる。これらの変化は神経シナプスの機能と可塑性に影響を与え、神経の健康と疾患の理解に不可欠である。
〇実験方法
マイクロインジェクションを使用して特定のニューロンに蛍光色素を導入し、その後、高解像度共焦点顕微鏡と画像処理技術を駆使して、樹状突起スパインの形態を詳細に分析する。データはNeuronStudioソフトウェアを用いて、自動的にスパインの密度や形態を定量化する。このプロセスには、細胞特異的な詳細な解析が可能な高度な画像処理技術が含まれている。
〇実験結果
使用された技術により、加齢や病理状態における樹状突起スパインのサイズや数の変化を高精度に捉えることが可能であった。特に、加齢に伴う薄いスパインの選択的な損失と、残存する薄いスパインが若年時のそれよりも大きくなる傾向があり、これが認知状態と高度に相関していることが明らかにされた。
〇Discussion
このプロトコルは、既存の手法よりも迅速かつ詳細なデータを提供することが可能で、特に3Dでのスパインの形態を正確に捉えることができる。これにより、樹状突起スパインの微細な変化を時間の経過とともに追跡し、神経疾患の発症や進行のメカニズムを解明する手がかりを提供する。
〇新規性と応用
この研究の新規性は、従来の透過型電子顕微鏡技術と比較して、マイクロインジェクションと共焦点顕微鏡を組み合わせることで得られる高速かつ高精度な3D画像取得能力にある。これにより、生きた細胞での迅速な画像取得と解析が可能となり、研究の効率と精度が大幅に向上する。このプロトコルは、基礎的な神経科学研究だけでなく、神経疾患の診断や治療法の開発においても大きな可能性を持っている。特定の疾患状態における樹状突起スパインの変化を詳細に分析することで、新たなバイオマーカーや治療ターゲットの同定に寄与することが期待される。
〇本研究の限界
この技術の主な制限は、シナプスの有無を直接確認できないことである。ただし、樹状突起スパインの量と特性は神経回路の機能に密接に関連しているため、このプロトコルは重要な洞察を提供する。
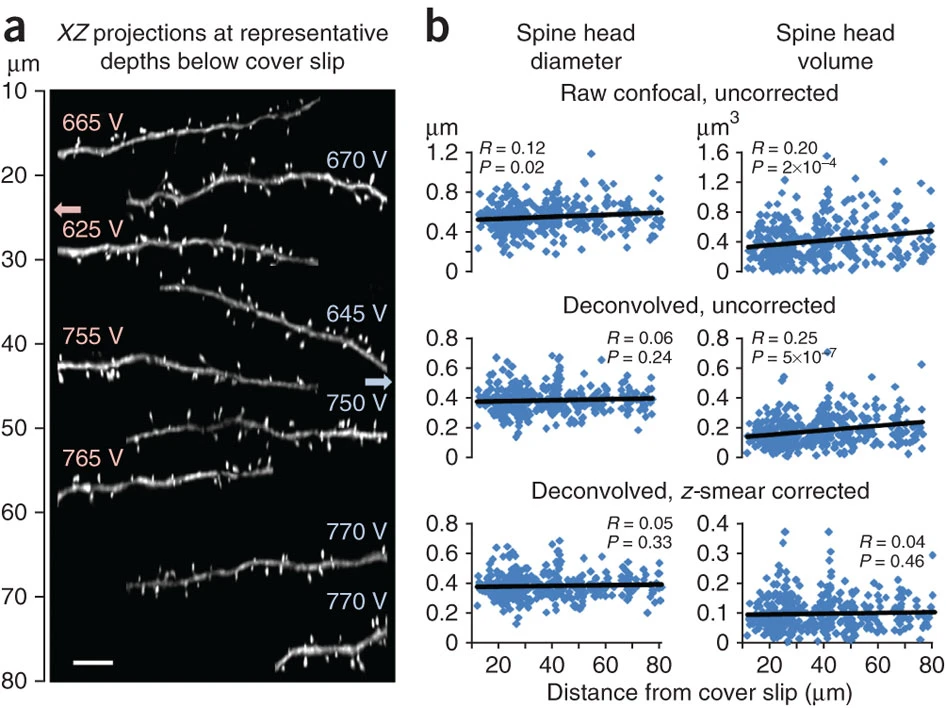
(a)ルシファーイエローを注入した2個のサル前頭前野III層細胞のソーマから60-120μmに位置する17個の基底樹状突起を、焦点深度を変えて撮像した。図は、カバースリップから解剖学的に正しい深さに配置した、デコンボリューション後の神経突起のサブセットのXZビューである。矢印は各細胞の神経突起の位置と焦点深度を示す。各樹状突起の横の数字は、フルダイナミックレンジで撮像するのに必要なゲインを表す。焦点深度が約80μmを超えると、強度が低下するため、800V以上のゲインが必要となり、画質が悪くなるため、撮像を継続することは不可能であった。スケールバーは5μm。(b)棘頭径と棘頭体積のNeuronStudioによる完全自動定量化は、生の共焦点Zスタック(上)、デコンボリューションしたZスタック(中)、デコンボリューションしたZスタックにz-smear補正をかけたもの(下)で、同じ約400個の棘に対して行った。焦点深度の関数としてのぼかし効果を評価するために、ピアソンの相関を使用した。球面収差は、生画像の2Dおよび3D解像度の両方に大きな影響を与える(上)。デコンボリューションは2D解像力への影響を補正できるが、3D解像力への影響は補正できない(中)。しかし、z-スミア補正により、3D解像度にまで補正が及ぶ(下)。すべての相関を各細胞のスパインに対して個別に実行したところ、非常によく似た結果が得られた(データは示していない)。したがって、われわれのシステムと準備では、またわれわれのポストホック解析技術を用いれば、少なくとも焦点深度80μmまでは球面収差の影響を無視できる。
