Cell Rep. 2023 Dec 26;42(12):113574. doi: 10.1016/j.celrep.2023.113574. Epub 2023 Dec 14.
Microglia promote remyelination independent of their role in clearing myelin debris (ミクログリアはミエリンの残骸を除去する役割とは独立に再ミエリン化を促進する)
Charbel S Baaklini 1, Madelene F S Ho 1, Tristan Lange 1, Brady P Hammond 1, Sharmistha P Panda 1, Martin Zirngibl 1, Sameera Zia 1, Kassandre Himmelsbach 1, Heli Rana 1, Braxton Phillips 1, Daria Antoszko 1, Jeremies Ibanga 1, Mizuki Lopez 1, Kelly V Lee 1, Michael B Keough 2, Andrew V Caprariello 3, Bradley J Kerr 4, Jason R Plemel 5
1Neuroscience and Mental Health Institute, University of Alberta, Edmonton, AB T6G 2R3, Canada2Division of Neurosurgery, Department of Surgery, University of Alberta, Edmonton, AB T6G 2R3, Canada3Department of Clinical Neurosciences, Hotchkiss Brain Institute, University of Calgary, Cumming School of Medicine, Calgary, AB T2N 1N4, Canada4Department of Anesthesiology & Pain Medicine, University of Alberta, Edmonton, AB T6G 2R3, Canada5Department of Medical Microbiology and Immunology, University of Alberta, Edmonton, AB T6G 2R3, Canada6Department of Medicine, Division of Neurology, University of Alberta, Edmonton, AB T6G 2R3, Canada
Received 18 May 2023, Revised 17 October 2023, Accepted 27 November 2023, Available online 14 December 2023, Version of Record 14 December 2023.
Highlights
- •Microglia and monocyte-derived macrophages engulf equal volumes of myelin debris
- •Macrophages compensate to remove myelin debris when microglia are depleted
- •Microglia facilitate oligodendrocyte progenitor cell proliferation
- •Microglia promote oligodendrocyte differentiation and remyelination
ハイライト
・ミクログリアと単球由来マクロファージは同量のミエリン残骸を取り込む
・ミクログリアが枯渇すると、マクロファージがミエリンの残骸を除去する。
・ミクログリアはオリゴデンドロサイト前駆細胞の増殖を促進する。
・ミクログリアはオリゴデンドロサイトの分化と再ミエリン化を促進する。
Summary
Multiple sclerosis (MS) is an inflammatory disease characterized by myelin loss. While therapies exist to slow MS progression, no treatment currently exists for remyelination. Remyelination, linked to reduced disability in MS, relies on microglia and monocyte-derived macrophages (MDMs). This study aims to understand the role of microglia during remyelination by lineage tracing and depleting them. Microglial lineage tracing reveals that both microglia and MDMs initially accumulate, but microglia later dominate the lesion. Microglia and MDMs engulf equal amounts of inhibitory myelin debris, but after microglial depletion, MDMs compensate by engulfing more myelin debris. Microglial depletion does, however, reduce the recruitment and proliferation of oligodendrocyte progenitor cells (OPCs) and impairs their subsequent differentiation and remyelination. These findings underscore the essential role of microglia during remyelination and offer insights for enhancing this process by understanding microglial regulation of remyelination.
多発性硬化症(MS)は、ミエリン(髄鞘)の消失を特徴とする炎症性疾患である。MSの進行を遅らせる治療法は存在するが、再ミエリン化に対する治療法は現在のところ存在しない。MSの障害軽減につながる再髄鞘化は、ミクログリアと単球由来マクロファージ(MDM)に依存している。本研究では、ミクログリアの系統追跡と枯渇を行い、再髄鞘化におけるミクログリアの役割を理解することを目的とした。ミクログリアの系譜追跡から、ミクログリアとMDMの両方が初期には集積するが、後にミクログリアが病変を支配することが明らかになった。ミクログリアとMDMは同量の抑制性ミエリン残屑を取り込むが、ミクログリアが枯渇すると、MDMはより多くのミエリン残屑を取り込んで補う。しかしミクログリアの枯渇は、オリゴデンドロサイト前駆細胞(OPC)のリクルートと増殖を減少させ、その後の分化と再ミエリン化を阻害する。これらの知見は、再髄鞘形成におけるミクログリアの重要な役割を強調するものであり、再髄鞘形成におけるミクログリアの制御を理解することによって、再髄鞘形成プロセスを促進するための洞察を与えるものである。
Keywords
microglia, monocyte-derived macrophages, oligodendrocyte progenitor cell, oligodendrocyte
remyelination, lysophosphatidylcholine, myelin debris, phagocytosis, proliferation, differentiation
7dd9254e5794f353e46e948b8d7ec515Introduction
ミエリンの喪失、すなわち脱髄は、脊髄損傷1,2,3、多発性硬化症(MS)4,5、脳卒中6,7、外傷性脳損傷8,9などの後に起こる。白質の喪失は、アルツハイマー病10,11,12,13,14でも起こり、認知機能の低下と相関する老化の特徴でもある。脱髄は軸索の伝導を阻害するため、再ミエリン化はこの障害を回復させると考えられている20,21,22,23。再ミエリン化はまた、軸索を変性から免れるため、軸索の喪失に伴う永続的な障害を防ぐ。
再ミエリン化には、オリゴデンドロサイト前駆細胞(OPC)のリクルートと増殖、その後の分化、ミエリン鞘の再生の両方が関与している。ミエリンの残骸は、培養ではオリゴデンドロサイトの成熟を阻害し34 、in vivoでは再髄鞘化を阻害する35 。ミエリンの残骸のクリアランスは、再髄鞘化の重要な律速段階であると考えられており、ミエリンの残骸のクリアランスは加齢とともに遅くなる26,36,37,38 。
例えば、ミクログリアはin vitroでOPCの増殖を刺激することができ、ミクログリア/MDMはオリゴデンドロサイトの分化を促進するアクチビンなどの因子を分泌することができる。脱髄後、ミクログリアとMDMを減少させると、再ミエリン化が制限される40,41,43,44。このことは、ミクログリアとMDMが再ミエリン化の重要な要素であることを示唆している。重要なことは、再髄鞘化に対する細胞タイプ特異的な寄与を理解することで、選択的で標的を絞った再髄鞘化促進治療が可能になるということである。しかしながら、再髄鞘化を促進する過程が主にミクログリアに起因するのか、それとも浸潤性MDMに起因するのかはまだ不明である。
再髄鞘化におけるミクログリアの機能を理解するための効果的な戦略は、脱髄を誘導した後にミクログリアを枯渇させることである。リゾホスファチジルコリン(LPC)誘発脱髄モデルにおいて、塩化ガドリニウムを用いたミクログリアおよび/またはMDMの枯渇はOPCの増殖を減少させる40。また、マウス肝炎ウイルスまたはキュプリゾン誘発脱髄後、CSF1Rアンタゴニストを介したミクログリアの枯渇はオリゴデンドロサイトの蓄積を減少させる43,44。対照的に、キュプリゾン誘発慢性脱髄の後では、CSF1R拮抗作用はオリゴデンドロサイトの蓄積を促進する45,46,47。ミクログリア枯渇研究にCSF1R拮抗薬を用いることの限界の一つは、これらの薬剤がMDMsの転写状態を変化させるなど、標的外効果を持つ可能性があることである48。
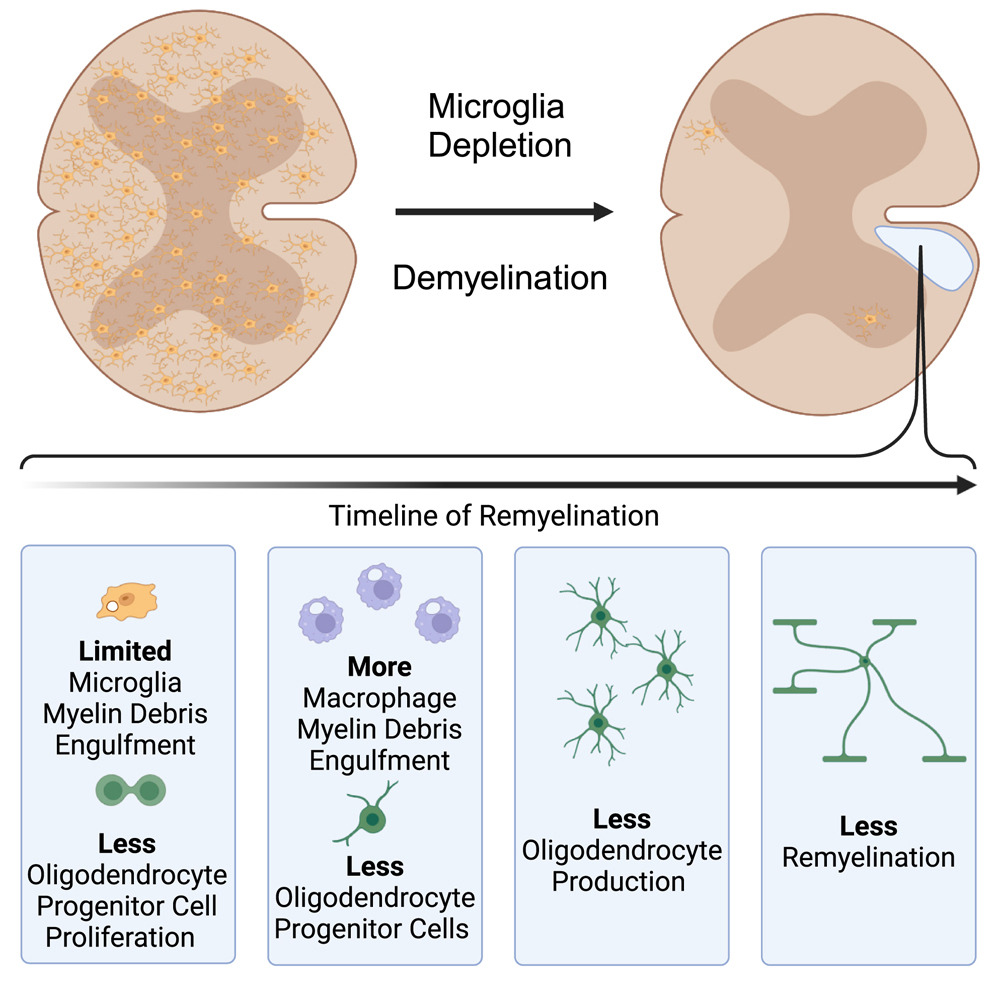
そこで本研究では、ミクログリア系譜追跡法を用いてミクログリアを標識し、LPC誘発脱髄後の再ミエリン化過程におけるミクログリアとMDMを比較した。その結果、初期にはミクログリアもMDMもほぼ同数で反応し、同量のミエリン残骸を取り込むことがわかった。その後、再髄鞘化の際にはミクログリアが病変部を独占した。再髄鞘化におけるミクログリアの寄与を理解するために、我々は遺伝子戦略を使ってミクログリアにジフテリア毒素受容体(DTR)を挿入し、再髄鞘化中のミクログリアを枯渇させるためにこれらの動物をジフテリア毒素(DT)で処理した。ミクログリアの枯渇は、ミエリン残骸のクリアランスには変化を及ぼさなかったが、ミクログリアがOPCの増殖とリクルート、その後の分化と再ミエリン化に寄与していることが明らかになった。これらの知見は、ミクログリアがミエリンの残骸を除去する役割とは別のメカニズムで再ミエリン化を促進することを示唆している。
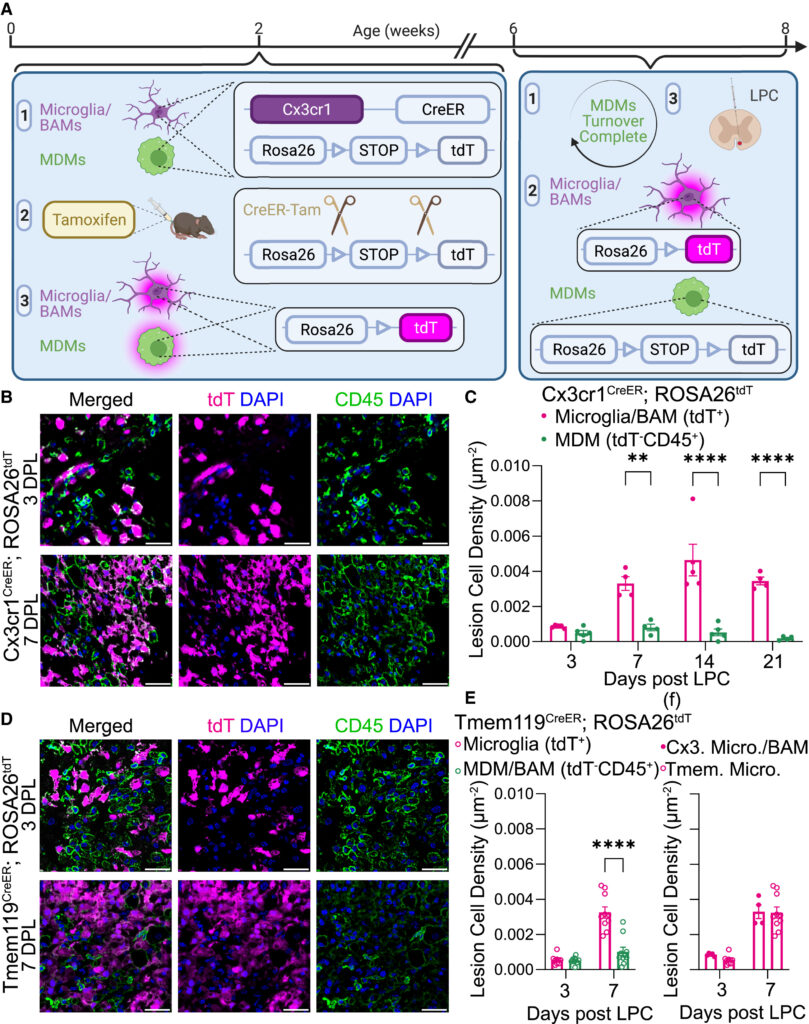
(A)CX3CR1CreER;ROSA26tdTマウスにおける系統追跡戦略の概略図。
(B)6~8週齢のCx3cr1CreER; ROSA26tdTマウスのLPC誘発脊髄病変におけるミクログリア/BAM(tdT+DAPI+)およびMDM(tdT-CD45+DAPI+)の代表的免疫蛍光像(3, 7 DPL)。スケールバー: 30 μm。
(C)6~8週齢のCx3cr1CreER; ROSA26tdTマウスのLPC誘発脊髄病変におけるミクログリア/BAM(tdT+DAPI+)およびMDM(tdT-CD45+DAPI+)密度の定量; ROSA26tdTマウス(3DPL、雌マウス数[nF]=2、雄マウス数[nM]=3;7DPL、nF=4;14DPL、nF=4、nM=1;21DPL、nF=4)。シダックの多重比較検定による二元配置分散分析。
(D)6-8週齢のTmem119CreER; ROSA26tdTマウス(3, 7 DPL)のLPC誘発脊髄病変におけるミクログリア(tdT+DAPI+)およびMDMs/BAMs(tdT-CD45+DAPI+)の代表的免疫蛍光像。スケールバー 30 μm。
(E)6~8週齢のTmem119CreER;ROSA26tdTマウス(3DPL、nM=9;7DPL、nF=10)のLPC誘導脊髄病変におけるミクログリア(tdT+DAPI+)およびMDM/BAM(tdT-CD45+DAPI+)密度の定量化。シダックの多重比較検定による二元配置分散分析。
(F)6~8週齢のCx3cr1CreER; ROSA26tdTマウス(3 DPL, n = 5; 7 DPL, n = 4)および6~8週齢のTmem119CreER; ROSA26tdTマウス(3 DPL, nM = 9; 7 DPL, nF = 10)のLPC誘発脊髄病変におけるミクログリア(tdT+DAPI+)密度。二元配置分散分析(Sidakの多重比較検定付き)。
平均値±SEM、**p<0.01、**p<0.0001。tdT、tdTomato;BAM、border-associated macrophage;MDM、monocyte-derived macrophage;LPC、lysophosphatidylcholine;DPL、(LPC後数日)。
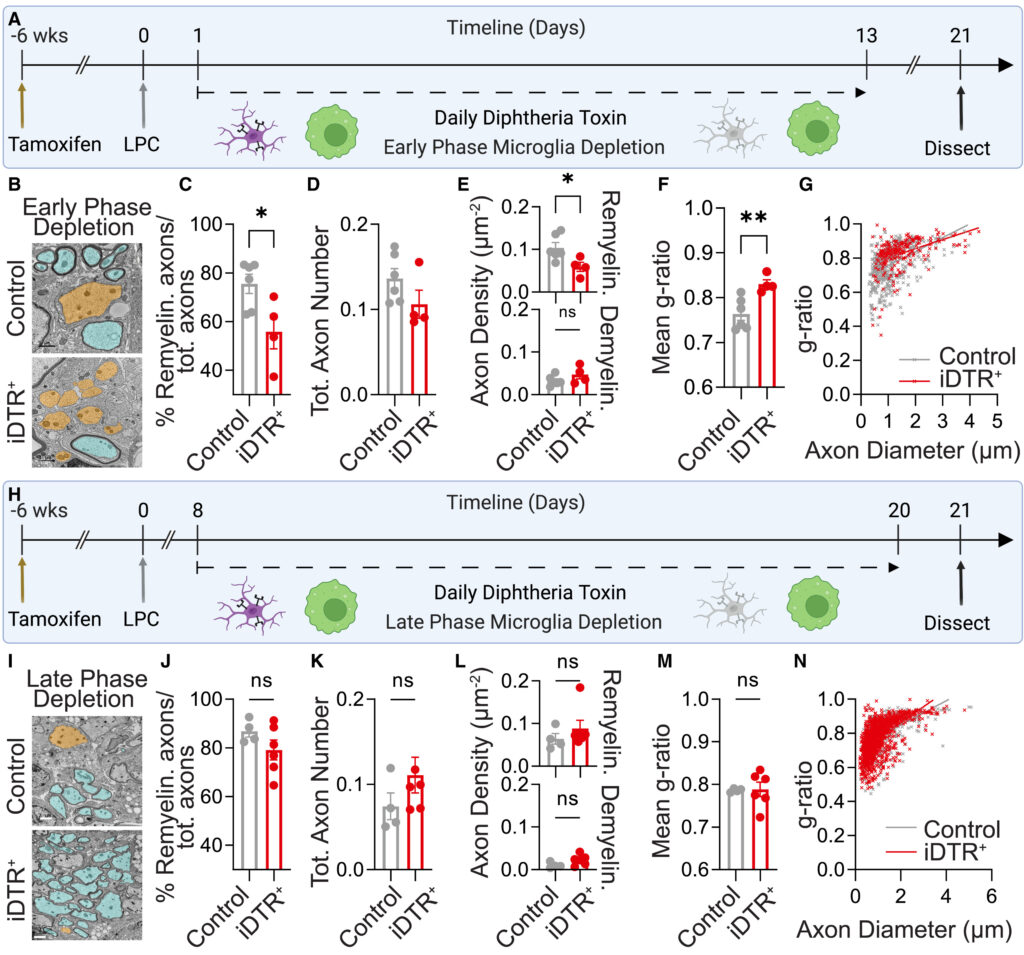
(B)6~8週齢のコントロールマウスおよびiDTR+マウス(初期ミクログリア枯渇、21DPL)のLPC誘発脊髄病変における脱髄軸索(オレンジ色)および再髄鞘軸索(シアン色)を擬似カラー標識した代表的電子顕微鏡写真。スケールバー 1 μm。
(C-G)コントロールマウス(21 DPL、nF = 3、nM = 3)およびiDTR+マウス(21 DPL、nF = 2、nM = 2)のLPC誘導病変における定量。両側対応のないt検定(C-F)。
(C)再髄鞘化した軸索の割合を全軸索で割ったもの。
(D)総軸索数。
(E)再髄鞘化軸索(上)と脱髄軸索(下)の密度。
(F)再髄鞘化軸索の平均g比。
(G) 再髄鞘化した軸索の直径に対するg比のプロット。
(H)CX3CR1CreER+/-;ROSA26tdT/-(コントロール)およびCX3CR1CreER+/-;ROSA26iDTR/-(iDTR+)マウスにおけるタモキシフェン、LPCおよびDT(8DPL)投与タイムラインの概略図。
(I) 6-8週齢のコントロールマウスおよびiDTR+マウス(後期ミクログリア枯渇、21DPL)のLPC誘発脊髄病変における脱髄軸索(オレンジ色)および再髄鞘軸索(シアン色)を擬似カラー標識した代表的電子顕微鏡写真。スケールバー:2μm。
(J-N) コントロールマウス(21 DPL、nF = 2、nM = 2)およびiDTR+マウス(21 DPL、nF = 2、nM = 4)のLPC誘導病変における定量。両側対応のないt検定(J-M)。
(J)再髄鞘化軸索の割合を全軸索で割ったもの。
(K)総軸索数。
(L)再髄鞘化軸索密度(上)と脱髄軸索密度(下)。
(M) 再脱髄軸索の平均g比。
(N) 再髄鞘化した軸索の直径に対するg比のプロット。
平均値±SEM、*p < 0.05、**p < 0.01。
Discussion
ミクログリアとMDMは再髄鞘化を促進するが、このプロセスをどのように制御するかについては異なる可能性がある。ここでは、再髄鞘形成におけるミクログリアの関与の程度を定量化した。再髄鞘化の初期段階では、ミクログリアとMDMが同程度の密度で集積するが、この初期集積の後、ミクログリアが拡大して病変部を独占することが、我々の系統追跡戦略によって確認された。ミエリン残屑の飲み込みは、再髄鞘化の重要な律速段階であるため38,49,50,73,74、ミクログリアとMDMが同量のミエリン残屑を飲み込むことがわかった。再髄鞘化におけるミクログリアの重要性を理解するために、われわれはミクログリアを特異的に減少させる遺伝子戦略を用いた。その結果、ミクログリアの枯渇はMDMの代償反応を刺激し、ミエリン残骸の取り込みには変化がないことがわかった。その後、ミクログリアを枯渇させると、OPCの増殖、脱髄病巣への動員、その後の分化が減少することがわかった。初期にミクログリアを枯渇させると、再髄鞘化が抑制されることから、初期のミクログリア応答が再髄鞘化に適した環境を促進することが示唆された。ミクログリアとMDMsはともにミエリンの残骸を除去するが、ミクログリアは再髄鞘化を促進する別の役割も持っている。
ミクログリア非存在下でのOPC分化の低下と関連して、ミクログリアもまた再髄鞘化を促進した。再髄鞘化には、軸索と新しく分化したオリゴデンドロサイトの両者を安定化させる過程での軸索の鞘化98が関与している。皮質灰白質では、OPCはミエリン鞘を産生するか死滅するかのどちらかによって、数日以内に分化し安定化する。可能性としては、分化するオリゴデンドロサイトのプールを拡大すれば、より多くの軸索を鞘に収めるのに十分である。しかし、別の可能性としては、ミクログリアがオリゴデンドロサイトによる軸索鞘化を促進する因子を分泌していることが考えられる。重要なことは、ミクログリアの減少を1週間遅らせても、再髄鞘形成に変化がないことである。したがって、ミクログリアは、再髄鞘化オリゴデンドロサイトのプールを拡大するために、OPCの遊走、増殖、分化をサポートしている可能性が高い。
