Front Neurol. 2023 Nov 16:14:1284304. doi: 10.3389/fneur.2023.1284304. eCollection 2023.
Advances in the study of IL-17 in neurological diseases and mental disorders (神経疾患および精神障害におけるIL-17の研究進展)
Yu Lu 1, Piaopiao Zhang 2, Fenfen Xu 2, Yuan Zheng 2, Hongyang Zhao 2
- 1Department of Pediatrics, Jinan Central Hospital, Shandong University, Jinan, China
- 2Department of Pediatrics, Central Hospital Affiliated to Shandong First Medical University, Jinan, China
Abstract
Interleukin-17 (IL-17), a cytokine characteristically secreted by T helper 17 (Th17) cells, has attracted increasing attention in recent years because of its importance in the pathogenesis of many autoimmune or chronic inflammatory diseases. Recent studies have shown that neurological diseases and mental disorders are closely related to immune function, and varying degrees of immune dysregulation may disrupt normal expression of immune molecules at critical stages of neural development. Starting from relevant mechanisms affecting immune regulation, this article reviews the research progress of IL-17 in a selected group of neurological diseases and mental disorders (autism spectrum disorder, Alzheimer’s disease, epilepsy, and depression) from the perspective of neuroinflammation and the microbiota-gut-brain axis, summarizes the commonalities, and provides a prospective outlook of target application in disease treatment.
インターロイキン-17(IL-17)は、Tヘルパー17(Th17)細胞によって特徴的に分泌されるサイトカインであり、多くの自己免疫疾患や慢性炎症性疾患の病因におけるその重要性から、近年ますます注目を集めている。最近の研究では、神経疾患や精神障害は免疫機能と密接な関係があり、程度の差こそあれ、免疫調節異常が神経発達の重要な段階において免疫分子の正常な発現を乱す可能性があることが示されている。本稿では、免疫制御に影響を及ぼす関連メカニズムから出発して、神経炎症および微生物叢-腸-脳軸の観点から、神経疾患および精神疾患(自閉症スペクトラム障害、アルツハイマー病、てんかん、うつ病)の選択されたグループにおけるIL-17の研究進展を概説し、共通点をまとめ、疾患治療における標的適用の展望を提供する。
Keywords: IL-17; mental disorders; microbiota-gut-brain axis; neuroinflammation; neurological diseases.
【要旨】 IL-17はTヘルパー17細胞によって分泌されるサイトカインであり、自己免疫疾患や慢性炎症性疾患の病態形成において重要な役割を果たしている。このレビューでは、神経疾患および精神障害におけるIL-17の役割を、神経炎症と腸内細菌叢・腸脳軸の観点から検討し、共通点をまとめている。特に、自閉症スペクトラム障害(ASD)、アルツハイマー病(AD)、てんかん、うつ病においてIL-17が関与するメカニズムについて詳述している。
【背景】 IL-17A(IL-17とも呼ばれる)は、Th17細胞によって分泌される代表的なサイトカインである。神経疾患や精神障害の病態形成において、自己免疫や炎症性の損傷と関連している。神経炎症は中枢神経系(CNS)内の炎症反応を指し、感染、外傷、虚血などによって引き起こされることがある。腸内細菌叢の機能は、神経発達や社会行動に影響を及ぼすことが明らかになっている。
【方法】 本論文では、IL-17の生物学的特性、シグナル伝達経路、神経炎症および腸内細菌叢・腸脳軸との関連について概説している。IL-17は、構造上他のサイトカインとは異なる特徴を持ち、Th17細胞以外にも様々なリンパ球や神経系の細胞がIL-17を産生することが示されている。
【結果】 神経炎症におけるIL-17の役割は、血液脳関門(BBB)の破壊、神経細胞とグリア細胞の形態異常、シナプス可塑性の障害などを介して神経疾患や精神疾患を引き起こす可能性がある。腸内細菌叢・腸脳軸を介したIL-17の作用も、免疫活性化、微生物代謝産物の生成、神経伝達物質の影響を通じて神経発達や社会行動に影響を与えることが示されている。
【議論】 ASD、AD、てんかん、うつ病におけるIL-17の役割は、神経炎症と腸内細菌叢・腸脳軸のメカニズムを通じて、これらの疾患の発症、進行、および結果に影響を及ぼすことが示唆されている。これらの疾患においてIL-17が果たす役割の共通点についても言及されている。
【制限】 IL-17の役割に関する研究はまだ進行中であり、特に神経疾患や精神障害におけるその正確なメカニズムについては、さらなる探求が必要である。
【可能な応用】 IL-17に関連する治療法の開発は、神経疾患や精神障害の予防および治療において新たな可能性を提供する可能性がある。特に、Th17細胞およびTreg細胞のバランスを調整すること、腸内細菌叢の調整、炎症反応を調節する薬物の使用などが、将来の治療戦略として注目されている。
Introduction
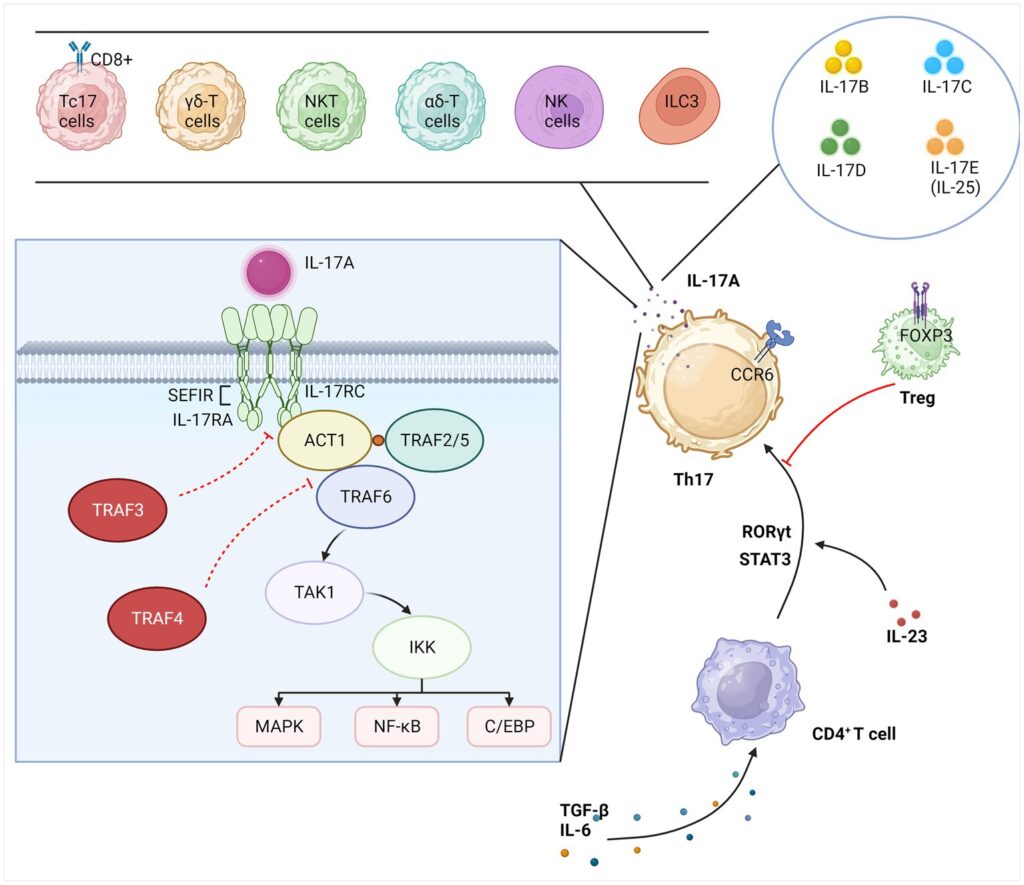
IL-17としても知られるインターロイキン-17A(IL-17A)は、Tヘルパー17(Th17)細胞から分泌される代表的なサイトカインであり、免疫恒常性の維持と免疫異常の促進に重要な役割を果たしている。現在、IL-17は免疫疾患、腫瘍疾患、および多発性硬化症(MS)、関節リウマチ、強直性脊椎炎、乾癬などの慢性炎症性疾患において研究されている。また、現代の研究では、多くの神経疾患や精神障害の病態が自己免疫疾患や炎症性傷害と密接に関係していること、また、さまざまな程度の免疫調節異常が中枢と末梢の両方に蔓延しており、神経発達の重要な段階で免疫分子の正常な発現を乱す可能性があることが示唆されている。
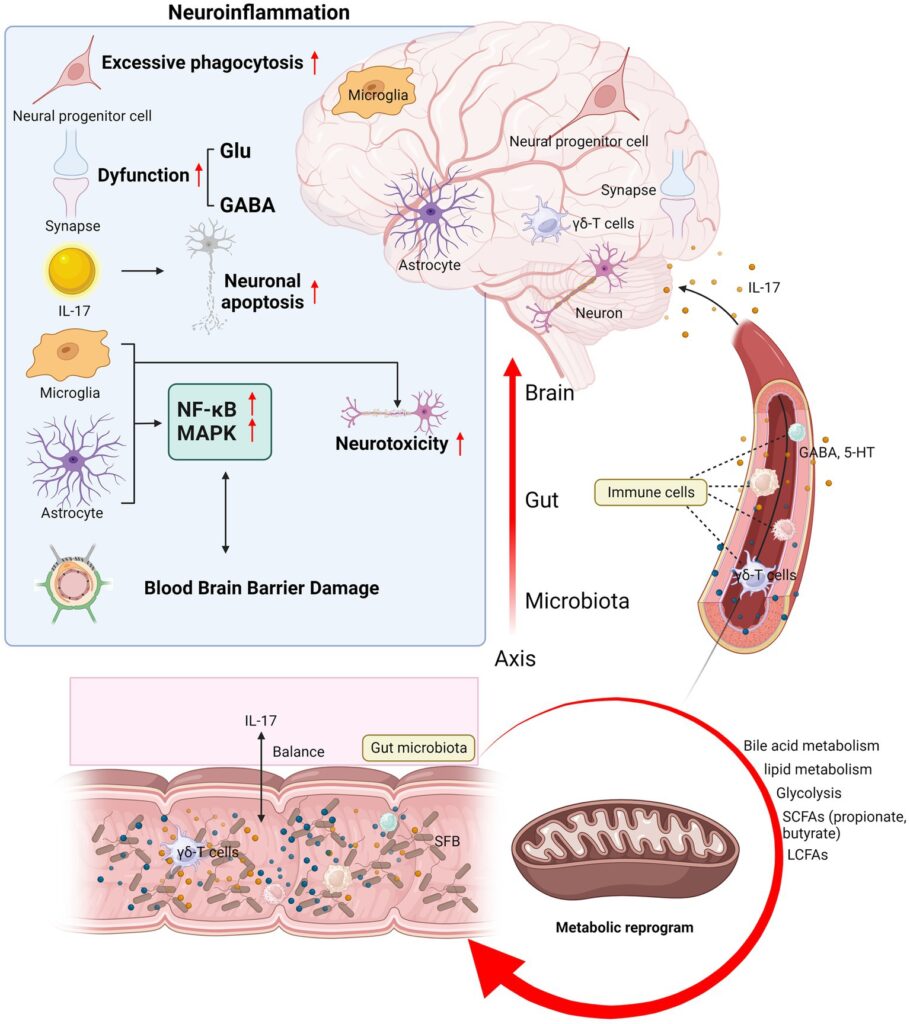
神経疾患は、世界的に死亡や身体障害の主な原因として認識されつつある。さらに、精神疾患も見過ごすことはできず、うつ病の診断が最も高い割合を占めている。近年、中枢神経系(CNS)疾患と精神障害の両方において、神経炎症と腸内微小生態系が免疫を媒介し、制御する可能性が指摘されている。神経炎症は通常、中枢神経系内の炎症反応を指し、感染、外傷、虚血、その他の病的傷害によって引き起こされる。この過程は、神経細胞死、神経新生阻害、シナプス機能障害を媒介する炎症性サイトカインの産生によって特徴づけられる。一方、グリア細胞は、迅速な免疫反応のための主要な免疫細胞として働く可能性がある。腸はもはや消化器官としてのみ考えられるものではなく、免疫系との相互作用も同様に複雑である。腸関門は、その内腔側では腸内細菌叢と、組織側では腸管ニューロンや神経膠と密接に接しており、中枢神経系の障害と密接に関連している。本総説では、自閉症スペクトラム障害(ASD)、アルツハイマー病(AD)、てんかん、うつ病などの神経疾患および精神疾患群を選んだ。関連する総説を読み、多数の基礎的および臨床的研究を要約することによって、IL-17に関する現在の研究は、いくつかの神経疾患および精神疾患においてより広範かつ包括的に解明されているが、IL-17に関するこれまでの研究は、ほとんどが神経炎症作用などのメカニズムに限定されていたのとは異なり、本総説ではさらに、微生物叢-腸-脳軸を新たな視点として採用し、IL-17が生理学的および病理学的状況において免疫系に直接的または間接的にどのように影響を及ぼすかを議論する。選択した神経疾患および精神疾患群の中で、IL-17と各疾患との間の単線的な関連を単純に分析するのではなく、むしろ4つの疾患の神経炎症および微生物叢-腸-脳軸経路を相互作用的に分析し、それらにおけるIL-17の作用の共通性を明らかにした。IL-17に関連するメカニズムを通して4つの疾患を関連づけることは、このレビューをより包括的なものとし、より効果的な疾患介入ターゲットを見出すために極めて重要である。
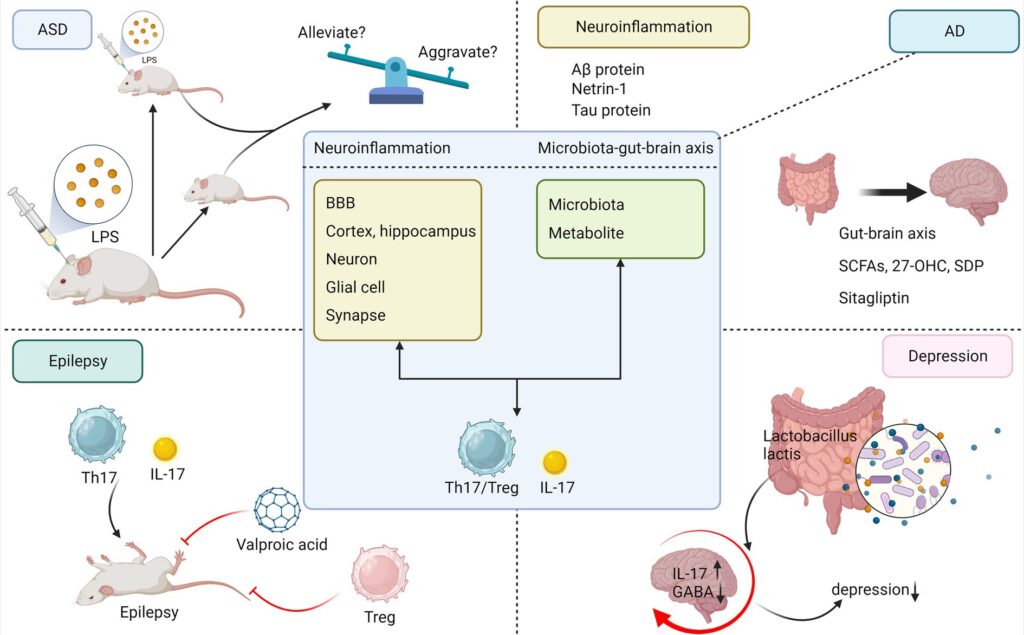
4.1 IL-17と自閉症スペクトラム障害
ASDとは、1943年にKannerが発表した症例(50)で、当初は「幼児期早期自閉症」と呼ばれていた神経発達障害の一群を指す。その中核的な症状は、社会的コミュニケーションや相互作用の困難、制限的で反復的な行動、興味、活動である(51)。Global Burden of Disease (GBD)研究では、この疾患の世界的な有病率は約0.76%で、地域差はないと初めて推定された(52)。中国では、小児を対象とした初の全国的な多施設集団ベースの横断研究が行われ、ASDの有病率は約0.70%であり、男児は女児のおよそ4倍の感受性があることが示された(53)。
ASDの病因は複雑で結論は出ていないが、遺伝子と環境が主要な役割を果たしていることが研究で示唆されている(54)。ASDの遺伝的構造は、数百から数千の稀なデノボ、バリアント遺伝子、または一般的な多遺伝子リスクから構成されている(55)。遺伝的感受性の高い個体では、多くの環境リスク因子が相乗的に作用する可能性があり、特に妊娠中の発熱性感染症は子孫のASDリスクを高める可能性がある(56)。このことは、MIAの動物モデルで観察された結果と一致しており、LPSやポリI:Cによって炎症が誘発されたマウスの子供は、過剰な不安や社会性の低下など、ASDに似た行動を示すことがある(57)。ASDにおけるIL-17の顕著な性質を裏付ける証拠が蓄積されている。発熱はTh17細胞の分化を著しく促進し、炎症能力を高めることが報告されている(58)。ASDのいくつかのげっ歯類モデルでは、子宮や腸などの臓器の血清や組織でIL-17レベルの上昇、IL-17産生Th17細胞やγδ-T細胞の増加が観察されている(59)。ASDの子どもは健常児に比べて血清IL-17レベルが高いことが証明されており、ASDの重症度はIL-17の発現レベルと強い相関がある(60)。興味深いことに、IL-17は状況によってASDにまったく異なる影響を及ぼす可能性がある。母体のIL-17は、子マウスの発達中の脳に作用して皮質の異常な表現型を誘導し、ASD様行動を促進し、MIAによる子マウスの行動異常の際には妊娠マウスに必要である(61)。ASD児のサブセットにおける発熱時のASD様行動の改善に注目した後、Reed et al. は、MIAに曝露した接合体マウスの社会的行動障害が、LPS投与によって誘導される炎症反応によって一時的に救済されること、そしてこの救済能力は、一次体性感覚皮質粒状帯(S1DZ)ニューロンにおけるIL-17RAの発現をなくすことによって失われることを新たな研究で立証し、炎症時にIL-17が成体マウスのASD様症状を改善することを示唆した(図3)(62)。この研究は、ASDの小児が発熱時に、より強く、より頻繁にネガティブな行動変化を示す一方で、ごく一部のASDの小児が発熱によってポジティブな影響を受けるという点で議論を呼ぶかもしれないが、Byrneらの臨床研究のデータによれば、これはまれなケースである(63)。
IL-17はASDにおける神経炎症を媒介する。IL-17RはASDのマウスの子孫の神経細胞、神経幹細胞、星状細胞、ミクログリア細胞、内皮細胞に発現しており、IL-17シグナルは上記の細胞への作用を通して皮質の発達を阻害し、ASDに関連した子孫の皮質形成不全や行動障害の発症につながる(64, 65)。母親の慢性IL-17は、雄マウスの子孫に持続的なASD様表現型を引き起こし、ニューロン-ニューロンシナプス経路遺伝子発現、皮質体積、神経膠密度および遺伝子発現の減少を伴い、成体雄の社会化障害は皮質のGABA作動性シナプス遺伝子発現と負の相関があることがわかった(66)。ASD児の脳組織では、アストロサイト由来の円形膜小胞がリンパ球を攻撃し、血管周囲の脳脊髄液-脳関門で多巣性損傷を媒介する細胞傷害反応を発揮している(67)。IL-17はアストロサイトを介したアミノ酸の興奮毒性を促進し(33)、シナプスのグルタミン酸レベルの上昇がASDのげっ歯類モデルやヒト患者で報告されている(68、69)。大脳皮質の発達に対するIL-17の影響を評価するために、佐々木らはIL-17をラット胎仔脳の側脳室に注入し、活性化したミクログリアとその帯状皮質への蓄積、および大脳皮質における局在の変化を観察し、ASDの脳室帯における神経前駆細胞の貪食亢進をもたらした(70)。さらに、IL-17はTNF-αによるオリゴデンドロサイト(OL)の減少を悪化させ、OL前駆細胞の分化を阻害した(71)。プロピオン酸誘発ASDモデルラットにビオチン酸マグネシウム(MgB)を投与したところ、小脳のプルキンエ細胞のサイズと密度が増加した。また、MgBは脳のIL-17を減少させ、セロトニンを増加させ、社会的行動、学習、記憶を改善した(72)。さらに、IL-17/IL-17Rシグナル伝達は、単球の酸化ストレスを介した神経炎症の増幅にも重要な役割を果たしている。このシグナル伝達は、NF-κB経路を通じて自閉症児の末梢単球における誘導性一酸化窒素合成酵素(iNOS)/ニトロチロシンの発現を増加させるので、このシグナル伝達経路を遮断することはASD児にとって有益である可能性がある(73)。つまり、IL-17はCNS内に存在する免疫細胞だけでなく、ASD患者の末梢血に存在する単球を通しても神経炎症を媒介するということである。その後、Nadeemらも好中球のIL-17とIL-17Rシグナルが他の免疫細胞と酸化的炎症反応を調整することを発見し、ASDの神経炎症メカニズムへの関与の可能性を示唆した(74)。
ASD症状の緩和における腸内細菌叢の役割とその基礎となるメカニズムについては、長年にわたって研究者の注目が高まっている。ASD患者の腸内細菌叢を無菌マウスに移植したところ、典型的なASD症状が誘発され、マウスの脳におけるASD関連遺伝子の異常発現とスプライシングの変化が認められた(75)。Kimらは、SFBまたはヒト常在細菌を投与した妊娠ラットは、経口投与により腸内でTh17細胞の分化を誘導することができ、IL-17が有意に増加し、ASD様の表現型を持つ子孫を出産する可能性が高いことを指摘した(40)。その後、研究チームはさらに、MIAで誘発されたASDの子孫ラットは、Citrobacter rodentium感染後に腸炎を起こしやすく、神経発達の表現型におけるMIAの出生前の役割とは対照的に、IL-17は、母体の腸内細菌叢を改変することによって出生後に変化したナイーブCD4+ Tクロマチンランドスケープを媒介し、子孫の免疫関連の表現型を調節することを観察した(76)。別の研究では、小腸の固有層(LP)におけるTh17細胞の分化が、サイトファーガ-フラボバクター-バクテロイデス門と関連していることが確認された(77)。腸内細菌だけでなく、GABA受容体アゴニストである5-アミノ吉草酸(5AV)やタウリンなどの代謝産物は、ASDマウスの行動異常を有意に改善し、マウスの脳の神経興奮性を調節した(75)。自閉症のBTBRマウスモデルでは、胆汁酸欠乏は、非常に特異的な細菌分類群である胆汁代謝性ビフィドバクテリウム(Bifidobacterium)属およびブラウチア(Blautia)属の相対存在量の減少と関連している(78)。細菌が産生する胆汁酸代謝産物、例えば3-oxoLCAやisoLCAは、Th17/Treg細胞のホメオスタシスを制御し、ヒトの腸管免疫ホメオスタシスに貢献している(45)。SCFAは逆に、ミクログリアの欠損を回復させることで微生物叢-腸-脳軸に影響を与え、特に酪酸はASDと強く関連している。中国のASD児の腸内微小生態を調べたところ、糞便中の酪酸産生菌の減少が認められ、この微生物叢の乱れは糞便中の酪酸レベルの低下と関連していた(79)。GM由来の代謝産物である酪酸は、IL-17の発現レベルをダウンレギュレートし(80)、興奮性/抑制性のバランスを調節することによってASDマウスの社会的行動を改善する(81)。
また、Choiらは、妊娠中のダムをIL-17Aに対する抗体(IL-17Ab)で治療すると、MIAに関連した子孫の行動異常が改善することを見出した。したがって、RORγtやTh17細胞など、古典的および非古典的なIL-17シグナル伝達経路のさまざまな関連因子が、有効な治療標的となりうる(61)。さらに、Treg細胞(CD4 + CD25 + Foxp3+)を用いた養子細胞移植(ACT)療法は、MIA誘発の炎症性免疫形質とASD様異常行動を有意に逆転させ、MIA子孫の不安表現型と社会的認識記憶を救済することが観察された(82)。腸内環境の調節も同様に重要であり、糞便微生物叢移植(FMT)や経口プロバイオティクスカプセルなどを通じて、特定のIL-17関連細菌叢、脂質代謝、神経伝達物質を調節することは、臨床への応用や大規模な治療のための新たな知見を提供するだろう。
結論
まとめると、IL-17は広く議論されている炎症性標的であり、一般的な神経疾患や精神疾患において、神経炎症と微生物叢-腸-脳軸を介した免疫調節に重要な役割を果たすことを支持する研究が増えている。臨床研究や動物実験により、IL-17がASD、AD、てんかん、うつ病にどのような影響を及ぼすかが明らかにされ始めているが、動物モデルの結果をそのままヒトに適用できるかどうかは議論の余地がある。これは、ヒトの神経系が複雑であること、腸内細菌叢とその代謝が遺伝、民族性、年齢、ライフスタイルなど無数の要因に左右されることによる。
現在、乾癬、関節リウマチ、強直性脊椎炎などの自己免疫疾患の治療薬として、あるいは第III相臨床試験まで進んだ治療薬として、IL-17を標的とした阻害剤が数多く承認されている。今後、様々な技術や研究の方向性を組み合わせることで、将来の研究に役立てることができる。これには、Th17/Treg細胞、IL-17シグナル伝達経路および関連因子、IL-17関連グリア細胞の多面的な制御が含まれ、免疫の制御における微生物叢-腸-脳軸の役割を強調することができる。さらに、健康なボランティアに由来する食生活の改善、神経伝達物質の補充、特定のプロバイオティクス、FMTなどの治療法を適応させることで、免疫と神経疾患および精神障害の治療に関する新たな展望が得られるかもしれない。
