bioRxiv. 2023 Mar 14:2023.03.13.532494. doi: 10.1101/2023.03.13.532494. Preprint
Phosphorylation of pyruvate dehydrogenase marks the inhibition of in vivo neuronal activity (ピルビン酸デヒドロゲナーゼのリン酸化はin vivoでの神経細胞活動の抑制を示す)
Dong Yang, Yu Wang, Tianbo Qi, Xi Zhang, Leyao Shen, Jingrui Ma, Zhengyuan Pang, Neeraj K Lal, Daniel B McClatchy, Kristina Wang, Yi Xie, Filip Polli, Anton Maximov, Vineet Augustine, Hollis T Cline, John R Yates, Li Ye
Department of Neuroscience and Dorris Neuroscience Center, The Scripps Research Institute, La Jolla, CA 92037, USADepartment of Molecular Medicine, The Scripps Research Institute, La Jolla, CA 92037, USA
Neuron. Published: January 23, 2024 DOI:https://doi.org/10.1016/j.neuron.2023.12.015
Phosphorylation of pyruvate dehydrogenase inversely associates with neuronal activity
Highlights
- 光遺伝学に基づく定量的プロテオミクス・スクリーニング・プラットフォームの確立
- 偏りのないスクリーニングにより、神経活動がpPDHを減少させることが同定された
- pPDHレベルはin vitroおよびin vivoの神経活動と負の相関を示す
- 神経活動の低下を追跡する新しい逆活性マーカー(IAM)としてのpPDH
Abstract
For decades, the expression of immediate early genes (IEGs) such as c- fos has been the most widely used molecular marker representing neuronal activation. However, to date, there is no equivalent surrogate available for the decrease of neuronal activity (i.e., inhibition). Here, we developed an optogenetic-based biochemical screen in which population neural activities can be controlled by light with single action potential precision, followed by unbiased phosphoproteomic profiling. We identified that the phosphorylation of pyruvate dehydrogenase (pPDH) inversely correlated with the intensity of action potential firing in primary neurons. In in vivo mouse models, monoclonal antibody-based pPDH immunostaining detected neuronal inhibition across the brain induced by a wide range of factors including general anesthesia, sensory experiences, and natural behaviors. Thus, as an in vivo marker for neuronal inhibition, pPDH can be used together with IEGs or other cell-type markers to profile and identify bi-directional neural dynamics induced by experiences or behaviors.
何十年もの間、c- fosなどの最初期遺伝子(IEG)の発現は、神経細胞の活性化を表す分子マーカーとして最も広く用いられてきた。しかし、神経細胞活動の低下(すなわち、抑制)については、現在までのところ、これに相当する代用物質がない。われわれは、光遺伝学に基づく生化学的スクリーニング法を開発し、単一活動電位の精度で集団神経活動を光で制御し、その後、リン酸化プロテオミクスプロファイリングを行った。その結果、ピルビン酸脱水素酵素(pPDH)のリン酸化が、一次ニューロンの活動電位発火強度と逆相関することが明らかになった。in vivoマウスモデルにおいて、モノクローナル抗体を用いたpPDH免疫染色により、全身麻酔、感覚体験、自由行動など、さまざまな要因によって誘発される脳全体の神経細胞抑制が検出された。このように、pPDHは神経細胞抑制のin vivoマーカーとして、IEGや他の細胞型マーカーと併用することで、経験や行動によって誘導される双方向の神経動態をプロファイリングし、同定することができる。
〇概要
本研究では、神経活動の減少を示す分子マーカーとして、ピルビン酸脱水素酵素(PDH)のリン酸化(pPDH)を特定した。神経活動の増加は一般的に即時早期遺伝子(IEGs)の発現で追跡されるが、活動の減少を示す分子マーカーはこれまで確立されていなかった。本研究では、光遺伝学に基づく生化学的スクリーニングとリン酸化プロテオミクスを用いて、pPDHが神経活動の減少と逆相関することを発見した。
〇背景
これまで、神経活動の増加はIEGsの発現で追跡されていたが、活動の減少を示す分子マーカーは確立されていなかった。本研究では、神経活動の減少を示す新たな分子マーカーを同定するための研究を行っている。
〇方法
光遺伝学に基づく生化学的スクリーニングとリン酸化プロテオミクスを用いて、神経活動の増減と相関する分子イベントを調査した。この方法により、PDHのリン酸化(pPDH)が神経活動の減少と逆相関することを発見した。
〇結果
pPDHは、培養した神経細胞や実験用マウスの脳内で、神経活動の減少と逆相関することが確認された。さらに、pPDHは一般麻酔や特定の感覚体験によって引き起こされる脳全体の神経活動の減少を検出することができた。
〇議論
pPDHは、神経活動の減少を示す新たな分子マーカーとして有用であり、これまで利用できなかった神経抑制の追跡手段を提供するだろう。この発見は、神経回路の動態を理解する上で新たな可能性を開くだろう。
〇この研究の限界
pPDHの検出は現在、死後の脳に限られており、生体内での直接的な追跡には制限がある。また、異なる脳領域や細胞タイプにおいて、pPDHのベースラインや感度が異なる可能性がある。
〇可能な応用
pPDHを用いた研究は、神経活動の減少を示す新たな手段として、特に行動や経験によって引き起こされる神経回路の動態の理解を深めることに貢献するだろう。さらに、pPDHはIEGベースのマーカーと組み合わせることで、神経活動の双方向の変化を追跡する強力なツールとなるだろう。
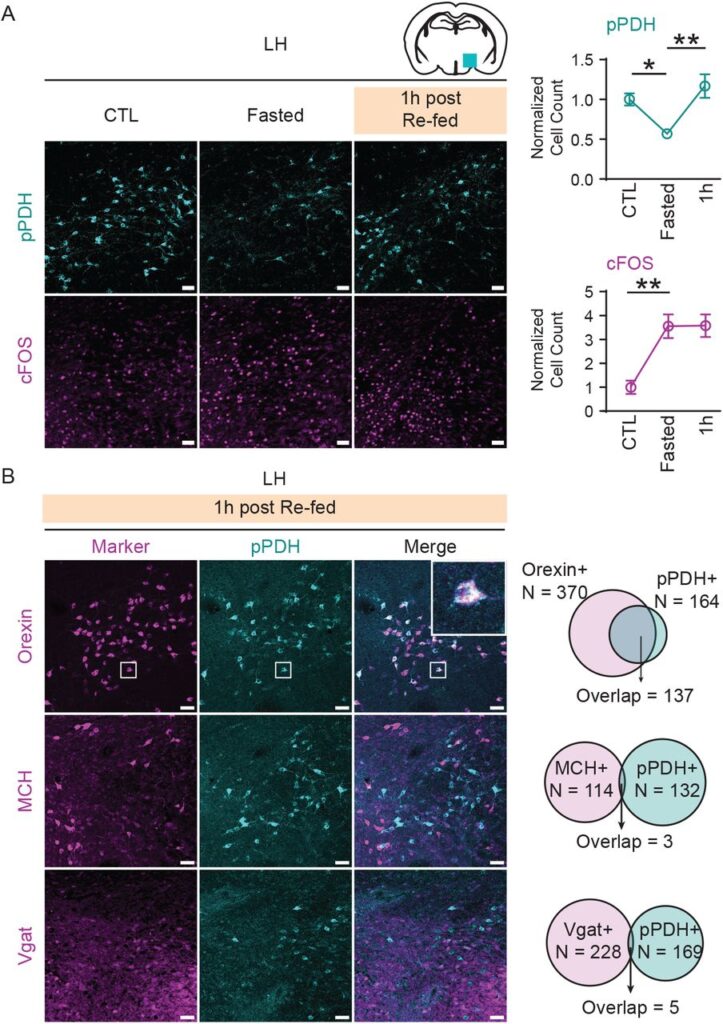
pPDHは絶食-摂食パラダイムにおけるLHの神経活動と逆相関する。(図S6も参照)
(A)LHにおけるpPDHおよびcFOS染色の代表的画像。陽性染色細胞を定量し、対照群に対して正規化した。N = 4匹/群。
(B)再給餌1時間後のLHにおけるpPDH標識と細胞型マーカーの代表的画像と定量。共標識細胞の拡大図を挿入図に示す。オレキシンおよびMCHについてはN=3マウス(オレキシンおよびMCH免疫染色による)、VgatについてはN=4マウス(Vgat-Cre: Ai9マウスを使用)。
すべての値は(A)の平均値±s.e.m.である。統計は通常の一元配置分散分析とTukeyの多重比較検定によって決定した。* p < 0.05; ** p < 0.01。
A)および(B)のスケールバーは50μm。LH:視床下部外側領域。
Discussion
神経細胞の動態には、活動の増加と減少の両方が含まれるが、長い間、追跡可能な組織学的マーカーは前者しかなかった。実際、既存の文献は神経ダイナミクスの活性化に重きが置かれており、一般に、従来のマーカーで神経細胞活動の低下をスクリーニングし、追跡することは困難であったからである。この不均衡は、回路ダイナミクスの重要な部分をプロファイリングし、追跡し、研究するための新しいツールの必要性を浮き彫りにしている。この目的のため、われわれは、神経細胞活動の抑制に近い時間スケールで調節されるPTMに着目し、神経細胞活動の逆マーカーを探索した。オプトジェネティク・アプローチを用いることで、活性化された神経細胞のリン酸化プロテオミクスを行い、神経活動と逆相関するマーカーとしてpPDHを同定することができた。
pPDHの方向性と動態は、神経細胞の発火に必要なエネルギー要件に適合しており、リン酸化によってPDHが活性化され、ピルビン酸がTCAサイクルに入って完全に酸化され、ATPが産生される。われわれの発見は、おそらくエネルギーの浪費を避けるために、活動が停止したり減少したりすると、PDHが速やかに再リン酸化されることを示唆している。このような神経細胞代謝のダイナミックな制御は、ニューロンの発火状態を探り、追跡するための分子ハンドルを与えてくれた。
我々は偏りのない方法でpPDHをIAMとして同定したが、神経細胞の活動にpPDHが関与していることを示す証拠は古くからある。このことは、pPDHが単なる傍観者的な分子事象ではなく、生化学的変化と電気的活動の間の顕著で論理的なリンクであることを強調している。
この発見は、複数の重要な意味を持つ。第一に、オプトジェネティクスを介したプロテオミクス・スクリーンを初めて確立したことで、遺伝学的に定義され、光学的に制御された神経細胞活動のハイスループット・プロファイリングが可能になった。このアプローチはその後、細胞タイプ特異的、活動パターン特異的なオプトジェネティックスクリーンに拡張され、多くの応用が期待される。第二に、pPDHの同定により、抑制されたニューロンを事後的に同定するための追跡可能な内因性マーカーが得られた。抑制は記録やCa2+イメージングから容易に読み取ることができるが、FOSや他のIEG誘導体によってしばしば「捕捉」できる活性化ニューロンとは異なり、その後の分子、遺伝学、投影研究のために抑制ニューロンを追跡して単離することは依然として困難である。将来的には、pPDH染色を全脳クリアリング、イメージング、あるいはスクリーニングツールと組み合わせることで、活動の双方向の変化を理解し、神経細胞集団をより精密に研究し、確立されたパラダイムと新しいパラダイムの両方の基礎となる回路を解明する能力が大きく変わるだろう。
*本投稿にはPaper Interpreter (Japanese)を使用しました。
