Nat Commun. 2023 Sep 9;14(1):5555. doi: 10.1038/s41467-023-40982-8.
PD-L1 positive astrocytes attenuate inflammatory functions of PD-1 positive microglia in models of autoimmune neuroinflammation (自己免疫性神経炎症モデルにおいて、PD-L1陽性アストロサイトがPD-1陽性ミクログリアの炎症機能を抑制する)
Mathias Linnerbauer # 1 2, Tobias Beyer # 2, Lucy Nirschl 2, Daniel Farrenkopf 1, Lena Lößlein 1, Oliver Vandrey 1, Anne Peter 1, Thanos Tsaktanis 1 2, Hania Kebir 3, David Laplaud 4, Rupert Oellinger 5 6, Thomas Engleitner 5 6, Jorge Ivan Alvarez 3, Roland Rad 5 6, Thomas Korn 2, Bernhard Hemmer 2, Francisco J Quintana 7 8, Veit Rothhammer 9 10
Department of Neurology, University Hospital, Friedrich-Alexander University Erlangen Nuremberg, Erlangen, Germany.
Abstract
Multiple Sclerosis (MS) is a chronic autoimmune inflammatory disorder of the central nervous system (CNS). Current therapies mainly target inflammatory processes during acute stages, but effective treatments for progressive MS are limited. In this context, astrocytes have gained increasing attention as they have the capacity to drive, but also suppress tissue-degeneration. Here we show that astrocytes upregulate the immunomodulatory checkpoint molecule PD-L1 during acute autoimmune CNS inflammation in response to aryl hydrocarbon receptor and interferon signaling. Using CRISPR-Cas9 genetic perturbation in combination with small-molecule and antibody-mediated inhibition of PD-L1 and PD-1 both in vivo and in vitro, we demonstrate that astrocytic PD-L1 and its interaction with microglial PD-1 is required for the attenuation of autoimmune CNS inflammation in acute and progressive stages in a mouse model of MS. Our findings suggest the glial PD-L1/PD-1 axis as a potential therapeutic target for both acute and progressive MS stages.
多発性硬化症(MS)は中枢神経系(CNS)の慢性自己免疫性炎症性疾患である。現在の治療法は主に急性期の炎症過程を標的としているが、進行性のMSに対する有効な治療法は限られている。このような状況において、アストロサイトは、組織の変性を促進するだけでなく、抑制する能力も持っていることから、ますます注目を集めている。ここでは、アストロサイトが、自己免疫性中枢神経系の急性炎症時に、アリル炭化水素受容体やインターフェロンシグナルに応答して、免疫調節チェックポイント分子PD-L1をアップレギュレートすることを示す。CRISPR-Cas9による遺伝子改変と、低分子および抗体によるPD-L1およびPD-1の阻害をin vivoおよびin vitroの両方で併用することで、アストロサイトPD-L1およびミクログリアPD-1との相互作用が、MSのマウスモデルにおける急性期および進行期の自己免疫性中枢神経系炎症の抑制に必要であることを実証した。我々の発見は、グリアPD-L1/PD-1軸が、MSの急性期と進行期の両方に対する潜在的な治療標的であることを示唆している。
PD-1/PD-L1 パスウェイとは?
PD-1(programmed cell death – 1)受容体(別名:CD279)は活性化 T 細胞の表面に発現します。一方 PD-1 のリガンドである PD-L1(別名:B7-H1、CD274)および PD-L2(別名:B7-DC、CD273)は、通常抗原提示細胞の表面上に発現します。PD-1、PD-L1 および PD-L2 は、T 細胞応答を抑制もしくは停止させる共同抑制因子として働く、免疫チェックポイント・タンパク質です。腫瘍細胞に対する免疫システムは PD-1 と PD-L1 の反応によって必要な場合のみ発動し、自己免疫疾患となることを防ぎます。
Introduction
アストロサイトは中枢神経系(CNS)において重要な役割を担っており、健康状態や疾患において多彩な機能を発揮している。神経細胞の代謝支援や血液脳関門(BBB)特性の制御5など、発生と恒常性における役割に加え、アストロサイトは炎症性障害に反応する能力を持ち、周囲の微小環境6,7,8に応じて中枢神経系の病理を促進したり抑制したりする。シングルセル手法の出現により、この機能的多様性が、環境、細胞、微生物由来の多数の手がかりに依存する異種活性化状態に関連していることが明らかになってきた。多くの研究が、反応性アストロサイトが積極的に病態形成や神経炎症事象の伝播を促進する可能性があることを実証しているが、疾患の文脈におけるアストロサイトの制御機能や組織保護機能についてはあまり知られていない。
CNSにおけるアストロサイトの存在量と戦略的な局在性に基づき、自己免疫性中枢神経系炎症において、アストロサイトはCNSに常在する様々な種類の細胞だけでなく、浸潤する細胞とも相互作用する。この相互作用はしばしば双方向的であり、免疫学的チェックポイントを介した炎症シグナル伝達カスケードの厳密な制御に関与している。これらのチェックポイントのひとつは、B7リガンドファミリーのメンバーであるプログラム細胞死1リガンド1(PD-L1;Cluster of differentiation 274;CD274としても知られる)と、その同族受容体PD-1(プログラム細胞死タンパク質1;PDCD1としても知られる)との相互作用である。PD-L1は主に抗原提示細胞(APC)によって発現されるが、PD-1はT細胞によっても発現され、PD-L1/PD-1シグナル伝達カスケードの活性化は、増殖、炎症性サイトカイン産生、アネルギー、アポトーシスなどのプロセスを調節する。
この経路は特に腫瘍性疾患の分野でよく研究されてきたが、最近、膠芽腫だけでなく、外傷性脳損傷、老化、アルツハイマー病においても、アストロサイトがPD-L1を発現する能力があることが報告された。多発性硬化症(MS)のような自己免疫性中枢神経系疾患では、自己反応性末梢免疫細胞が中枢神経系に侵入し、脱髄、軸索変性、グリオーシスを特徴とする多因子病態を引き起こす。
自己免疫性CNS炎症において、反応性アストロサイトがPD-L1を発現する能力は、細胞接触に依存するメカニズムだけでなく、独立したメカニズムによって、浸潤細胞だけでなくCNS常在細胞の病原特性を調節する可能性を提供するかもしれない。このことは、効果的な治療戦略が限られているMSの進行期において、特に重要であると考えられる。このような病期は、閉じたBBBの背後に「閉じ込められた」炎症過程と慢性炎症主導型の神経変性を特徴とする。このような観点から、進行性MSに関する最近の研究では、進行性MSの治療には、抗炎症と神経保護を組み合わせた戦略が必要であり、進行性MSの炎症と変性の両側面を抑制する必要があることが示唆されている。
ここでは、急性および慢性の自己免疫性神経炎症におけるアストロサイトによるPD-L1の時空間的発現を調べる。我々は、アストロサイトにおけるPD-L1の制御因子として、I型およびII型インターフェロン、ならびにアリール炭化水素受容体(AhR)シグナルを同定し、CRISPR-Cas9遺伝的摂動モデルを用いて、急性CNS炎症におけるアストロサイトPD-L1の関連性を示した。最後に、活性化ミクログリアは、アストロサイト由来の膜結合型PD-L1および可溶性PD-L1に反応し、炎症促進特性を制限することを示した。全体として、アストロサイトのPD-L1シグナル伝達を治療的に調節することで、自己免疫性中枢神経系炎症の急性期と進行期の両方において、浸潤細胞と中枢神経系常在細胞の炎症能力を抑制できる可能性がある。
芳香族炭化水素受容体(ほうこうぞくたんかすいそじゅようたい、英:Aryl Hydrocarbon Receptor、AhR)とはbHLH-PAS(Basic Helix-Loop-Helix-Per-Arnt-Sim)ファミリーに属する転写因子である。AhRは同ファミリーの中でも発見が最も古い分子であり、ほとんどの細胞・組織に発現が見られる。リガンドの結合により種々の遺伝子の転写活性化を引き起こすが、これまで長らくAhRの内因性リガンドは発見されていなかった。現在ではインディゴ(Indigo)やインディルビン(Indirubin)という化合物がAhRに結合して尿中に排泄されること[5]、ジオスミン(Diosmin)などの食餌性分子がAhRに対して結合能を有することがそれぞれ報告されている[6]。(Wikipedia)
Discussion
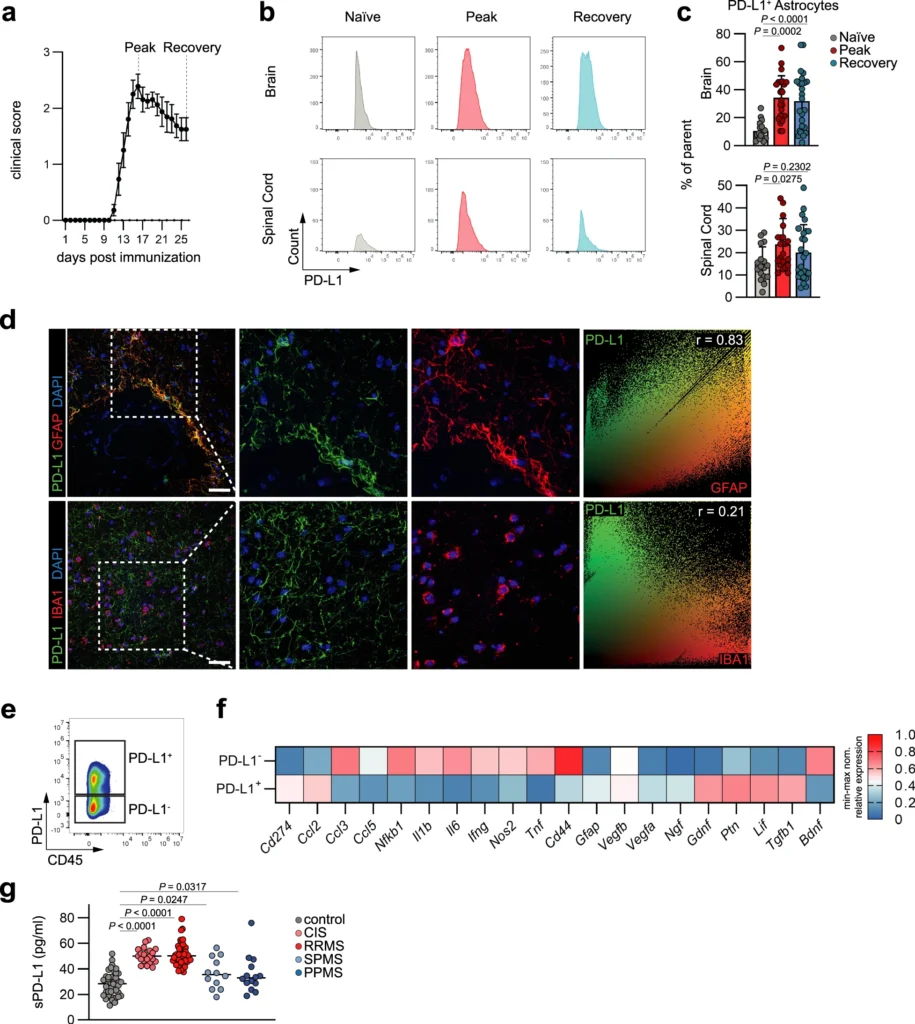
免疫チェックポイント阻害剤は、悪性細胞が免疫細胞による駆除から逃れるために制御的防御機構を利用する、腫瘍性疾患に対する現代的治療の基礎の一つである。PD-L1/PD-1軸を含む基本的なメカニズムは、T細胞とAPCのクロストークという文脈で長い間研究されてきたが、末梢だけでなく中枢神経系内の他の細胞型も、免疫学的チェックポイントを通じて炎症反応を制御する能力を持つことが次第に明らかになってきている。タウオパチー、加齢、ADを対象とした一連の研究から、PD-L1とPD-1を介した共制御シグナル伝達が、神経病理学や関連する認知障害を改善する可能性が示唆されており、CNSにおけるこのチェックポイントの関連性が強調されている。さらに新たな研究では、グリア細胞がPD-L1/PD-1シグナルを介して、この免疫調節に積極的に関与できることが示されている。この論文で筆者らは、アストロサイト由来のPD-L1が、MSやEAEの文脈における自己免疫性中枢神経系炎症の解消に重要であり、ミクログリアの炎症特性を制御していることを報告する。
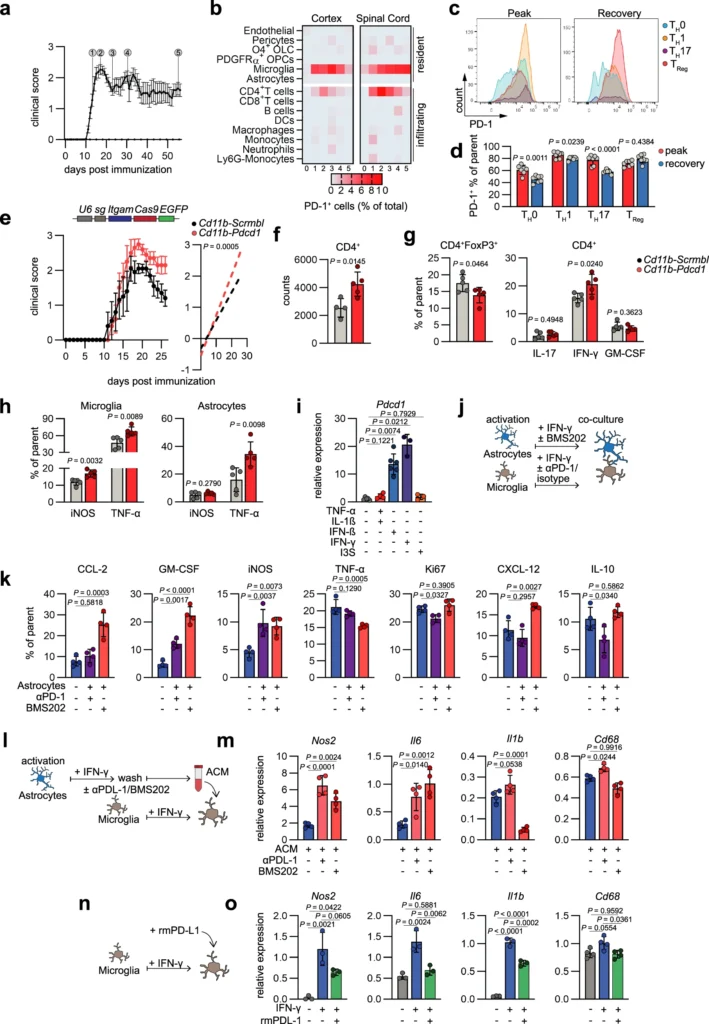
T細胞に加えて、ミクログリアによるPD-1の高発現が検出された。これは、ADや脳損傷の文脈で最近報告された観察結果である。特に中枢神経系炎症の後期にミクログリアPD-1が高発現することから、ミクログリアにおけるPdcd1の遺伝子欠損がミクログリアとアストロサイトの炎症シグナルを増加させ、EAEからの回復を制限することが示された。AD22においてミクログリアのPD-1がその貪食能に重要であることを示した最近の研究に照らせば、Cd11b-Pdcd1マウスにおける疾患の重症度の増加は、少なくとも部分的にはミクログリアによるミエリンの残骸のクリアランスが障害された結果であると考えられる。さらに我々は、アストロサイトが産生する可溶性PD-L1がミクログリアにおける炎症性シグナル伝達を抑制するのに十分であることを証明し、中枢神経系炎症におけるアストロサイトとミクログリアのクロストークの重要性を強調した。抗PD-L1抗体または低分子阻害剤BMS202によるPD-L1遮断後に観察される効果の違いは、両者のMoAが異なる結果である可能性がある。BMS202は、あらかじめ形成されたPD-L1/PD-1複合体を解離させ、PD-L1二量体の形成を誘導することで下流のシグナル伝達を阻害することが示されているが、抗体を介した遮断は、PD-L1とPD-1との結合を立体的に阻害すると考えられるからである。
まとめると、我々は、アストロサイトによるPD-L1発現を、インターフェロンとAhRシグナルによって誘導される防御的活性化状態の一部として同定した。我々は、アストロサイトPD-L1が、ミクログリアの炎症促進機能を抑制することによって、自己免疫性中枢神経系の炎症を制限することを示している。全体として、私たちの発見は、中枢神経系における急性期および後期段階の炎症を制御するアストロサイトとミクログリアの間の共制御機構を定義するものである。