Nature Communications volume 14, Article number: 7060 (2023) Article Published: 03 November 2023
Lipofuscin-like autofluorescence within microglia and its impact on studying microglial engulfment (ミクログリア内のリポフスチン様自家蛍光とそのミクログリア貪食能研究への影響)
Jacob M. Stillman, Francisco Mendes Lopes, Jing-Ping Lin, Kevin Hu, Daniel S. Reich & Dorothy P. Schafer
Department of Neurobiology, Brudnick Neuropsychiatric Research Institute, University of Massachusetts Chan Medical School, Worcester, MA, 01605, USA
Abstract
Engulfment of cellular material and proteins is a key function for microglia, a resident macrophage of the central nervous system (CNS). Among the techniques used to measure microglial engulfment, confocal light microscopy has been used the most extensively. Here, we show that autofluorescence (AF) likely due to lipofuscin (lipo-AF) and typically associated with aging, can also be detected within microglial lysosomes in the young mouse brain by light microscopy. This lipo-AF signal accumulates first within microglia and it occurs earliest in white versus gray matter. Importantly, in gray matter, lipo-AF signal can confound the interpretation of antibody-labeled synaptic material within microglia in young adult mice. We further show that there is an age-dependent accumulation of lipo-AF inside and outside of microglia, which is not affected by amyloid plaques. We finally implement a robust and cost-effective strategy to quench AF in mouse, marmoset, and human brain tissue.
Abstract
中枢神経系(CNS)に常在するマクロファージであるミクログリアにとって、細胞物質やタンパク質の貪食(engulfment)は重要な機能である。ミクログリアの貪食能を測定するために用いられている技術の中で、共焦点レーザー顕微鏡が最も広く用いられている。ここで我々は、一般に加齢に伴って増加するリポフスチンに起因すると思われる自家蛍光(リポAF)が、若いマウスの脳においても、ミクログリアライソソーム(水解小体)内で検出されることを、光学顕微鏡によって示した。このリポフスチン由来自家蛍光シグナルはミクログリア内に最初に蓄積し、白質と灰白質で最も早く発生する。重要なことは、灰白質ではリポ-AFシグナルが、若齢成体マウスのミクログリア内の抗体標識シナプス物質の解釈を混乱させる可能性があることである。われわれはさらに、ミクログリアの内外に年齢依存的なリポAFの蓄積があり、これはアミロイド斑には影響されないことを示した。最終的には、マウス、マーモセット、ヒトの脳組織において、AFを消去するための強固で費用効果の高い戦略を実現した。
リソソーム
リソソーム(lysosome; ライソソーム)は、真核生物が持つ細胞小器官の一つである。リソゾーム、ライソソーム、ライソゾームまたは水解小体(すいかいしょうたい)とも呼ばれる。語源は、“lysis(分解)”+“some(〜体)”に由来する。生体膜につつまれた構造体で細胞内消化の場である。内部に加水分解酵素を持ち、エンドサイトーシスやオートファジーによって膜内に取り込まれた生体高分子はここで加水分解される。分解された物体のうち有用なものは、細胞質に吸収される。不用物はエキソサイトーシスによって細胞外に廃棄されるか、残余小体(residual body)として細胞内に留まる。単細胞生物においては、リソソームが消化器として働いている。また植物細胞では液胞がリソソームに相当する細胞内器官である。 (Wikipedia)
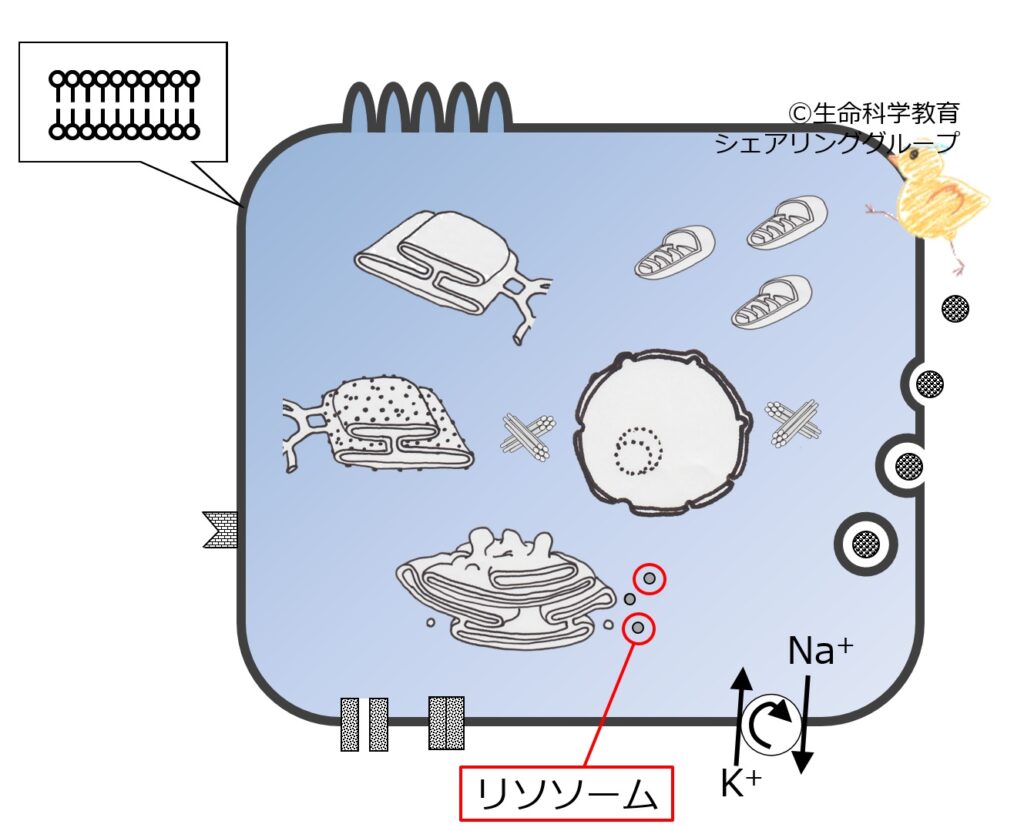
リポフスチン
リポフスチン(lipofuscin)は、細胞質内の不飽和脂肪酸の過酸化によりリソソーム内に形成される不溶性色素。リソソームによって細胞内消化された異物の残余物質であり、加齢性色素あるいは消耗性色素とも呼ばれる。(Wikipedia)
Introduction
ミクログリアは中枢神経系(CNS)に存在する貪食性の高い組織常在マクロファージである。ミクログリアの貪食活性は、歴史的には死細胞や死にかけた細胞の除去に起因してきたが、近年、ミクログリアの貪食基質のリストは拡大しており、シナプス関連分子、細胞外マトリックスタンパク質、タンパク質凝集体(アミロイドβ、タウなど)などが含まれるようになっている。 この研究から、ミクログリアによる細胞やタンパク質の取り込みが、シナプスの結合性を制御し、神経疾患の表現型を調節することが示されている。ミクログリアによる細胞内物質の取り込みはまた、アルツハイマー病から統合失調症に至る様々な疾患における治療介入の新たな標的でもある。したがって、ミクログリアによる細胞やタンパク質の基質への取り込みの解析は、極めて厳密に行うことが重要である。
共焦点光学顕微鏡は、組織や細胞におけるミクログリアの細胞内封入機能を測定するための標準的な方法となっている。これらの研究の潜在的な交絡要因は、脳組織、特に加齢に伴う自家蛍光(AF)である。組織における自家蛍光の最大の原因は、おそらくリポフスチンであろう。リポフスチンは、高度に酸化された脂質、ミスフォールディングしたタンパク質、金属の混合物であり、加齢とともにリソソームのコンパートメント内に蓄積する。これらのリポフスチン凝集体は蛍光スペクトルの全域で自己蛍光を発するため、蛍光標識した細胞や分子を光学顕微鏡で画像化することは困難である。ミクログリアでは、リポフスチンの凝集は、ミエリンの不完全な消化やリソソーム経路の破壊によって誘導される可能性があり、このことは、リポフスチン負荷の増加につながる重要なメカニズムとして、細胞物質の貪食が関与していることを示唆している。さらに、ミクログリアにおけるリポフスチンの蓄積は年齢に依存したプロセスであり、6ヶ月齢のマウスでは、リポフスチンと思われるAF陽性のミクログリアがAF陰性のミクログリアを2倍以上上回ると推定されている。しかし、最近では、リポフスチンに起因するAFが、7-9週齢のマウスでミクログリアのリソソーム内で示されている。したがって、ミクログリア内のリポフスチンが、細胞やタンパク質を取り込んだものと誤認される可能性を考慮することは重要である。
ここでは、発育中、成体、老化マウス、疾患マウスの脳を共焦点光学顕微鏡で観察し、ミクログリア内のリポフスチン(リポAFと呼ぶ)に由来すると思われるAFを評価した。我々のデータは、ミクログリアがマウス脳でリポAFを蓄積する最初の中枢神経系常在細胞であり、この蓄積は白質で最も早く起こることを示している。我々は、ミクログリア内外のリポ-AFが加齢とともに蓄積することを示した。しかし、マウス脳における神経変性中、プラークに関連したミクログリアでは、ミクログリアのリポ-AFは増加しない。また、リポ-AFを考慮しなければ、若く成熟した脳であっても、ミクログリア内に取り込まれた物質と誤解される可能性があることを示す。最後に、免疫蛍光抗体のシグナルを保持する、適応可能で費用対効果の高い前染色AF消光プロトコルを提供する。このプロトコールは、マウス、マーモセット、ヒトの脳組織など、様々な生物種に適用可能である。
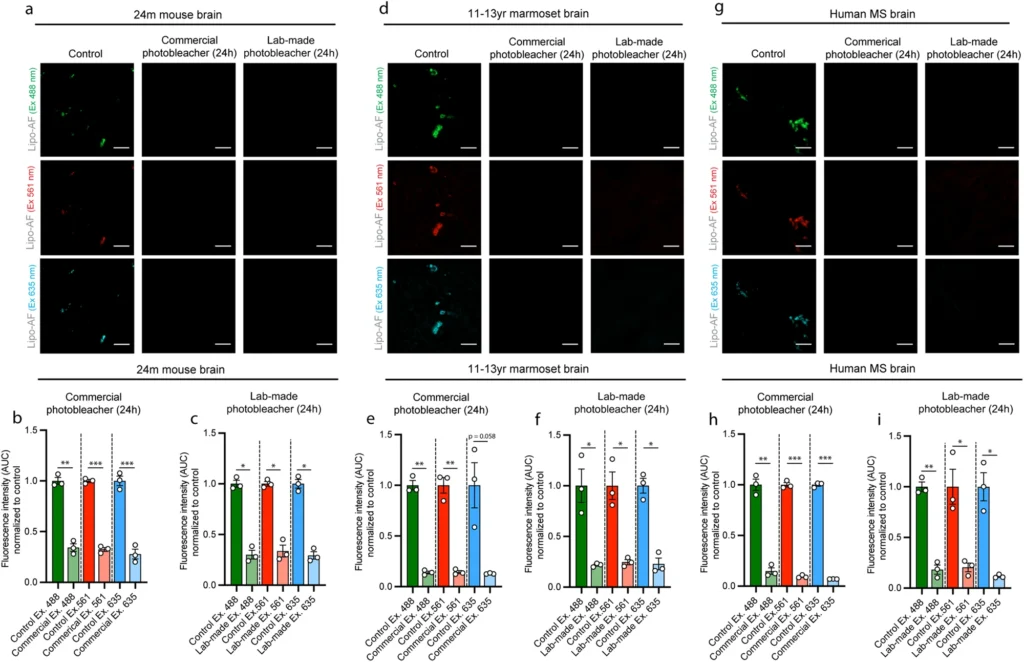
市販および自家製の光消去デバイスは、生物種を超えて自家蛍光を効果的に除去する
組織を光脱色するためにLEDベースの照明を使用する市販のMERSCOPE光脱色装置に加えて、筆者らは広く入手可能な材料に基づいて、より費用対効果の高いオプションを設計した(補足図4)。この自家製装置および市販の装置を用いると、24ヶ月齢のマウス大脳皮質において、24時間のフォトブリーチにより、すべてのレーザーラインにおけるリポ-AFが効果的に消光された(図6a-c)。次に、このプロトコルを他の生物種や固定・保存条件にも拡張した。老化したマウスの脳と同様に、ホルマリン固定、パラフィン包埋した11-13歳のマーモセット大脳皮質(図6d-f)およびFFPEした60-77歳の多発性硬化症(MS)被験者のヒト大脳皮質(図6g-i)では、24時間のフォトブリーチにより、複数の蛍光チャンネルにわたるAFからのシグナル強度が有意に減少した。これらの組織はそれぞれ、短時間(マウスでは数時間)または長時間(マーモセットとヒトでは数日間)固定されたものであることも強調しておきたい。また、保存期間も数日/数週間(マウス)から数年(マーモセットとヒト)までさまざまであり、凍結法(マウス)またはパラフィン包埋法(マーモセットとヒト)で作製した。さらに、フォトブリーチ後の組織を免疫染色したが、マウス、マーモセット、ヒトの脳組織において、免疫蛍光シグナル強度に有意な影響は認められなかった(補足図5)。したがって、これらの結果は、免疫蛍光シグナルを損なうことなく、異なる組織標本や保存条件下でも組織切片中のAFを確実に除去する、費用対効果の高い前染色プロトコルを実証するものである。このプロトコールは、ヒトを含む複数の生物種に適用できるため、幅広い応用が可能である。

Discussion
筆者らは、共焦点レーザー顕微鏡を用いて、発育中、成体、老化、および疾患マウス脳におけるミクログリア関連リポAF(リポフスチン由来自家蛍光)を評価した。筆者らは、ミクログリアが白質と灰白質で最初にリポ-AFを蓄積する細胞であり、白質ミクログリアが最初にリポ-AFを蓄積することを示した。ミクログリア内外のリポ-AFは、灰白質では加齢とともに増加したが、アルツハイマー病関連の神経変性では増加しなかった。注目すべきは、灰白質ではミクログリア内のリポ-AFが、若い成体マウスの脳ではシナプス物質を取り込んだと誤解されることである。最後に、免疫染色の前に組織からリポ-AFシグナルを除去するための、費用対効果の高いプロトコルを紹介する。重要なことは、このプロトコールは、ヒト組織を含め、生物種を問わず蛍光顕微鏡に依存する他の研究にも適用できるということである。
ミクログリア内のリポ-AFの供給源はなんだろうか?網膜色素上皮と同様に、リポ-AFはリポフスチンであり、ミクログリアが介在する細胞物質の貪食により、生涯を通じて生成されると推測される。この考えと一致して、脱髄の際にミエリンを貪食することで、ミクログリアにリポフスチンが蓄積することが示唆されている。興味深いことに、白質ミクログリアと灰白質ミクログリアでは、リポフスチンが最初に、そして最も強固に蓄積することが観察された。これは、過剰または脱落したミエリンを取り込むミクログリアが、生涯を通じてミエリン鞘のリモデリングを続けているためではないかと考えられる。また、ミエリン膜の脂質に富む性質が、酸化脂質に富むリポフスチンの蓄積を助長しているのかもしれない。今後の重要な方向性は、さまざまな疾患におけるミクログリアでのこの生物学の有病率を理解することと、灰白質と白質における異なる貪食基質が、ミクログリアにおいてどのようにリポ-AFの蓄積を異なる形で誘導するかを明らかにすることである。
今回の研究では、ミクログリアが他の中枢神経系細胞よりも先にリポ-AFを蓄積することも示された。発生初期におけるミクログリアの広範な貪食的役割1により、発生期の脳においてミクログリア内に少量のリポ-AFが存在することが説明できるかもしれない。しかし、ミクログリア内のこのリポ-AFは、成体や老化した脳ではかなり増加し、成体脳ではミクログリア内のシナプス免疫染色と共局在する。発育期の脳ではミクログリアのリソソーム分解能力が、リポフスチンをより多く蓄積させることなくリソソームの恒常性を維持できる可能性があるが、このリソソーム分解能力は加齢とともに変化する。この考えを裏付けるように、ミクログリアにおけるリソソーム分解経路の破壊は、リポフスチンの蓄積を増加させることが示された。さらに、細胞分裂は細胞がリポフスチンの負担を軽減する主な方法であることが知られている。すなわち、細胞が分裂すると、リポフスチンは希釈される。若い脳ではミクログリアが活発に分裂しているため、リポフスチン、ひいてはリポAFは希釈される可能性がある。これとは対照的に、成人の脳では、たとえ低レベルであっても細胞物質の取り込みが継続し、細胞分裂が減少しているため、ミクログリアにリポフスチンが蓄積し、それに関連したAFが生じる可能性がある。加齢脳ではミクログリアのリポAF負荷が高いが、われわれが検出したリポAFの大部分は、加齢に伴って神経細胞で観察されたというわれわれの観察も重要である。加齢に伴うこのような神経細胞でのリポ-AFの蓄積は、加齢に伴うオートファジー、リポファジー、および/またはプロテオスタシスの低下に起因すると推測されている。
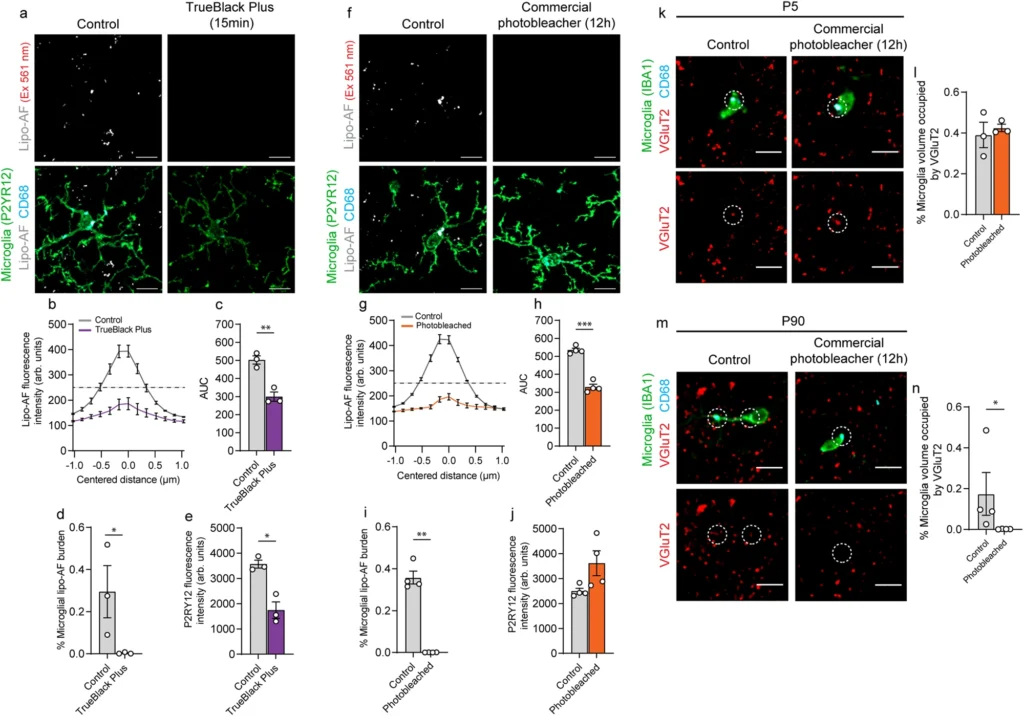
リポフスチンの生物学における加齢や部位依存的な側面を明らかにすることに加え、我々は、リポフスチンがどのように光学顕微鏡によるミクログリアシナプスの貪食解析を混乱させるかを示す。P90でミクログリアとリポAF内に取り込まれた/取り込まれた抗VGluT2シグナルの蛍光強度を測定したところ、これらのシグナル強度は同等であった。同様の結果は、別のシナプス前マーカー抗VGluT1を用いた免疫染色でも得られた。対照的に、シナプス後マーカーの抗Homer1で得られた免疫染色の蛍光強度は、lipo-AFのシグナルよりも有意に高かった。このことから、このシナプス後シグナルは、成体脳における善意の飲み込み事象を反映している可能性が示唆される。また、分子スカフォールドに富むシナプス後物質は、リソソームでの消化に時間がかかり、抗体による検出がより強固になるのかもしれない。我々は、リポAFがシナプス前部物質の呑み込みに及ぼす潜在的な交絡をさらに探ろうとし、組織をフォトブリーチする前と後のミクログリア内の抗VGluT2シグナルの面積を測定した。P90脳では、ミクログリア内の抗VGluT2シグナルはフォトブリーチ後に観察されなくなり、この抗VGluT2シグナルの検出はリポ-AFシグナルによるものであることが示された。対照的に、P5の脳では、抗VGluT2免疫蛍光シグナルが光脱失後もミクログリア内で観察された。この後者の実験から、新生児組織におけるシナプス結合の評価には、lipo-AFの方が問題が少ないことが示された。以上のことから、特に成体マウスの脳においてミクログリアの細胞内封入を解釈する際には注意が必要である。561nmレーザー(BP 629/62)を用いて解析のほとんどを行ったが、他のレーザーライン、レーザー出力、顕微鏡でもミクログリア内のリポ-AFを検出した。その結果、このリポ-AFシグナルは、イメージングセットアップを問わず、より普遍的な問題である可能性が高い。免疫染色の前にサンプルをフォトブリーチし、組織切片中のリポフスチン由来AFまたは他のAF源の量を評価するために、二次のみの対照を含めることは、最良の方法である。
本研究の最終段階として、異なるリポAFクエンチング戦略を比較し、今後ラボが採用すべき費用対効果の高いプロトコルを導き出した。まず、市販の試薬TrueBlack Plus™でリポAFを免疫染色後15分間消光すれば、AFシグナルを消すのに十分であることがわかった。しかし、免疫染色された蛍光シグナルの有意な消光も確認された。この消光を防ぐために、免疫染色の前にこれを行うことは可能であるが、界面活性剤はこの試薬と相性が悪く、免疫染色のために抗体を組織に浸透させる能力を低下させる。二つ目の方法は、市販の光照射装置で切片を長時間インキュベートする方法である。この装置を用いて、脳組織切片を12-24時間フォトブリーチすると、蛍光色素のシグナル強度を損なうことなく、AFシグナルが有意に減少することがわかった。最後に、既報とこの市販のフォトブリーチ装置に基づいて、組織中のAFを除去する同等の能力を持つLEDベースのフォトブリーチシステムを設計した。この自作装置は、比較的安価で製作が簡単であり、研究室間で容易に採用でき、複数の異なる種類の組織サンプルに使用できる。しかし、この装置と共焦点光顕法を行う前にサンプルをフォトブリーチする以外に、ミクログリアによるシナプスの貪食を複数の方法で評価することは良い方法である。例えば、電子顕微鏡やビオチン結合体でシナプスタンパク質にタグを付け、ミクログリアのリソソーム含量を生化学的に評価する方法である。これらの方法は、光学顕微鏡によるリポ-AFシグナルの交絡も避けることができる。
まとめると、ミクログリアによる細胞やタンパク質の基質への取り込み機構が、健康状態や疾患における神経回路の構造や機能に与える影響が、より多くの研究によって明らかになりつつある中、ミクログリアによる細胞やタンパク質の基質への取り込みを評価する実験を、最も厳密に行うことが重要である。われわれが提供するプロトコールは、ミクログリアによる細胞・タンパク質共焦点イメージングアッセイがAFの影響を受けないことを保証するものである。重要なことは、我々のプロトコールと装置はコスト効率がよく、比較的簡単に作成でき、マウス、霊長類、ヒトの組織サンプルにおいてAFシグナルを除去するために使用できることである。
