Cell Rep. 2023 Aug 29;42(8):112947. doi: 10.1016/j.celrep.2023.112947. Epub 2023 Aug 10.
Adamtsl3 mediates DCC signaling to selectively promote GABAergic synapse function (Adamtsl3はDCCシグナルを媒介し、GABAシナプス機能を選択的に促進する)
Teresa M L Cramer 1, Berangere Pinan-Lucarre 2, Anna Cavaccini 3, Angeliki Damilou 3, Yuan-Chen Tsai 1, Musadiq A Bhat 1, Patrizia Panzanelli 4, Nicolas Rama 5, Patrick Mehlen 5, Dietmar Benke 1, Theofanis Karayannis 3, Jean-Louis Bessereau 2, Shiva K Tyagarajan 6
- 1University of Zurich, Institute of Pharmacology and Toxicology, Winterthurerstrasse 190, 8057 Zurich, Switzerland.
- 2University Claude Bernard Lyon 1, CNRS UMR 5284, INSERM U 1314, Melis, 69008 Lyon, France.
- 3University of Zurich, Brain Research Institute, Winterthurerstrasse 190, 8057 Zurich, Switzerland.
- 4Department of Neuroscience Rita Levi Montalcini, University of Turin, Turin, Italy.
- 5Centre de Recherche en Cancérologie de Lyon, INSERM U1052-CNRS UMR5286, Université de Lyon, Centre Léon Bérard, 69008 Lyon, France.
- 6University of Zurich, Institute of Pharmacology and Toxicology, Winterthurerstrasse 190, 8057 Zurich, Switzerland. Electronic address: shiva.tyagarajan@gmail.com.
ハイライト
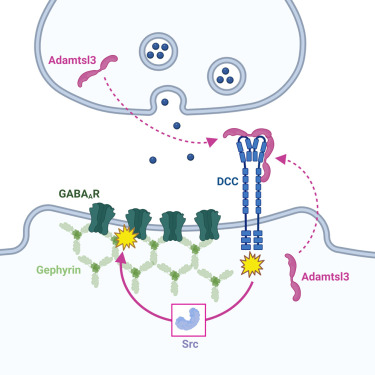
〇Adamtsl3は海馬シナプスで広く発現している
〇Adamtsl3はシナプス形成期および成熟脳においてDCCのリガンドである
〇シナプス前膜およびシナプス後膜のAdamtsl3は、DCCを介してGABAシナプスの維持に寄与する。
〇自己分泌型Adamtsl3-DCCシグナルはGABA作動性シナプス後部の可塑性適応を仲介する。
グラフィカルアブストラクト
Keywords
inhibitory synapse, postsynaptic density, gephyrin, extracellular matrix, GABAA receptor, inhibitory LTP
Abstract
The molecular code that controls synapse formation and maintenance in vivo has remained quite sparse. Here, we identify that the secreted protein Adamtsl3 functions as critical hippocampal synapse organizer acting through the transmembrane receptor DCC (deleted in colorectal cancer). Traditionally, DCC function has been associated with glutamatergic synaptogenesis and plasticity in response to Netrin-1 signaling. We demonstrate that early post-natal deletion of Adamtsl3 in neurons impairs DCC protein expression, causing reduced density of both glutamatergic and GABAergic synapses. Adult deletion of Adamtsl3 in either GABAergic or glutamatergic neurons does not interfere with DCC-Netrin-1 function at glutamatergic synapses but controls DCC signaling at GABAergic synapses. The Adamtsl3-DCC signaling unit is further essential for activity-dependent adaptations at GABAergic synapses, involving DCC phosphorylation and Src kinase activation. These findings might be particularly relevant for schizophrenia because genetic variants in Adamtsl3 and DCC have been independently linked with schizophrenia in patients.
生体内でのシナプスの形成と維持を制御する分子コードについては、これまでほとんど明らかにされていなかった。今回われわれは、分泌タンパク質Adamtsl3(ADAMTS-like protein 3; a disintegrin-like and metalloprotease domain with thrombospondin type I motifs-like 3; punctin-2)が、膜貫通型受容体DCC(大腸がんで欠失)を介して、海馬シナプスの重要なオーガナイザーとして機能することを明らかにした。従来、DCCの機能はグルタミン酸作動性シナプス形成とNetrin-1シグナルに応答する可塑性に関連していた。われわれは、生後早期の神経細胞におけるAdamtsl3の欠失がDCCタンパク質の発現を障害し、グルタミン酸作動性シナプスとGABA作動性シナプスの両方の密度低下を引き起こすことを示した。GABAニューロンあるいはグルタミン酸作動性ニューロンにおけるAdamtsl3の成体欠失は、グルタミン酸作動性シナプスにおけるDCC-Netrin-1機能を阻害しないが、GABA作動性シナプスにおけるDCCシグナル伝達を制御する。Adamtsl3-DCCシグナル伝達ユニットはさらに、DCCのリン酸化とSrcキナーゼの活性化を伴う、GABA作動性シナプスにおける活動依存的な適応に必須である。Adamtsl3およびDCCの遺伝子変異は、統合失調症患者と独立して関連していることから、これらの知見は統合失調症に特に関連するかもしれない。
Introduction
シナプスオーガナイザーは、脳の発達や成人期におけるシナプスの維持において、シナプス前とシナプス後の接着や結合を促進する重要な因子である。シナプス前ニューレキシンとシナプス後ノイロリギン(NLG)パートナーは、典型的なシナプスオーガナイザーの例である。興奮性シナプスではNLG1、抑制性シナプスではNLG2が、シナプス後膜では様々なシグナル伝達タンパク質(LRRTM、ラトロフィリン)やGABAA(γ-アミノ酪酸)受容体と直接相互作用する。したがって、シナプス前とシナプス後の相互作用の連続性が、シナプス結合の分子論理に寄与していると考えられている。
シナプスオーガナイザーもまた、神経回路形成において重要な役割を果たしている。成体脳では、Netrin-1-DCC相互作用がSrcキナーゼを活性化し、NMDAR依存的な長期増強(LTP)を誘導することで、記憶や学習に影響を及ぼしている8。線虫の線虫では、UNC-6(Netrin-1ホモログ)とUNC-40(DCCホモログ)は、アクチン細胞骨格を組織化することによって、NMJ(神経筋接合部)でのシナプス小胞のクラスター化を促進する。遺伝学的スクリーニングにより、線虫のシナプス前分泌型糖タンパク質Ce-Punctinが同定され、このタンパク質がシナプス後部のアセチルコリン受容体やGABAA受容体と神経伝達物質特異的放出部位を結びつけることが示された。その後の研究で、Ce-PunctinはFRM-3/FARP1-2およびLIN-2/CASKのリクルートメントを介して、GABAA受容体維持のためにシナプス後UNC-40/DCCに結合し、活性化することが明らかになった。Ce-Punctinの哺乳類オルソログであるAdamts-like 1およびAdamts-like 3は、ADAMTS(A Disintegrin and Metalloprotease with Thrombospondin repeat)プロテアーゼに関連する細胞外糖タンパク質のクラスに属するが、タンパク質分解活性を持たない13。Adamtsl1とAdamtsl3はヒト胎盤ライブラリーのcDNAから発見された14。Adamtsl1は主にヒトとマウスの骨格筋で発現しているが、Adamtsl3は脳で広く発現しており、統合失調症の候補遺伝子として同定されている。
GABAA受容体のクラスタリングや抑制性シナプスの可塑性にはいくつかの細胞内シグナル伝達経路が関与していることが示されているが、GABA作動性シナプスの形成や維持を規定する細胞外オーガナイザーについてはほとんど知られていない。哺乳類のCe-Punctinオルソログの役割も、脳のGABA作動性シナプスにおけるDCCの機能も、まったく解明されていない。ここでは、哺乳類の脳におけるAdamtsl3の機能を明らかにすることを目的とした。In vitroのHEK293T-ニューロン共培養とAAV8-Syn1-Creを組み合わせて、出生時に海馬ニューロンのAdamtsl3を欠損させることで、Adamtsl3が生後早期のGABA作動性シナプスとグルタミン酸作動性シナプスのDCC依存的アセンブリーに機能していることを明らかにした。AAV6-CaMKIIαERT2-CreまたはAAV8-DlxERT2-Creを組み合わせて、錐体ニューロンまたはGABA作動性介在ニューロンのAdamtsl3またはDCCを欠損させることで、成体脳におけるGABA作動性シナプスの維持にAdamtsl3がDCCシグナルの上流で機能していることを報告した。さらに、成熟脳におけるDCC受容体でのAdamtsl3シグナル伝達は、GABAシナプスの完全性に特異的に影響を及ぼすのに対し、Netrin-1シグナル伝達はグルタミン酸作動性シナプスの完全性に影響を及ぼすという証拠を得た。このことから、海馬の記憶機能において、DCCとSrcの活性化を介して、GABA作動性シナプスにおける活動依存的な可塑性適応にAdamtsl3が機能していることが示された。これらのデータを総合すると、GABA作動性シナプスにおいてDCCを介してシグナルを伝達する細胞外シナプスオーガナイザーAdamtsl3が同定された。
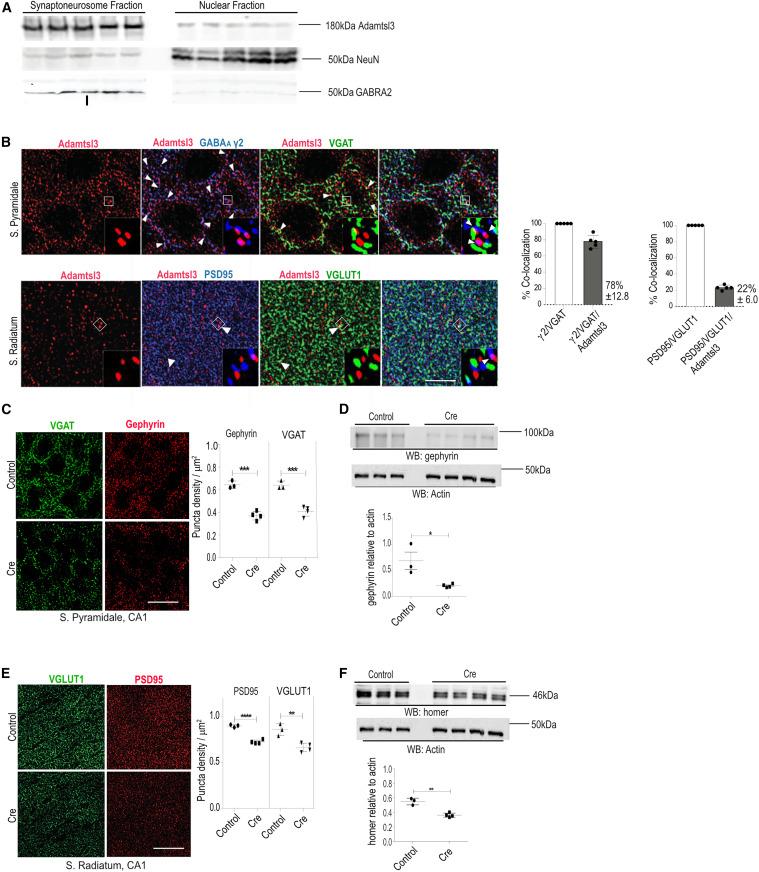
(A) Synaptoneurosome fraction showing enrichment for Adamtsl3 and GABRA2 (n = 5).
(B) Representative image of CA1 (top panel) S. pyramidale stained for Adamtsl3 (red), γ2 GABAAR subunit (blue), and VGAT (green) (n = 4; SD ±1.8%).; (bottom panel) S. radiatum stained for Adamtsl3 (red), PSD95 (blue), and VGlut1 (green) (n = 4; SD ±3.9%). Co-localization is shown using white arrowheads in zoom-in (white box).
(C) Left: representative images of CA1 S. pyramidale stained for VGAT (green) and gephyrin (red). Right: quantification of puncta densities. (n = 3–4).
(D) WB for gephyrin after Adamtsl3 deletion (n = 3–4).
(E) Left: representative images of CA1 S. radiatum stained for VGlut1 (green) and PSD95 (red). Right: quantification of puncta densities (n = 3–4).
(F) WB for homer after Adamtsl3 deletion (n = 3–4). Scale bar, 5 μm.
Data are shown as mean ± SD. ∗∗p < 0.01, ∗∗∗p < 0.005, ∗∗∗∗p < 0.0001, as determined by Student’s two-tailed t test.
Discussion
線虫では、NMJで分泌されるCe-Punctinが、興奮性シナプス後と抑制性シナプス後との特異性の決定に中心的な役割を果たしている。本研究では、げっ歯類の脳におけるCe-Punctinオルソログ、Adamtsl3の特徴を明らかにすることを目的とした。Ce-Punctinと同様に、Adamtsl3は抑制性シナプス部位と興奮性シナプス部位の両方で機能することが報告されている。生後間もない脳では、Adamtsl3はGABA作動性シナプスとグルタミン酸作動性シナプスの形成に関わるDCC機能を促進する。成体脳では、Adamtsl3はDCC受容体を介してシグナルを伝達し、GABA作動性シナプスの維持に特異的に影響を及ぼすのに対し、Netrin-1はDCCを介してシグナルを伝達し、グルタミン酸作動性シナプスの維持に影響を及ぼす。Adamtsl3の神経細胞サブタイプ特異的欠失を用いて、GABA作動性シナプスにおけるDCC受容体シグナル伝達におけるAdamtsl3のシナプス前およびシナプス後の寄与を明らかにした。シナプス前Adamtsl3はDCCを安定化/局在化し、シナプス後Adamtsl3はGABA作動性シナプス維持のためのDCCシグナル伝達を活性化する。機能的には、Adamtsl3-DCCシグナルモジュールは、Src経路の活性化を通じてGABAシナプスにおける可塑性の変化をサポートしている。それに伴い、行動アッセイでは、シナプス前およびシナプス後のAdamtsl3が、記憶符号化における海馬の機能を維持することが示された。これらのデータを総合すると、Adamtsl3は生体内のGABA作動性シナプスにおける細胞外シナプスオーガナイザーであることが明らかになった。
〇ネトリン-1-DCCネクサスを超えて
DCCのリガンドはNetrin-1である。交連軸索はその成長円錐上にDCCを発現しており、ネトリン-1の結合は、成長円錐をネトリン-1勾配に沿って誘導する細胞内シグナル伝達を引き起こす。げっ歯類の脳では、軸索誘導はP10までに完了する。P0時にAAV8-hSyn1-RFP-Creを頭蓋内に注入する我々の方法では、Adamtsl3の発現はP10以降にしか停止しないと予想される。したがって、我々の実験パラダイムでは、Adamtsl3の欠失が軸索誘導に影響を与える可能性は低い。しかし、BL6マウスの海馬形成部では、P5でAdamtsl3のmRNA発現が高いこともわかった(図S1F)。ネトリン-1が生後1週間の間にDCCを介して苔状線維を引き寄せ、その方向性を制御することが示されていることから、DCCにおけるAdamtsl3シグナル伝達もまた、発達中の海馬における軸索ターゲティングに影響を与える可能性がある。重要なことに、線虫のAdamtsl3のオルソログであるCe-Punctinは、正中線指向性ガイダンスにおいてNetrin/UNC-6と冗長的に機能することが見いだされた。この機能的冗長性がげっ歯類の脳において進化的に保存されているのか、あるいはDCCにおけるAdamtsl3シグナル伝達が軸索ターゲティングに独立して関与しているのかは、まだ明らかにされていない。
ネトリン-1とDCCシグナルは、Nck1(Dock)、Pak1、Cdc42、Rac1、RhoAなどのアクチン細胞骨格エフェクタータンパク質の興奮性末端での再組織化を通して、推定シナプス接点の接着とシナプスタンパク質の局所的蓄積を促進することが示されている。しかし、Draxin、Cerebellin 4、DSCAM、およびシナプス周囲腔のヘパラン硫酸もまた、DCC依存性シナプス形成の促進に関与している。GABA作動性シナプスとグルタミン酸作動性シナプスの形成に影響を与えるDCCリガンドとしてAdamtsl3が同定されたことで、DCCのトランスシグナリングネットワークはさらに複雑になった。
興味深いことに、Adamtsl3とDCCの相互作用は、線虫のCe-PunctinとUNC-40/DCCもNMJ形成を促進するために物理的に相互作用するように、進化的に保存されている。Ce-Punctinには2つのアイソフォームがあり、どちらもコリン作動性あるいはGABA作動性のNMJに局在するUNC-40/DCCのリガンドである。対照的に、3つのAdamtsl3変異体が報告されているが、そのうちの1つだけが成体マウスで検出されている。予測される全てのアイソフォームを免疫組織化学的に検出できる我々の自家製抗体を用いて、成体GABA作動性シナプスにおけるAdamtsl3の優先的局在を同定した。しかしながら、Adamtsl3アイソフォームが発生初期に異なって発現し、おそらくDCCと相互作用するグルタミン酸作動性シナプスにも発現しているかどうかはわからない。P0のAdamtsl3欠失とニューロン-HEK293T共培養アッセイから得られた知見は、興奮性シナプス形成と抑制性シナプス形成の両方におけるAdamtsl3の機能を支持しており、Adamtsl3アイソフォームの発現が時空間的に制御されているか、あるいはAdamtsl3がNetrin-1などの他のリガンドと協力してグルタミン酸作動性シナプス形成に関与していることを示唆している。DCC、Adamtsl3、Netrin-1、およびシナプス形成と仕様に関する他のシグナル間の相互作用については、今後さらに明らかにする必要があるだろう。GABA作動性シナプスでは、Adamtsl3-DCCと、Slitrk3(Slit and NTRK-like family member 3)、PTPδ(チロシンホスファターゼ受容体PTP delta)、アデノシンA2A受容体52のような他の既知のシグナル伝達分子との時空間的関係を調べることも、Adamtsl3の役割を定義するために不可欠であろう。我々のニューロン-HEK293T共培養アッセイでは、VGAT陽性シナプス形成を調べ、DCCにおけるAdamtsl3のシナプス形成機能はNLG1やNLG2に依存しないことを見出した(図S3BとS3C)。しかし、共培養アッセイではシナプス後誘導を評価しなかったため、Adamtsl3がGABAA受容体のクラスタリングに必要なのかどうか、またNLG2を必要とするのかどうかは不明である。優れたNLG2市販抗体がないため、Adamtsl3遺伝子の欠失に伴うNLG2の発現変化を免疫組織化学的に評価することはできなかった。Takahashiらは、共培養アッセイにおいて、シナプス後接着分子Slitrk3がNLG2とは無関係にVGAT陽性シナプスを効率的に誘導することを見出したが、彼らは、Slitrk3とNLG2が生体内で協力してCA1におけるGABA作動性シナプスの発達を制御していることを指摘した。したがって、生体内でのAdamtsl3の機能におけるNLGの役割は否定できない。NLG2欠失はCA1における体性GABAA受容体の領域特異的な消失をもたらし、Adamtsl3欠失はCA1錐体細胞におけるGABA作動性抑制の機能障害をもたらす。従って、DCCとNLG2の下流のシグナル伝達経路は、GABAA受容体のクラスター化を促進するために協力し合うか、あるいはオーバーラップしているということになる。注目すべきことに、線虫では最近、Ce-Punctinのタンパク質分解によってN末端が短くなり、NLG1と特異的に結合し、UNC-40/DCCとともにGABA作動性シナプス後ドメインの構成に寄与することが示された。我々は、Adamtsl3とDCCの相互作用が機能的に保存されていることを見いだしたので、Adamtsl3のタンパク質分解による切断も、マウス脳におけるNLGの機能とシナプスの特定に関連しているのかもしれない。
〇GABAシナプス維持のためのAdamtsl3-DCCシグナル伝達
成体脳では、DCCは興奮性スパインの維持とシナプス部位のGluN2B発現に重要な役割を果たしている。さらに、DCCの欠失はLTP誘導と空間記憶に障害を引き起こすことが示されている。ここでは、GABA作動性シナプスにおけるDCCのこれまで予想されていなかった役割を明らかにする。特定のニューロンサブタイプでDCCを欠損させることで、DCCが部位特異的にGABA作動性シナプス前部とシナプス後部のコンパートメントを維持するシグナルを発していることがわかった(図4Hと4I)。我々のデータは、CA1錐体ニューロンにおける興奮性シナプスの電気生理学的特性に対するDCCの特異的なシナプス前およびシナプス後への寄与を示した別の報告と一致している28,29。しかしながら、DCCがシナプス前またはシナプス後の対極的な部位で欠失した後も、VGATまたはゲフィリンクラスターが維持されることは興味深い(図4I)。シナプス横断的相互作用(例えばニューレキシン-NLG)はシナプスの仕様と維持を決定すると考えられているが、シナプス前またはシナプス後の集合体を誘導する別個のメカニズムも同定されている5,56。特定のGABAコンパートメントを維持するためにDCCがどのようにシグナルを送るかはまだ研究されていないが、Nck1(Dock)、Pak1、あるいはRho GTPase(Cdc42、Rac1、RhoA)を含むシナプス細胞骨格の下流エフェクターが関与している可能性が高い8,46,57。
特定のニューロンサブタイプでAdamtsl3を欠損させることで、シナプス前ニューロンとシナプス後ニューロンのAdamtsl3がCA1 GABA作動性コンパートメントの維持に必須であることを明らかにすることができた。AAV6-CaMKIIαERT2-Creを注射したAdamtsl3flox/floxマウスはシナプス後部位に限定されたシナプス変化を示すのに対し、AAV8-hDlxERT2-Creを注射したAdamtsl3flox/floxマウスは、シナプス前神経伝達物質放出(IEI)とシナプス後受容体利用可能性(振幅)のレベルでGABA作動性神経伝達の障害を示す(図3G)。このように、我々のデータは、部位特異的および経シナプス的に作用するシナプス前およびシナプス後Adamtsl3の多様な役割を同定した。さらに我々のデータは、これらの多様な役割が、DCCレセプター機能に対するシナプス前とシナプス後のAdamtsl3の寄与の違いによって、少なくとも部分的には媒介されることを示している。我々は、シナプス前Adamtsl3がシナプス後GABA作動性部位でDCCを安定化し(図4D)、シナプス後に放出されたAdamtsl3が錐体細胞のDCC活性化に必須であるという単純な仮説を提唱する(図4F)。シナプス前Adamtsl3とシナプス後Adamtsl3がシナプス後部位でどのように異なってDCCと結合するか、あるいはDCCを制御するかは、グリコシル化のような翻訳後修飾の役割によると考えられる。しかし、現在のところ、そのメカニズムの詳細は不明である。
シナプス前局在DCCにおけるAdamtsl3の役割についても、さらなる研究が必要であろう。成体で介在ニューロンからAdamtsl3を欠失させても、GABA作動性終末のマーカーであるVGATの点状密度(図3C)は変化しないが、介在ニューロンからDCCを欠失させるとVGATの点状密度が減少する(図4H)。したがって、DCCがGABA作動性シナプス前部位で働くためには、Adamtsl3とは異なるリガンドによって安定化(あるいは活性化)されなければならない。しかし、介在ニューロンからAdamtsl3を成体で欠失させると、mIPSCのIEIが強く減少し(図3G)、これはシナプス前機能障害を示している。ネトリン-1-DCCシグナルはシンタキシン-1を活性化することが示されており、シンタキシン-1はSNAP25とシナプトブレビン-2とともにシナプスにおける小胞の移動と脱分極を介した融合に必要である58,59。したがって、介在ニューロンからのアダムスリル3の欠失は、神経伝達物質の放出に影響を及ぼすシナプス前DCC機能を変化させる可能性がある。この見解を支持するものとして、Glasgowら29は、興奮性末端におけるDCCの欠損が誘発性神経伝達を障害することを見出した。現在のところ、われわれの発見は、シナプス前Adamtsl3がシナプス前GABA作動性活性にもおそらくGABA放出動態に関与していることを示しているが、その具体的なメカニズムとDCCの役割についてはさらなる研究が必要である。
成体脳のNetrin-1 mRNAをサイレンシングすることで、成体脳のDCCレセプターにおけるNetrin-1シグナル伝達が、グルタミン酸作動性シナプスの完全性に特異的に影響を与えるという証拠をさらに得た(図S6)。Netrin-1-DCCシグナルとAdamtsl3-DCCシグナルの、それぞれグルタミン酸作動性シナプスとGABA作動性シナプスへの分離を促進するものは何か、さらなる研究が必要である。これまでのところ、Adamtsl3とNetrin-1の機能の相違が、シナプス特異的な発現パターンの結果だけなのかどうかはわかっていない。我々は、GABA作動性シナプスにおけるAdamtsl3の優先的局在を発見したが、成体脳における免疫組織化学を用いたNetrin-1のシナプス局在を評価することはできなかった。グルタミン酸作動性シナプスにおけるNetrin-1の機能は文献によく記載されているが、Netrin-1のmRNAはCA1のS. pyramidaleでも高発現しており(データはAllen Mouse Brain Atlas In situ hybridization [ISH]から得られた)、CA1のGABA作動性シナプスに存在する可能性を示している。したがって、GABA作動性シナプスにおけるDCCシグナル伝達が、Adamtsl3とNetrin-1の相乗機能に依存しているのか、Adamtsl3だけに依存しているのかは、まだ明らかにされていない。特に、GABA作動性シナプスにおけるDCC-Netrin-1シグナル伝達を変化させるためには、Adamtsl3が必要かもしれない。CDK5とGSK3βの両方が、ゲフィリン足場と微小管相互作用の減少に関連しており、DCC-Netrin-1シグナル伝達の下流で活性化される。以上のことから、われわれのデータは、海馬におけるGABAシナプスの分子構造を動的に組織化する上で、Adamtsl3がシナプスの可塑性と記憶に機能的な影響を及ぼす重要な役割を担っていることを示している(図5と6)。
〇Adamtsl3-DCC下流エフェクターはGABA作動性シナプス後可塑性を促進する
Netrin-1と同様に、我々はAdamtsl3がDCCのTyr1418リン酸化を直接促進し、下流のシグナル伝達を活性化することを明らかにした27,37。iLTPのin vitroパラダイムを用いて、我々はAdamtsl3がGABA作動性抑制における適応のためにDCCとSrcの活性化に影響を与えることを示した(図S5)。私たちは、Adamtsl3-DCC-Srcシグナルが、海馬の可塑性と記憶機能に関して以前に特徴付けられたTyr365/367の部位でGABAA受容体γ2サブユニットに直接作用すると予想している32,33。ゲフィリンには直接リン酸化するためのSrcコンセンサスモチーフが存在しないため、Srcがゲフィリンを介してGABA作動性シナプスの可塑性を促進するとは考えていない。しかし、CaMKIIα65やPLCγ145のような他の既知のDCCエフェクターは抑制性シナプスの機能に関与しており、Adamtsl3-DCCの下流でゲフィリン足場やGABAA受容体を修飾する可能性もある66。最後に、Adamtsl3の欠失に伴うシナプス前DCCの機能障害やシナプス伝達の減弱がiLTPの発現障害に関与している可能性があるため、iLTPにおけるシナプス前Adamtsl3の役割についてはさらなる研究が必要である。Adamtsl3は統合失調症の候補遺伝子として同定されており、統合失調症は一貫してGABA作動性神経伝達の低下と関連している67。したがって、GABA作動性シナプスにおけるAdamtsl3の下流で我々が概説したシグナル伝達カスケードは、健常時と疾患時の両方の脳機能を理解する上で極めて重要である。
〇研究の限界
本研究の大きな限界は、Adamtsl3に対する自家製抗体では、特異的な機能を示す可能性のある個々のAdamtsl3アイソフォームを区別できないことである。さらに、IHCに一般的なシナプスマーカーを用いたため、CA1シナプスの分子的不均一性に対処することができなかった。他の脳領域の詳細な形態学的・機能的解析を行えば、別の生物学的知見が得られるかもしれない。最後に、我々はAdamtsl3の半減期とP0注射後のAAV8-hSyn1-RFP-Cre発現までの時間を知らない。したがって、生後早期の脳において、どの発生プログラムがAdamtsl3によって影響を受けるかを確認することはできなかった。
