Nature Communications volume 12, Article number: 2030 (2021)
Loss of microglial SIRPα promotes synaptic pruning in preclinical models of neurodegeneration (ミクログリアSIRPαの欠損は神経変性の前臨床モデルにおいてシナプス刈り込みを促進する)
Xin Ding, Jin Wang, Miaoxin Huang, Zhangpeng Chen, Jing Liu, Qipeng Zhang, Chenyu Zhang, Yang Xiang, Ke Zen & Liang Li
Abstract
Microglia play a key role in regulating synaptic remodeling in the central nervous system. Activation of classical complement pathway promotes microglia-mediated synaptic pruning during development and disease. CD47 protects synapses from excessive pruning during development, implicating microglial SIRPα, a CD47 receptor, in synaptic remodeling. However, the role of microglial SIRPα in synaptic pruning in disease remains unclear. Here, using conditional knock-out mice, we show that microglia-specific deletion of SIRPα results in decreased synaptic density. In human tissue, we observe that microglial SIRPα expression declines alongside the progression of Alzheimer’s disease. To investigate the role of SIRPα in neurodegeneration, we modulate the expression of microglial SIRPα in mouse models of Alzheimer’s disease. Loss of microglial SIRPα results in increased synaptic loss mediated by microglia engulfment and enhanced cognitive impairment. Together, these results suggest that microglial SIRPα regulates synaptic pruning in neurodegeneration.
ミクログリアは中枢神経系におけるシナプスのリモデリングを制御する上で重要な役割を果たしている。古典的補体経路の活性化は、発生および疾患においてミクログリアが介在するシナプス刈り込みを促進する。CD47は発生過程においてシナプスを過剰な刈り込みから保護することから、CD47受容体であるミクログリアのSIRPαがシナプスリモデリングに関与していることが示唆される。しかし、疾患におけるシナプス刈り込みにおけるミクログリアSIRPαの役割は不明である。ここでは、コンディショナルノックアウトマウスを用いて、ミクログリア特異的にSIRPαを欠損させるとシナプス密度が低下することを示した。ヒト組織では、ミクログリアのSIRPα発現がアルツハイマー病の進行とともに低下することが観察された。神経変性におけるSIRPαの役割を調べるために、アルツハイマー病モデルマウスにおいてミクログリアSIRPαの発現を調節した。ミクログリアSIRPαを欠損させると、ミクログリアによる刈り込みを介してシナプス損失が増加し、認知機能障害が増強した。これらの結果は、ミクログリアSIRPαが神経変性におけるシナプス刈り込みを制御していることを示唆している。
SIRP alpha & CD47 免疫チェックポイント経路
CD47 は、マクロファージおよび樹状細胞特異的タンパク質シグナル調節タンパク質アルファ (SIRP alpha)への結合を介して食作用を調節するなど、さまざまな機能を持つ細胞表面糖タンパク質である。SIRPαおよびCD47免疫チェックポイント経路として、SIRPαのCD47への結合は、食作用を阻害するためのシグナル伝達を開始することにより、本質的に「私を食べないで」というメッセージをマクロファージに送る。CD47の発現の増加は、それを通して癌細胞が免疫検出および食作用を回避するメカニズムであることが提唱されている。CD47の発現は、急性骨髄性白血病(AML)、急性リンパ芽球性白血病(ALL)、非ホジキンリンパ腫(NHL)、原発性滲出液リンパ腫、多発性骨髄腫、平滑筋肉腫、および膀胱がんを含むいくつかの癌で増加している。また、抗CD47遮断抗体を用いた癌細胞上のCD47の標的化は、インビトロでマクロファージによる食作用を促進することができる。さらに、抗CD47遮断抗体による治療はrituximab治療と相乗作用を示し、in vitroで食作用を促進し、in vivoで非ホジキンリンパ腫の異種移植片モデルにおける癌細胞を排除することはできる。さらなる結果によると、種々のヒト固形腫瘍におけるCD47の発現が増加し、そして、抗CD47抗体を用いてSIRPαおよびCD47免疫チェックポイント経路を遮断することは、インビトロで固形腫瘍細胞の食作用を促進し、そしてインビボで固形腫瘍の増殖を減少させることができる。(日本シノバイオロジカルより抜粋)
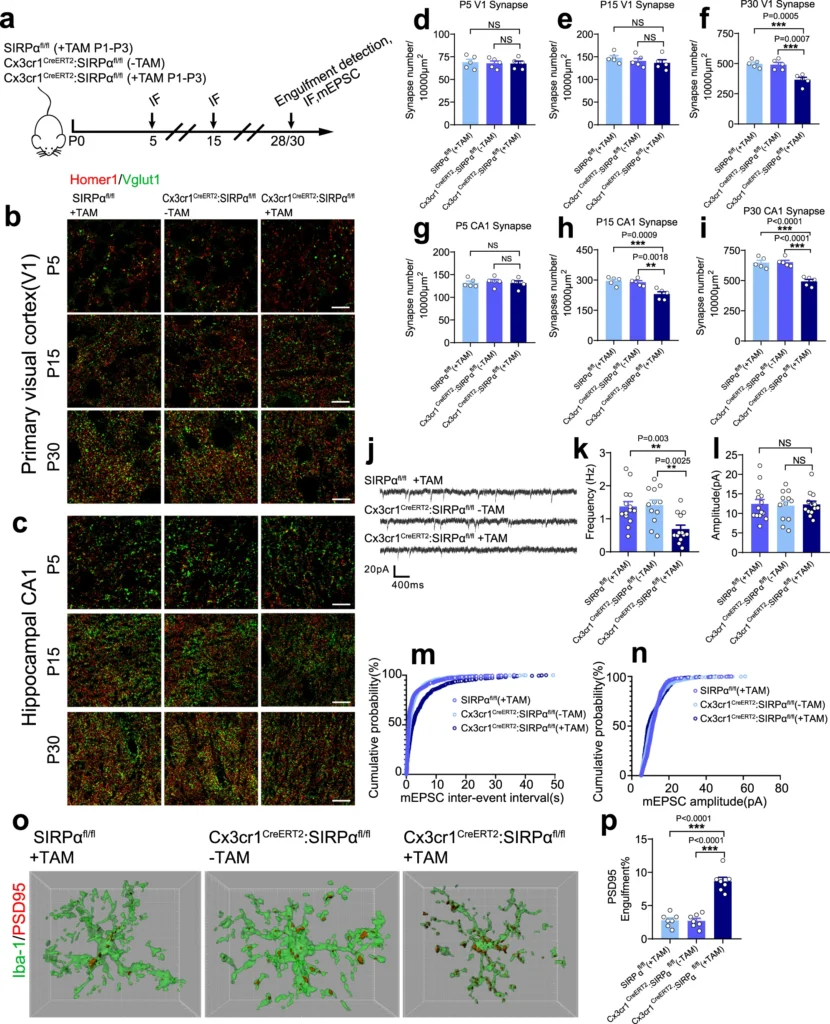
a Schematics of the experimental procedures. IF immunofluorescence, mEPSC miniature excitatory postsynaptic current, TAM tamoxifen, P postnatal. Neonatal mice were injected 50 μg tamoxifen at P1, P2, and P3. b, c Representative confocal images depict synaptic staining for presynaptic marker Vglut1 (green) and postsynaptic marker Homer1 (red) in primary visual cortex (V1) (b) or hippocampal CA1 stratum radiatum (c) in SIRPαfl/fl (+TAM), Cx3cr1CreERT2:SIRPαfl/fl (−TAM), and Cx3cr1CreERT2:SIRPαfl/fl (+TAM) mice at different time points. Synaptic number was quantified as colocalized pre- and postsynaptic puncta. Scale bar, 10 μm. d–i Histograms depict synaptic density in V1 (d–f) or hippocampal CA1 (g–i) in those mice. n = 5 mice/group; average of 10–12 fields from each mouse. One-way ANOVA analysis with Dunnett’s multiple comparisons test. j Example traces of mEPSCs (miniature excitatory postsynaptic currents) from SIRPαfl/fl (+TAM), Cx3cr1CreERT2:SIRPαfl/fl (−TAM), and Cx3cr1CreERT2:SIRPαfl/fl (+TAM) mice. k, l Histogram shows average mEPSC frequency (k) and amplitude (l) of SIRPαfl/fl (+TAM), Cx3cr1CreERT2:SIRPαfl/fl (−TAM), and Cx3cr1CreERT2:SIRPαfl/fl (+TAM) mice. n = 14, 12, 13 cells/group from 4 to 5 mice. One-way ANOVA analysis with Dunnett’s multiple comparisons test. m, n Cumulative probability distributions of mEPSC inter-event intervals (m) and amplitude (n) of SIRPαfl/fl (+TAM), Cx3cr1CreERT2:SIRPαfl/fl (−TAM) and Cx3cr1CreERT2:SIRPαfl/fl (+TAM) mice. o, p Three-dimensional reconstruction and surface rendering demonstrate larger volumes of PSD95 puncta inside Iba-1 positive microglia in V1 from P28 Cx3cr1CreERT2:SIRPαfl/fl (+TAM) mice. n = 7 mice/group, average of 8–9 microglia from each mouse, one-way ANOVA analysis with Dunnett’s multiple comparisons test. Grid line increments = 5 μm. Data are mean ± s.e.m. **P < 0.01, ***P < 0.001, NS not significant. Detailed statistical information was listed in Supplementary Statistical Data. Source data are provided as a Source Data file.
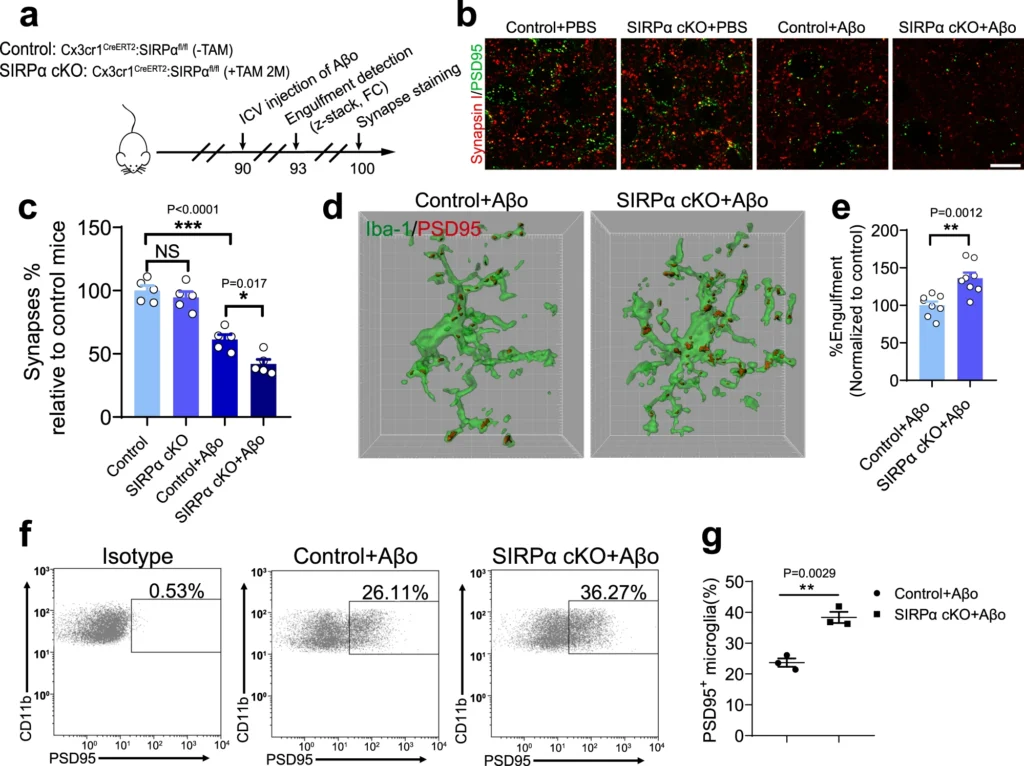
a Schematics of the experimental procedures, Cx3cr1CreERT2:SIRPαfl/fl (-TAM) mice are used as normal control. ICV intracerebroventricular, FC flow cytometry, TAM tamoxifen. b, c Representative confocal images (b) depict synaptic staining for presynaptic marker Synapsin I (red) and postsynaptic marker PSD95 (green) in cortex, Scale bars, 10 μm. Aβm, Aβ42 monomer; Aβo, Aβ42 oligomer. The histogram c displays the quantification of synaptic density in these mice. n = 5 mice/group (male, 3 months age), average of 6–8 fields from each mouse. One-way ANOVA, by Tukey’s multiple comparison test. d, e 3D reconstruction and surface rendering demonstrate larger volumes of PSD95+ puncta inside Iba-1+ microglia in cortex from SIRPα-cKO mice versus control mice after Aβo stimulation (2 μg/mouse), Grid line increments = 5 μm. n = 8 mice/group, average of 8–9 microglia from each mouse, two-tailed unpaired t test. f, g Flow cytometry analysis of synaptic material (PSD95+) engulfed by microglia in SIRPα-cKO or control mice after Aβo injection. n = 3 mice/group, average of three tests from each mouse, two-tailed unpaired t test. Data are mean ± s.e.m. *P < 0.05, **P < 0.01, ***P < 0.001, NS not significant. Detailed statistical information was listed in Supplementary Statistical Data. Source data are provided as a Source Data file.
Discussion
ミクログリアは中枢神経系におけるシナプスのリモデリングにおいて重要な役割を担っているが、その分子メカニズムはまだ研究中である。いくつかの研究では、iC3b/C3b-CR3シグナルが神経発達過程におけるシナプスの除去を積極的に制御していることが示されている。さらに、神経細胞のCD47が発達初期の視覚系において、ミクログリアによる不適切なシナプスの除去からシナプスを保護するという証拠がある。これは、中枢神経系におけるシナプス刈り込みの負の制御因子に関する最初の研究で、SIRPα-CD47シグナル軸が重要な役割を果たしていると考えられている。しかし、中枢神経系におけるシナプスのリモデリングに対するミクログリアのSIRPαの正確な作用は不明なままである。この論文で筆者らは、ミクログリアSIRPα-cKOマウスがdLGN(外側膝状体:視覚の視床中継核)だけでなく視覚野や海馬でもシナプス数を減少させることを示した。CD47-KOマウスでも同様の結果が得られたことから、SIRPα-CD47シグナルは脳内のシナプスリモデリングの負の制御に全般的に働いている可能性が示された。我々は、SIRPα cKOマウスとCD47-KOマウスにおいて、発達の過程でミクログリアがより多くのシナプス構造を取り込んでいることを証明した。また、これらのマウスでは、発達の初期段階(P5)においてシナプスの数は変化していなかった。このことは、ミクログリアが介在する過剰刈り込みが、我々が観察したシナプスの減少に関与している可能性を示している。しかし、P15からP30にかけてシナプス数が増加するという結果から、SIRPα-CD47シグナルの欠損がシナプス形成に影響を及ぼし、それがこの時期のシナプス減少に関与している可能性も否定できない。
CD47の発現はADの進行中にも低下する。ADマウスでは、生後8ヵ月でシナプトソームのCD47レベルが低下する。この段階でのCD47発現の低下は、長期にわたる神経活動の低下の結果である可能性がある。注目すべきことに、麻酔をかけたマウスモデルではミクログリアの監視が有意に増加しており、ミクログリアが介在するシナプスクリアランスが増加する可能性を示す証拠がある。さらに、CD47の発現が低いAD後期マウス脳(8M)から単離されたシナプトソームは、ミクログリアに飲み込まれやすい。CD47-KOマウスでは、SIRPα-cKOマウスにAβoをICV注射すると、シナプスの消失とミクログリアによる貪食が亢進した。シナプス除去の異常はAD病態において明らかであり、以前の報告では、シナプスにおけるC1q発現の亢進という神経細胞の異常が明らかにされている。これらの知見を総合すると、ADではミクログリアのSIRPαシグナルが阻害され、ADの進行過程で不適切なシナプス消去が促進されることにより、シナプスの消失が著しく加速されるという証拠が得られた。我々は、このようなシナプス刈り込み/除去の負の制御シグナルが神経疾患において調節不全となり、さらにシナプス病理学や神経症状の一因となっていることを証明した。SIRPα-CD47シグナルは免疫チェックポイント経路として広く研究されていることから、シナプス病変に関連する神経疾患の治療標的となる可能性もある。
まとめると、今回の研究結果は、ミクログリアのSIRPαシグナルが、脳の恒常性維持に重要な神経発達初期のシナプス刈り込みを負に制御していることを示す証拠となる。AD病態では、ミクログリアのSIRPαシグナルが破壊され、その結果、シナプスの過剰な除去が誘導され、認知障害が増強される。
*CD47は、血球細胞がマクロファージ、樹状細胞などの貪食細胞からの攻撃を守るタンパクである。CD47は赤血球、血小板、リンパ球などの血球細胞表面に存在するが、AML(急性骨髄性白血病)、NHL(非ホジキンリンパ腫)、そして乳がんなどの固形がんのがん細胞に過剰に発現することが判っている。(オンコロより抜粋)
db667fe78ff9daad1fd99776cab0f777