
Volume 186, Issue 10, 11 May 2023, Pages 2111-2126.e20 Article
An in vivo neuroimmune organoid model to study human microglia phenotypes (ヒトマイクログリアの表現型を研究するためのin vivo神経免疫オルガノイドモデル)
Simon T. Schafer 1234810, Abed AlFatah Mansour 158, Johannes C.M. Schlachetzki 6, Monique Pena 1234, Saeed Ghassemzadeh 1, Lisa Mitchell 1, Amanda Mar 1, Daphne Quang 1, Sarah Stumpf 1, Irene Santisteban Ortiz 234, Addison J. Lana 6, Clara Baek 1, Raghad Zaghal 5, Christopher K. Glass 6, Axel Nimmerjahn 7, Fred H. Gage 19
1Laboratory of Genetics, The Salk Institute for Biological Studies, La Jolla, CA 92037, USA 2Department of Psychiatry and Psychotherapy, School of Medicine, Technical University of Munich, 81675 Munich, Germany 3Center for Organoid Systems, Technical University of Munich, 85748 Garching, Germany 4TranslaTUM – Organoid Hub, Technical University of Munich, 81675 Munich, Germany 5Department of Medical Neurobiology, Institute for Medical Research Israel-Canada, Faculty of Medicine, Hebrew University of Jerusalem, Jerusalem 9112102, Israel 6Department of Cellular and Molecular Medicine, University of California, San Diego, La Jolla, CA 92093, USA 7Waitt Advanced Biophotonics Center, The Salk Institute for Biological Studies, La Jolla, CA 92037, USA
Received 3 March 2022, Revised 18 December 2022, Accepted 14 April 2023, Available online 11 May 2023, Version of Record 11 May 2023.
Summary
①ヒトミクログリア(hMG)研究のためのin vivoプラットフォームとしての異種移植脳オルガノイド ②hMGはヒトに特異的なtranscriptome signatureを獲得し、生体内と同様のidentityを持つようになる③hMGがヒトの脳環境を積極的に監視し、局所的な傷害に反応し、全身的な炎症の合図に応答する。 ④患者由来モデルから、自閉症における脳環境誘導型免疫応答が明らかになった。
Keywords
Human microglia, brain organoids, iPSCs, organoid transplantation, microglia surveillance, xenotransplantation, neuro-immune interactions, microglia in vivo identity, autism spectrum disorders
Abstract
ミクログリアは、脳の発達、恒常性維持、疾患において重要な役割を果たす、脳に常駐する特殊なマクロファージである。しかし、これまで、ヒトの脳内環境とミクログリアとの相互作用をモデル化する能力は著しく制限されていた。この限界を克服するために、我々は、生理学的に妥当である血管のある免疫不全ヒト脳オルガノイド(iHBO)モデル内で活動する機能的に成熟したヒトミクログリア(hMG)を研究できるin vivo異種移植アプローチを開発した。その結果、オルガノイド内に存在するhMGは、生体内とよく似たヒト特有のトランスクリプトームシグネチャーを獲得していることが明らかになった。また、in vivo2光子イメージングにより、hMGがヒトの脳環境を積極的に監視し、局所的な傷害に反応し、全身的な炎症の合図に応答することが明らかになった。最後に、今回開発した移植型iHBOは、健康状態や疾患における機能的なヒトマイクログリアの表現型を研究する前例のない機会を提供し、脳の大型化を伴う自閉症患者特異的モデルにおける脳環境誘導型免疫反応に関する実験的証拠を提供することを示す。
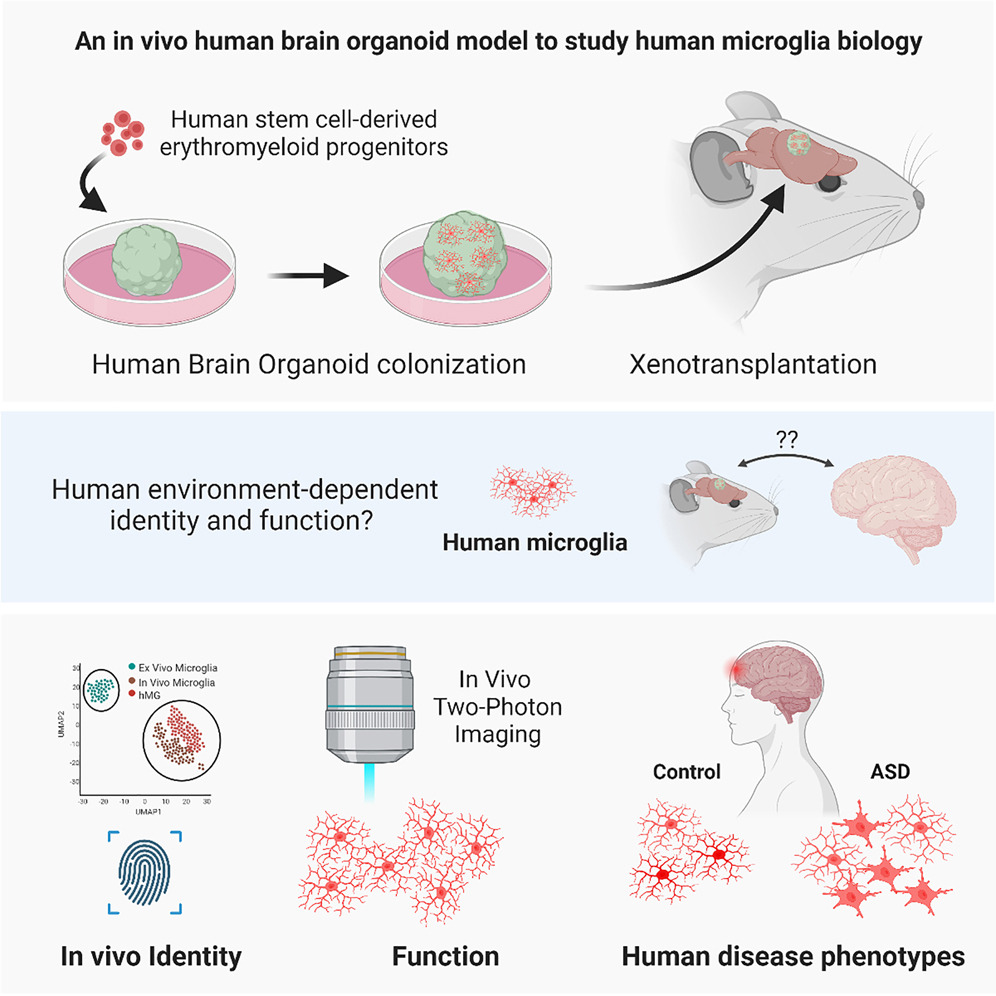
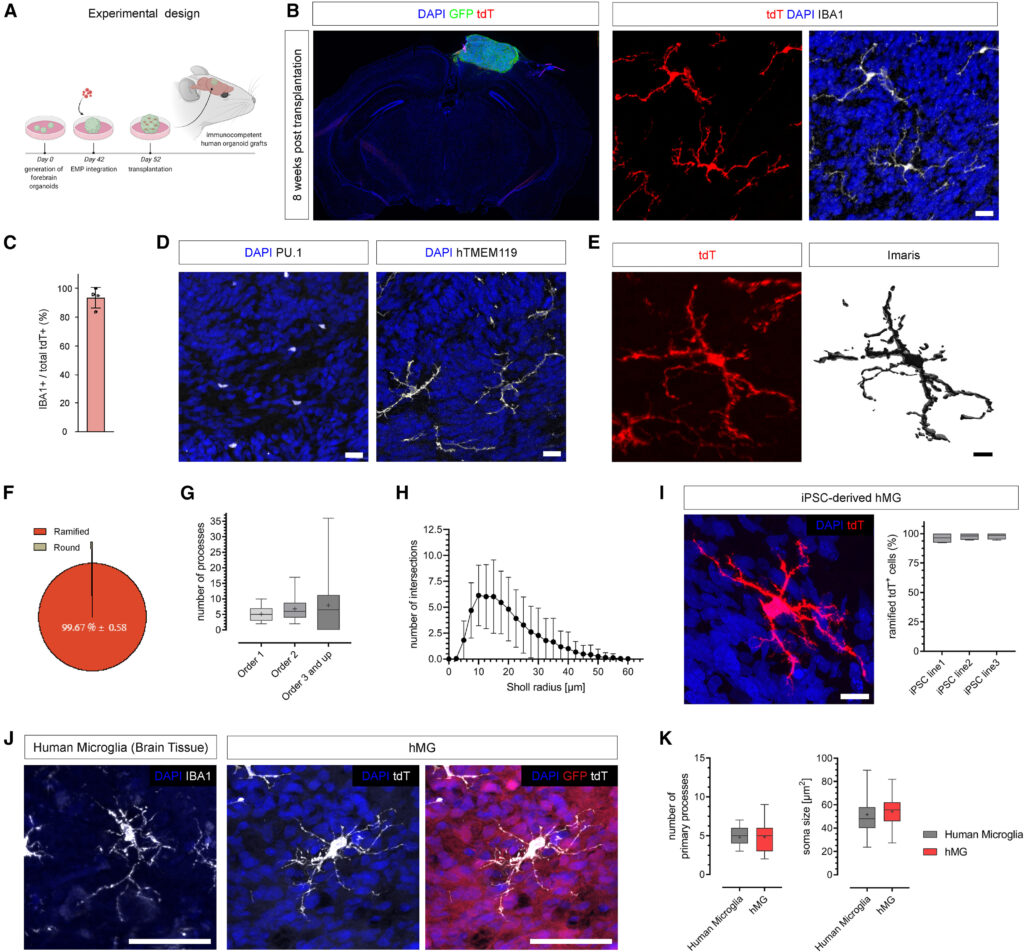
Figure 1. Transplantation permits maturation and long-term survival of human microglia in human brain organoids in vivo
(A) EMP-containing forebrain organoids were transplanted into the retro-splenial cortex of NOD/SCID mice and harvested 8 weeks post transplantation (wpt) for histological characterization.
(B) Left, representative slide scan image showing a coronal brain section grafted with a human organoid (GFP) containing tdT+ cells. Right, representative confocal images showing tdT+ cells that co-express IBA1 at 8 wpt. Scale bar, 20 μm.
(C) Bar graph showing percentages of tdT+ cells expressing the myeloid marker IBA1. Mean ± SD; n = 4 independent transplantation experiments.
(D) Representative images showing presence of cells expressing the myeloid-specific transcription factor PU.1 and the homeostatic human-specific microglia marker TMEM119 at 8 wpt in vivo. Scale bars, 20 μm.
(E) Representative confocal image showing the ramified morphology of an hMG and 3D reconstruction using Imaris. Scale bar, 10 μm.
(F) Pie chart showing relative abundance of microglia morphologies observed at 8 wpt in vivo.
(G) Boxplots showing quantifications of process numbers observed in hMGs at 8 wpt in vivo. Boxplots show median (center line), mean (“+”), and interquartile range (IQR), with whiskers representing the minimum and the maximum. n = 42 cells analyzed.
(H) Sholl plot showing the distribution of process intersections as a measure of cellular complexity. Mean ± SD.
(I) Left, representative confocal image showing the characteristic ramified morphology of an hMG derived from an independent iPSC line at 11 wpt in vivo. Scale bar, 20 μm. Right, bar graph showing percentages of tdT+ cells featuring ramified morphologies as quantified for 3 independent iPSC lines at 11 wpt.
(J) Representative confocal images of human IBA1+ microglia (brain tissue) and tdT+ hMGs at 11 wpt in human brain organoids in vivo. Scale bar, 50 μm.
(K) Boxplots showing the distributions of primary process numbers and soma size of microglia in human brain tissue and hMGs in human brain organoids in vivo. Quantifications were conducted on tissue from 5 independent human subjects and hMGs derived from 3 independent iPSC lines.
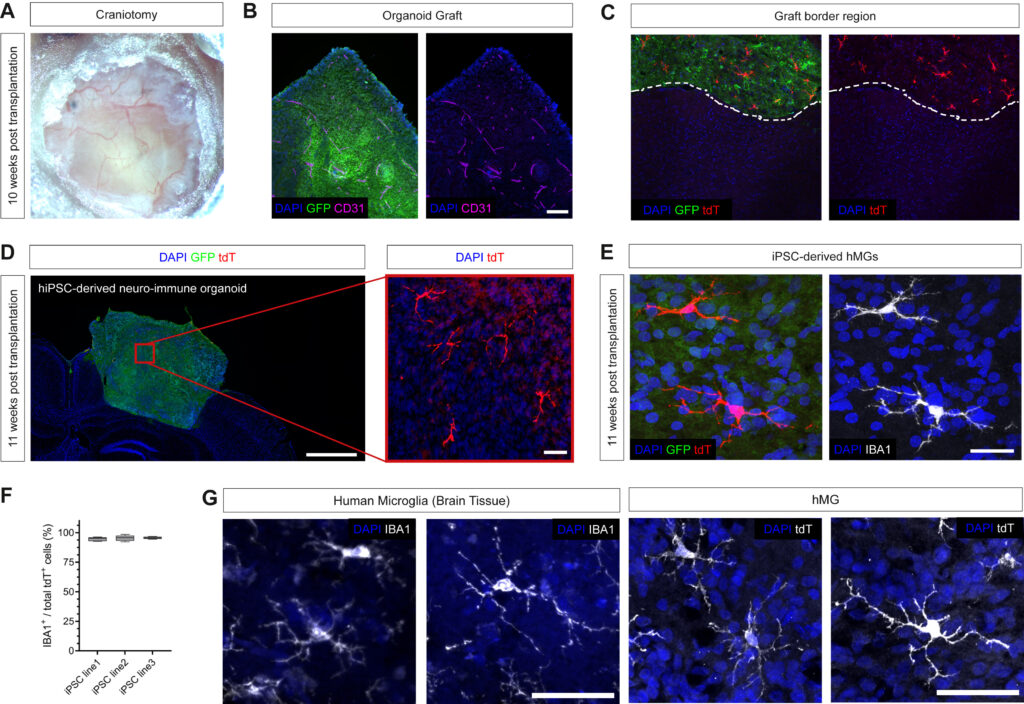
Figure S4. Transplantation of iPSC-derived EMP-containing brain organoids, related to Figure 1
(A) Craniotomy image at 10 wpt.
(B) Representative image showing sufficient infiltration of blood vessels (CD31) in the organoid graft (GFP). Scale bar, 200 μm.
(C) Representative confocal image showing the graft border region. Note that tdT+ cells remain within the GFP+ human graft.
(D) Representative images showing grafted human organoids (GFP) with tdT+ expressing cells at 11 wpt derived from an independent iPSC line. Scale bars, 1 mm (overview, left) and 50 μm (red box, right).
(E) Representative confocal images showing presence of iPSC-derived microglia expressing IBA1 at 11 wpt in vivo. Scale bar, 50 μm.
(F) Quantifications of tdT+ cells expressing IBA1 at 11 wpt as assessed for 3 different iPSC lines. Boxplots show median (center line), mean (“+”), and interquartile range (IQR), with whiskers representing the minimum and the maximum.
(G) Additional confocal images showing human IBA+ microglia (brain tissue) and tdT+ hMGs at 11 wpt in human brain organoids in vivo. Scale bar, 50 μm.
Figure 2. Transcriptomic characterization of hMG identity in vivo
(A) Schematic showing the experimental design. EMP-containing forebrain organoids were grafted into the retro-splenial cortex of NOD/SCID mice and harvested at 11 wpt for profiling tdT+-expressing hMGs using scRNAseq.
(B) UMAP plot of 1,027 tdT+ cells derived from 3 independent iPSC lines profiled that passed quality selection criteria (see Figure S5).
(C) Feature plots showing expression of key microglia genes AIF1, CX3CR1, CSF1R, and CST3 in vivo.
(D) Feature plots showing expression of proliferative marker genes MKI67 and RRM2 in vivo.
(E) Feature plots showing expression of homeostatic microglia genes P2RY12, TMEM119, and SALL1 in hMGs in vivo.
(F) Representative confocal images of hMGs expressing the homeostatic microglia marker P2RY12. Scale bar, 20 μm.
(G) Representative confocal images showing expression of TMEM119 by tdT+ hMGs. Scale bars, 20 μm.
(H) Boxplots showing quantifications of tdT+ cells co-expressing P2RY12 or TMEM119 at 11 wpt for 3 independent iPSC lines. Boxplots show median (center line) and interquartile range (IQR), with whiskers representing the minimum and the maximum.
Discussion
我々は、オルガノイド異種移植のパラダイムを活用した新しいアプローチを開発し、ヒトの脳に似た環境下で機能的なヒトミクログリアを研究することを可能にした。我々の異種移植パラダイムは、もともとネズミの脳に胎児や成体組織を移植するために開発された脳内移植技術を利用したもので、移植された脳オルガノイドに宿主からの血管系を十分に浸潤させることができる。マウスやラットで同様のオルガノイド移植実験を行った最近の研究では、細胞や分子の成熟状態がin vitroオルガノイドと比較して向上することが示された。今回開発したiHBO移植モデルは、長期間生存するhMGを保有し、P2RY12、TMEM119、SALL1などの恒常的なミクログリア特異的マーカーを発現した。時系列的なトランスクリプトームプロファイリングにより、hMGは定義された発生軌道をたどり、免疫感知特性を獲得し、in vivoの対応物に酷似したヒト特有のトランスクリプトームシグネチャーを獲得していることが明らかになった。機能解析の結果、組み込まれたhMGは特徴的な監視機能を果たし、ヒトの脳に似た環境で誘発される傷害に反応することができ、全身性の炎症シグナルに反応することが示された。このように、ヒトの脳のような生体内環境で機能するhMGを得ることができるモデル系を確立した。
ヒトの脳の発達や機能に影響を与える様々な障害に、ミクログリアが関与していることを示唆する証拠が増えつつある。例えば、ASDの子どもたちは、脳のさまざまな領域で継続的な神経炎症プロセスに苦しんでいることが、いくつかの研究によって示されている。この知見には、死後脳およびポジトロンCTから、活性化したミクログリアと調節されたミクログリア関連遺伝子発現シグネチャーを同定した証拠が含まれる。さらに、ASD児の脳およびCSFにおいて、不規則な炎症性サイトカインプロファイルおよび補体因子プロファイルの変化が報告されている。死後組織における現象的な観察を除けば、ヒトの脳の発達過程におけるミクログリアの役割と機能は、被験者固有のニューロン-ミクログリア相互作用を研究できる適切なモデル系がないため、ほとんど未知の領域である。我々の移植したiHBOモデルが提供する利点の一つは、ヒトの脳に似た環境における全身的および局所的な摂動が、in vivoでの数ヶ月間の発達においてhMGクロストークにどのように影響するかを研究することができることである。
ここでは、ASDにおけるヒト脳環境/ミクログリアクロスストークを調査するための患者特異的神経免疫モデルの作成について報告する。我々は、環境によるミクログリア表現型の細胞非自律的な変化に関する最初の実験的証拠を提供し、異常な神経発達過程に対する慢性的かつ初期の新興反応を示すと考えられる。観察された形態学的変化は、プライミングされ、より反応性の高いミクログリア状態と関連しており、ASD患者の死後組織で以前に報告されている。重要なことは、我々の実験により、ミクログリアの反応性におけるこれらの変化が、ミクログリア自身によってではなく、環境によって誘導されることが明らかになったことである。ASDの性差が報告されていることから、ヒトおよび/または宿主の脳環境における性差がこの表現型にどのように寄与しているかを明らかにするために、さらなる研究が必要である。今回開発した新規プラットフォームは、ヒトの神経細胞環境とhMGの機能的相互作用をモデル化するユニークな機会を提供し、発達と疾患における文脈依存的なhMG表現型の役割を明らかにするのに非常に適した技術である。
本研究の限界
本プラットフォームは、ネズミの脳にオルガノイドを移植した先行研究と比較して、いくつかの利点がある。移植戦略は、生体内と同様の条件下でヒトに特異的な神経免疫相互作用を調べるための代替ツールとなり得る。今回の新技術により、ASD発症におけるミクログリアの表現型制御に関する新たな知見を得ることができたが、解析したグループサイズはまだ限定的であり、さらなる研究が必要となっている。さらに、ヒト移植片への宿主細胞の寄与に関する懸念は、調査対象のシステムや細胞タイプを変化させる可能性があるため、これらのモデルを作成する際に考慮する必要がある。したがって、移植片の血管系を構成する成分が完全に宿主から供給されるのか、あるいはヒト細胞からの寄与の可能性があるのかについて、さらなる研究が必要である。今後、より高度なヒトオルガノイドモデルの開発が進めば、ヒトの非神経細胞と神経細胞の相互作用を生体内と同様の条件下で研究する道筋が見えてくるであろう。
