Sci Adv. 2023 Apr 14;9(15):eade2812. doi: 10.1126/sciadv.ade2812. Epub 2023 Apr 14.
Consensus molecular environment of schizophrenia risk genes in coexpression networks shifting across age and brain regions (統合失調症リスク遺伝子の共発現ネットワークにおけるコンセンサス分子環境は、年齢や脳部位を超えて変化する)
Giulio Pergola 1 2 3, Madhur Parihar 1, Leonardo Sportelli 1 2, Rahul Bharadwaj 1, Christopher Borcuk 2, Eugenia Radulescu 1, Loredana Bellantuono 2 4, Giuseppe Blasi 2 5, Qiang Chen 1, Joel E Kleinman 1 3, Yanhong Wang 1, Srinidhi Rao Sripathy 1, Brady J Maher 1 3 6, Alfonso Monaco 4 7, Fabiana Rossi 1 2, Joo Heon Shin 1, Thomas M Hyde 1 3 8, Alessandro Bertolino 2 5, Daniel R Weinberger 1 6 9
1Lieber Institute for Brain Development, Johns Hopkins Medical Campus, Baltimore, MD, USA.
2Group of Psychiatric Neuroscience, Department of Translational Biomedicine and Neuroscience, University of Bari Aldo Moro, Bari, Italy.
3Department of Psychiatry and Behavioral Sciences, Johns Hopkins University School of Medicine, Baltimore, MD, USA.
4Istituto Nazionale di Fisica Nucleare, Bari, Italy.
5Azienda Ospedaliero Universitaria Consorziale Policlinico, Bari, Italy.
6Department of Neuroscience, Johns Hopkins University School of Medicine, Baltimore, MD, USA.
7Dipartimento Interateneo di Fisica, Università degli Studi di Bari Aldo Moro, Bari, Italy.
8Department of Neurology, Johns Hopkins University School of Medicine, Baltimore, MD, USA.
9Department of Genetic Medicine, Johns Hopkins University School of Medicine, Baltimore, MD, USA.
Abstract
Schizophrenia is a neurodevelopmental brain disorder whose genetic risk is associated with shifting clinical phenomena across the life span. We investigated the convergence of putative schizophrenia risk genes in brain coexpression networks in postmortem human prefrontal cortex (DLPFC), hippocampus, caudate nucleus, and dentate gyrus granule cells, parsed by specific age periods (total N = 833). The results support an early prefrontal involvement in the biology underlying schizophrenia and reveal a dynamic interplay of regions in which age parsing explains more variance in schizophrenia risk compared to lumping all age periods together. Across multiple data sources and publications, we identify 28 genes that are the most consistently found partners in modules enriched for schizophrenia risk genes in DLPFC; twenty-three are previously unidentified associations with schizophrenia. In iPSC-derived neurons, the relationship of these genes with schizophrenia risk genes is maintained. The genetic architecture of schizophrenia is embedded in shifting coexpression patterns across brain regions and time, potentially underwriting its shifting clinical presentation.
統合失調症は神経発達性の脳疾患であり、その遺伝的リスクは生涯にわたって臨床現象を変化させることに関連している。我々は、死後のヒト背側前頭前野(DLPFC)、海馬、尾状核、歯状回顆粒細胞における脳内共発現ネットワークにおける統合失調症リスク遺伝子の収束を、特定の年齢層(合計N = 833)ごとに解析して調べた。その結果、統合失調症の基礎となる生物学に前頭前野が早期に関与していることを支持するとともに、年齢区分によって統合失調症リスクの分散を説明できる領域の動的な相互作用が明らかになった(すべての年齢期間をひとまとめにした場合と比較して)。複数のデータソースと論文から、DLPFCの統合失調症リスク遺伝子に富むモジュールにおいて最も一貫して見出されるパートナーである28の遺伝子を同定した。23は、統合失調症との関連がこれまで確認されていないものである。また、iPS細胞由来の神経細胞では、これらの遺伝子と統合失調症リスク遺伝子の関係は維持されている。統合失調症の遺伝的構造は、脳領域や時間を超えて変化する共発現パターンに組み込まれ、その臨床像の変遷を支えている可能性がある。
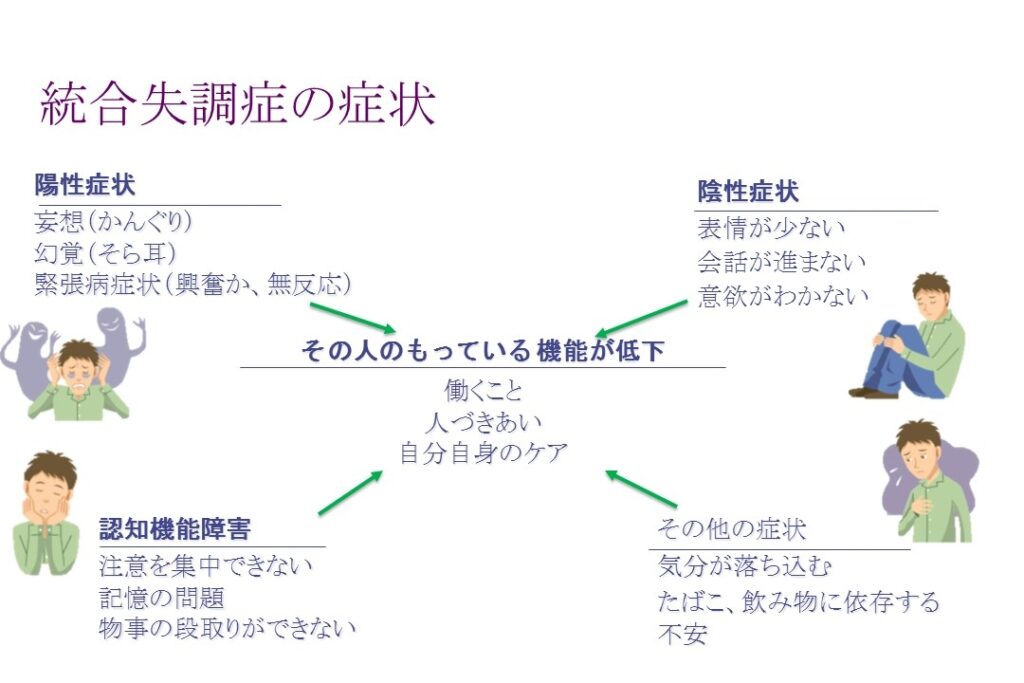
統合失調症の主な特性(厚生労働省websiteより)
- 発症の原因はよくわかっていないが、100人に1人弱かかる、比較的一般的な病気である。
- 「幻覚」や「妄想」が特徴的な症状だが、その他にも様々な生活のしづらさが障害として表れることが知られている。
- 陽性症状:幻覚実態がなく他人には認識できないが、本人には感じ取れる感覚のこと。なかでも、自分の悪口やうわさ、指図する声等が聞こえる幻聴が多い。妄想明らかに誤った内容を信じてしまい、周りが訂正しようとしても受け入れられない考えのこと。誰かにいやがらせをされているという被害妄想、周囲のことが何でも自分に関係しているように思える関係妄想などがある。
- 陰性症状:意欲が低下し、以前からの趣味や楽しみにしていたことに興味を示さなくなる。疲れやすく集中力が保てず、人づきあいを避け引きこもりがちになる。入浴や着替えなど清潔を保つことが苦手となる。など
- 認知や行動の障害考えがまとまりにくく何が言いたいのか分からなくなる。相手の話の内容がつかめず、周囲にうまく合わせることができない。など
https://www.med.nagoya-u.ac.jp/noutokokoro/ippan/
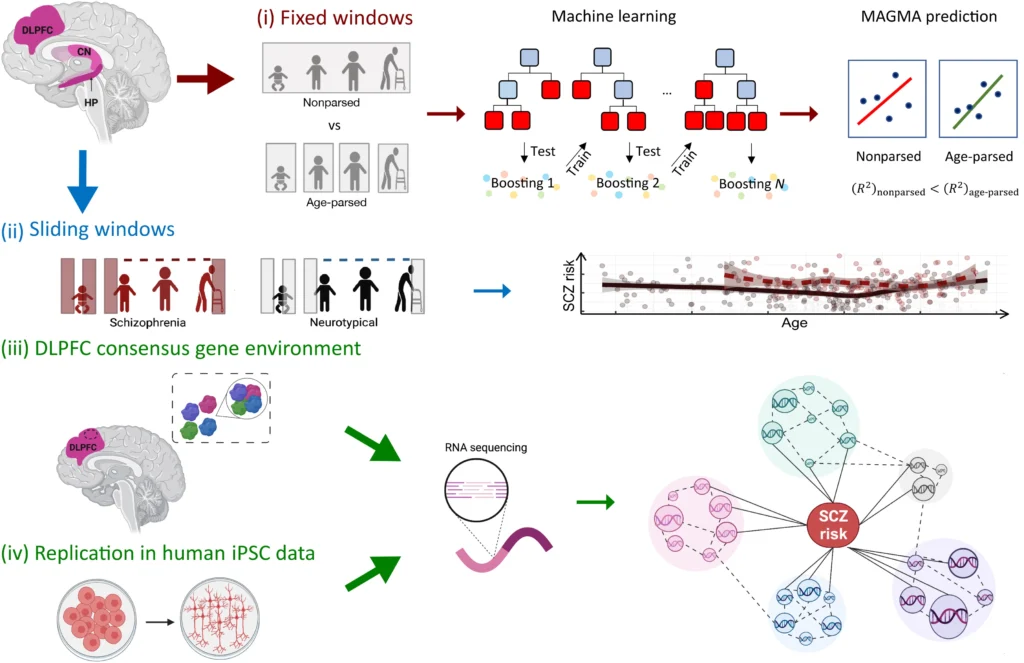
Fig. 1. Graphic summary of the study design.
In this study, we evaluate four hypotheses: (i) Age-parsed networks in neurotypical brains explain more SCZ genetic risk than the same data not age-parsed. (ii) The course of SCZ enrichment differs between NCs and patients with SCZ. (iii) There is a molecular environment to SCZ risk that can be identified by consensus between networks in terms of genes coexpressed with SCZ risk genes. (iv) The consensus genetic environment surrounding SCZ risk genes can be reproduced in vitro to perform cell system studies of coexpression networks relevant to SCZ. CN, caudate nucleus; HP, hippocampus; MAGMA, multimarker analysis of genomic annotation; SCZ, schizophrenia. The figure was created with BioRender.com and Inkscape.
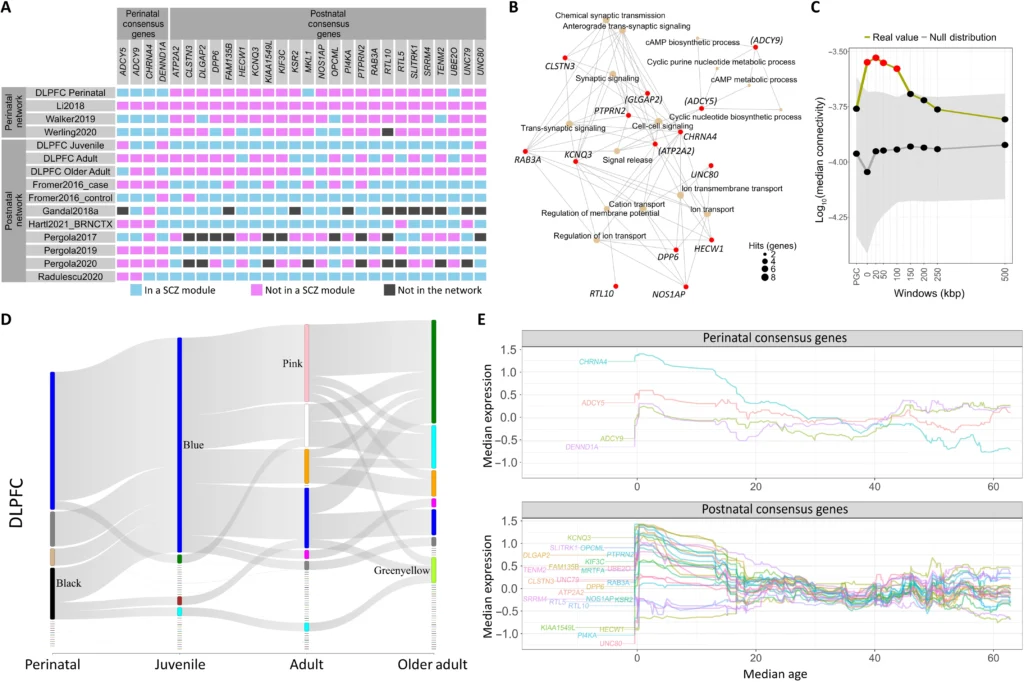
Fig. 9. Consensus genes and their relationship with PGC3 prioritized genes.
(A) Overlap of four perinatal and 24 postnatal consensus genes in the prefrontal networks according to their membership to a SCZ risk module across at least two-thirds of 11 networks. Cyan boxes represent genes in SCZ risk modules. Magenta boxes represent membership to modules not significantly enriched for SCZ. Dark gray boxes represent genes not annotated in that specific network. The figure illustrates how coexpression partners of SCZ risk genes change from perinatal to postnatal stages. (B) Gene-Concept Network (CNet) plot of the top 15 most significant (Padjust < 0.05) associated GO biological processes to postnatal (n = 24) and perinatal (n = 4) consensus genes. Nodes for processes are colored beige. Node size represents the number of hits. Nodes for genes are colored red. Genes also present in the GWAS are marked with round brackets. Only genes that are involved with the top 15 GO biological processes are shown (14 of 28 genes). (C) Connectivity between SCZ risk genes defined at various windows of genomic extension and 22 non-GWAS postnatal consensus genes in an iPSC dataset. Plots show −log10(median gene-wise connectivity) (y axis) of consensus genes to each SCZ gene set (x axis) from an iPSC-derived gene coexpression network. A null distribution of −log10(median gene-wise connectivity) was computed from randomly permuted non-SCZ and nonconsensus genes, after matching for gene set size, GC content, gene length, and average expression (95% CI for the mean in shaded gray). (D) Sankey plot of consensus gene membership across age stages in the DLPFC. Thin nodes not connected by links represent modules containing 200-kbp SCZ risk genes but not consensus genes. (E) Median rank-normalized expression across sliding window samples by age for the four prenatal (top) and 24 postnatal (bottom) consensus genes in the NC DLPFC.Collapse
Discussion
筆者らは、統合失調症SCZの遺伝的リスクを定型発達者の一生の異なる時期に、異なる脳領域で共発現ネットワークに収束することを調査し、SCZリスク遺伝子が年齢とともに共発現パートナーをどのように変化させるか、遺伝的リスクの発症効果を可能にするために特に関連すると考えられる分子環境を特定することを試みた。GWAS上位遺伝子座と全ゲノムリスクを評価した結果、SCZリスクがDLPFCの発達初期の共発現パターンに収束するプロファイルに関する一貫した結果が得られ、次いで若年期の海馬と尾状核が収束することがわかった。本報告の主要な知見は以下の通りである:
1) 年齢別に解析すると、すべての年齢を一つのネットワークにまとめた場合と比較して、SCZの遺伝子重要度スコアの分散をより多く説明できた。
2)SCZのリスク遺伝子は、潜在的な交絡因子と照合したランダムな遺伝子よりも共発現が多く、特に初期段階の背側前頭前皮質DLPFCで特定のモジュールに集まる傾向がある。周産期および幼少期のネットワークでは、成人のネットワークに比べて最大過剰発現が大きいという結果は、SCZリスク遺伝子が若い神経型脳組織で共発現ネットワークに最もよく集まっていることを示唆している。
3) SCZリスク遺伝子は、DLPFCにおいて周産期から若年期にかけてクラスター化する傾向があるが、共発現相手の多くは変化する。この結果は、出生前サンプルのみで再現され、さらに外部データセットでも再現された。このことは、これらのSCZリスク遺伝子は、その分子環境の一部が発達過程で変化しながらも複合的な効果を発揮し続け、年齢に伴う臨床症状の変化を潜在的に支えていることを示唆している。
4) SCZ患者の尾状核から得られたネットワークは、年齢をマッチさせた定型発達者から得られたネットワークよりも、SCZリスク遺伝子の収束性が高い。この効果は、デコンボリューションによって推測される細胞タイプの豊富さでは説明できない。
5) 共発現の年齢変化にもかかわらず、28個の遺伝子のセットは、複数の論文でDLPFCのSCZリスク遺伝子に濃縮されたモジュールに確実に見出されるが、これらの遺伝子の82%はGWASで有意なSCZ遺伝子座にない。これらの非GWAS濃縮関連遺伝子は、少なくともGWAS遺伝子と同様に機能喪失変異に対して不寛容であり、バックグラウンドよりも有意にその傾向が強く、SCZリスクを媒介する一貫した分子環境を示している可能性がある。
6)これらのコンセンサス遺伝子の多くは、周産期で高発現し、iPSC由来のヒト神経細胞でも発現し、SCZリスク遺伝子と相関がある。この証拠から、SCZの生物学的リスクを可能にするこれらの遺伝子の役割を実験的に調査するためのin vitroプラットフォームが示唆された。
これらの知見から、mRNAの共発現は、年齢や脳部位に特異的に位置するSCZ遺伝的リスクの収束を示し、GWASで同定された以上の潜在的に重要な生物学的シグナルを明らかにすることができる。
SCZのリスク遺伝子が共発現経路に収束することは以前から観察されていたが、今回、遺伝子間の関係がlifespan、特に周産期から生後にかけて変化し、おそらく前臨床期から顕在期への重大な移行と並行して、この収束の時空間的次元を特定することができた。年齢解析されたネットワークは、SCZとの潜在的な遺伝子の関連性という点で優れた予測を可能にする。年齢によるSCZリスク遺伝子の収束を細かく定量化したところ、尾状核のデータで特に定型発達型成人とSCZ患者との違いが明らかになった。また、デコンボリューション解析と予測解析により、SCZのリスク遺伝子は周産期と幼少期のDLPFCで特に収束し、変化する文脈で共発現し続けることが示された。これらの結果から、SCZの遺伝的構造は、ライフスパンにおいて脳領域間で変化する共発現パターンに組み込まれていることが明らかになった。この共発現の移り変わりパターンを利用して、GWAS陽性遺伝子と常に共発現している遺伝子群からSCZとの新規関連性を同定した。この遺伝子群は、遺伝的リスクをSCZの生物学的リスクに変換する細胞環境の一部であると考えられ、将来の治療法の開発にこれらの遺伝子が貢献する可能性を調べるためにin vitroモデルで容易に研究できる環境であった。
