
Current Biology ARTICLE
Microtubules self-repair in living cells (微小管は生きた細胞の中で自己修復を行う)
Morgan Gazzola, Alexandre Schaeffer, Ciarán Butler-Hallissey, Karoline Friedl, Benoit Vianay,
Jérémie Gaillard, Christophe Leterrier, Laurent Blanchoin, Manuel Théry
Paris University, INSERM, CEA, Hôpital Saint Louis, Institut Universitaire d’Hematologie, Paris, France.
パリ大学(Université de Paris)は、フランスの公立大学である。1970年以降は第1から第13まで単科大学として運営されてきたが、2008年から一部の大学の離脱や統合計画が実現し始め、第4と第6が合併しソルボンヌ大学に、第9はPSL研究大学に、2019年には第5と第7が合併しパリ大学に、2020年には第11はパリ=サクレー大学に統合され、新しい体制が整えられた。
パリ大学は、ボローニャ大学やオックスブリッジ、サラマンカ大学、モンペリエ大学やトゥールーズ大学などと共に、12〜13世紀に設立されたヨーロッパ最古の部類に入る中世大学の一つで、その起源は1150年 – 1170年までさかのぼる。(Wikepediaより)
Published: December 23, 2022 DOI:https://doi.org/10.1016/j.cub.2022.11.060

Highlights
•Free tubulin dimers can incorporate within the shaft of microtubules in living cells
•Most incorporations were smaller than 700 nm
•On average, incorporations can be detected every 100 μm of microtubule
•They are more frequent where the lateral fluctuations of microtubules are greater
ハイライト
〇遊離したチューブリン2量体は、生細胞内の微小管の軸に取り込まれることができる。
〇ほとんどの組込みは700 nmより小さい
〇平均して、微小管の100μmごとに組み込みが検出できる。
〇微小管の横方向の揺らぎが大きいところでは、より頻繁に検出される。
Graphical Abstract
Summary
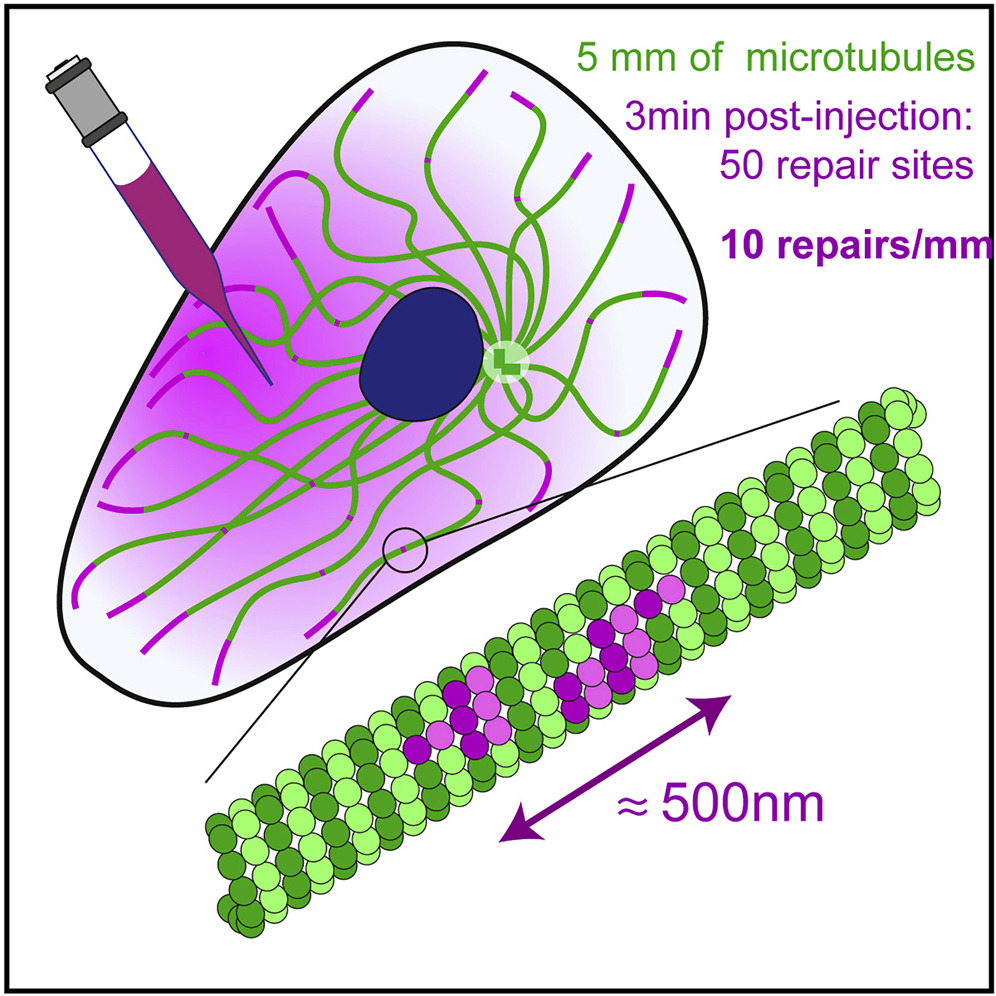
Microtubule self-repair has been studied both in vitro and in vivo as an underlying mechanism of microtubule stability. The turnover of tubulin dimers along the microtubule has challenged the pre-existing dogma that only growing ends are dynamic. However, although there is clear evidence of tubulin incorporation into the shaft of polymerized microtubules in vitro, the possibility of such events occurring in living cells remains uncertain. In this study, we investigated this possibility by microinjecting purified tubulin dimers labeled with a red fluorophore into the cytoplasm of cells expressing GFP-tubulin. We observed the appearance of red dots along the pre-existing green microtubule within minutes. We found that the fluorescence intensities of these red dots were inversely correlated with the green signal, suggesting that the red dimers were incorporated into the microtubules and replaced the pre-existing green dimers. Lateral distance from the microtubule center was similar to that in incorporation sites and in growing ends. The saturation of the size and spatial frequency of incorporations as a function of injected tubulin concentration and post-injection delay suggested that the injected dimers incorporated into a finite number of damaged sites. By our low estimate, within a few minutes of the injections, free dimers incorporated into major repair sites every 70 μm of microtubules. Finally, we mapped the location of these sites in micropatterned cells and found that they were more concentrated in regions where the actin filament network was less dense and where microtubules exhibited greater lateral fluctuations.
微小管の自己修復は、微小管の安定性の基礎的なメカニズムとして、in vitroおよびin vivoで研究されている。微小管に沿ったチューブリン二量体のターンオーバーは、成長端のみが動的であるという既存のドグマを覆すものである。しかし、in vitroでは重合した微小管の軸にチューブリンが取り込まれる明確な証拠があるものの、生細胞でそのような事象が起こる可能性は依然として不明である。そこで本研究では、GFP-tubulinを発現する細胞の細胞質に、赤い蛍光色素で標識した精製チューブリン二量体を微量注入し、この可能性を検討した。その結果、数分以内に既存の緑色の微小管に沿って赤い点が出現することが確認された。この赤い点の蛍光強度は緑のシグナルと逆相関しており、赤い二量体が微小管に取り込まれ、既存の緑の二量体と置き換わったことが示唆された。微小管中心からの横方向の距離は、取り込み部位や成長端と同様であった。注入したチューブリン濃度と注入後の遅延時間の関数として、組み込みのサイズと空間頻度が飽和したことから、注入した二量体は有限の損傷部位に組み込まれることが示唆された。我々の低い見積もりでは、注入後数分以内に、遊離二量体は微小管の70μmごとに主要な修復部位に取り込まれた。最後に、マイクロパターン化した細胞でこれらの部位の位置をマッピングしたところ、アクチンフィラメントネットワークの密度が低く、微小管がより大きな横揺れを示す領域に、より集中的に存在することがわかった。
Keywords
microtubule, lattice, shaft, tubulin, self-repair, renewal, remnants, GTP islands, rescue
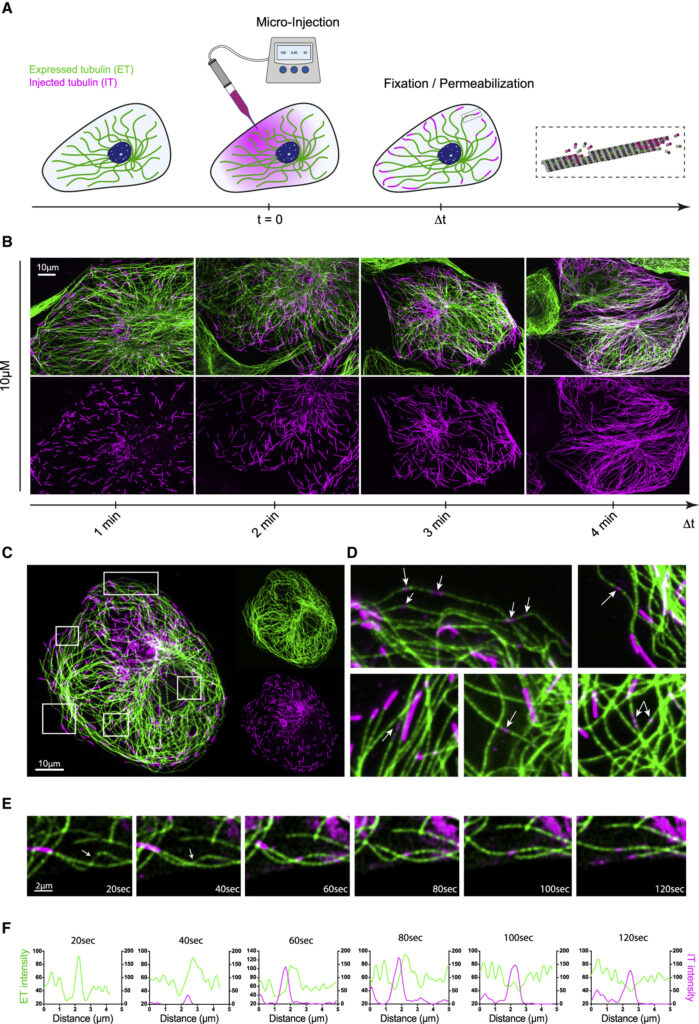
(B) Self-renewal of the microtubule network in PtK2 GFP-tubulin cells injected with 10 μM IT. Z acquisitions were performed and projected on a single image containing the maximal intensity of each pixel. Images show the newly assembled parts of the microtubule network 1, 2, 3, and 4 min post-injection. Scale bars, 10 μm.
(C) A PTK2 GFP-tubulin cell (ET signal is shown in green) microinjected with 10 μM IT (IT signal is shown in magenta). Z acquisitions were performed and projected on a single image containing the maximal intensity of each pixel. Scale bars, 10 μm.
(D) Images correspond to white insets shown in (C). Arrows point at IT patches (small magenta spots) that are localized along pre-existing microtubules (green) at a distance from microtubules growing ends (long magenta stretches).
(E) Images corresponding to the live acquisition of an IT patch appearance on a microtubule in the very edge of a flat cell. The acquisition was made 2–3 min after the injection of 10 μM IT every 20 s for 180 s on a spinning disk confocal microscope.
(F) Fluorescence intensity profiles of the microtubule showing the IT patch over time.
Live acquisition of an IT patch appearance on a microtubule in the very edge of a living PtK2 cell. Images were recorded every 20 seconds for 180 seconds with a 60x oil objective on a spinning disk confocal microscope. https://www.cell.com/current-biology/fulltext/S0960-9822(22)01851-6#%20
