
Cell Resource Available online 31 October 2022
Human prefrontal cortex gene regulatory dynamics from gestation to adulthood at single-cell resolution (単一細胞解像度での妊娠から成人期までのヒト前頭前皮質遺伝子調節ダイナミクス)
Charles A.Herring1,2,10Rebecca K.Simmons1,2,10SaskiaFreytag1,2,10DanielPoppe1,2,10Joel J.D.Moffet1JahnviPflueger12SamBuckberry12Dulce B.Vargas-Landin12OlivierClément12Enrique GoñiEcheverría1Gavin J.Sutton3AlbaAlvarez-Franco4RuiHou1ChristianPflueger12KerrieMcDonald5Jose M.Polo67Alistair R.R.Forrest1Anna K.Nowak8…RyanLister1,2,11
1 Harry Perkins Institute of Medical Research, QEII Medical Centre and Centre for Medical Research, The University of Western Australia (西オーストラリア大学), Perth, WA 6009, Australia
2 ARC Centre of Excellence in Plant Energy Biology, School of Molecular Sciences, The University of Western Australia, Perth, WA 6009, Australia
3 School of Biotechnology and Biomolecular Sciences, Cellular Genomics Futures Institute, and the RNA Institute, University of New South Wales, Sydney, NSW 2052, Australia
4 Centro Nacional de Investigaciones Cardiovasculares Carlos III (CNIC), Madrid 28029, Spain
5 Lowy Cancer Research Centre, University of New South Wales, Sydney, NSW 2052, Australia
6 Adelaide Centre for Epigenetics and the South Australian Immunogenomics Cancer Institute, Faculty of Health and Medical Sciences, The University of Adelaide, Adelaide, SA 5000, Australia
7 Faculty of Medicine, Nursing and Health Sciences, Monash University, Melbourne, VIC 3000, Australia
8 Medical School, University of Western Australia, Perth, WA 6009, Australia
9 University of Melbourne Centre for Cancer Research, Victoria Comprehensive Cancer Centre, Melbourne, VIC 3000, Australia
Received 29 October 2021, Revised 19 July 2022, Accepted 27 September 2022, Available online 31 October 2022.
Ryan Lister

Summary
Human brain development is underpinned by cellular and molecular reconfigurations continuing into the third decade of life. To reveal cell dynamics orchestrating neural maturation, we profiled human prefrontal cortex gene expression and chromatin accessibility at single-cell resolution from gestation to adulthood. Integrative analyses define the dynamic trajectories of each cell type, revealing major gene expression reconfiguration at the prenatal-to-postnatal transition in all cell types followed by continuous reconfiguration into adulthood and identifying regulatory networks guiding cellular developmental programs, states, and functions. We uncover links between expression dynamics and developmental milestones, characterize the diverse timing of when cells acquire adult-like states, and identify molecular convergence from distinct developmental origins. We further reveal cellular dynamics and their regulators implicated in neurological disorders. Finally, using this reference, we benchmark cell identities and maturation states in organoid models. Together, this captures the dynamic regulatory landscape of human cortical development.
ヒトの脳発達は、生後 30 年まで続く細胞および分子の再構成によって支えられている。西オ―ストラリア大学のグループは、神経成熟を調整する細胞ダイナミクスを明らかにするために、妊娠から成人期までの単一細胞解像度で、ヒト前頭前皮質遺伝子発現とクロマチンアクセシビリティをプロファイリングした。統合的な分析により、各細胞タイプの動的な軌跡を定義し、すべての細胞タイプの出生前から出生後の移行における主要な遺伝子発現の再構成を明らかにし、その後、成人期への継続的な再構成を明らかにし、細胞の発達プログラム、状態、および機能を導く調節ネットワークを特定している。発現のダイナミクスと発達のマイルストーンとの間の関連性を明らかにし、細胞が成体のような状態を獲得する多様なタイミングを特徴付け、明確な発生起源から分子的収束(molecular convergence)を同定した。さらに、神経疾患に関与する細胞動態とその調節因子を明らかにする。最後に、このリファレンスを使用して、オルガノイド モデルにおける細胞のアイデンティティと成熟状態のベンチマークを行った。これらを統合し、ヒト大脳皮質発達の動的な制御機構のランドスケープを提示する。
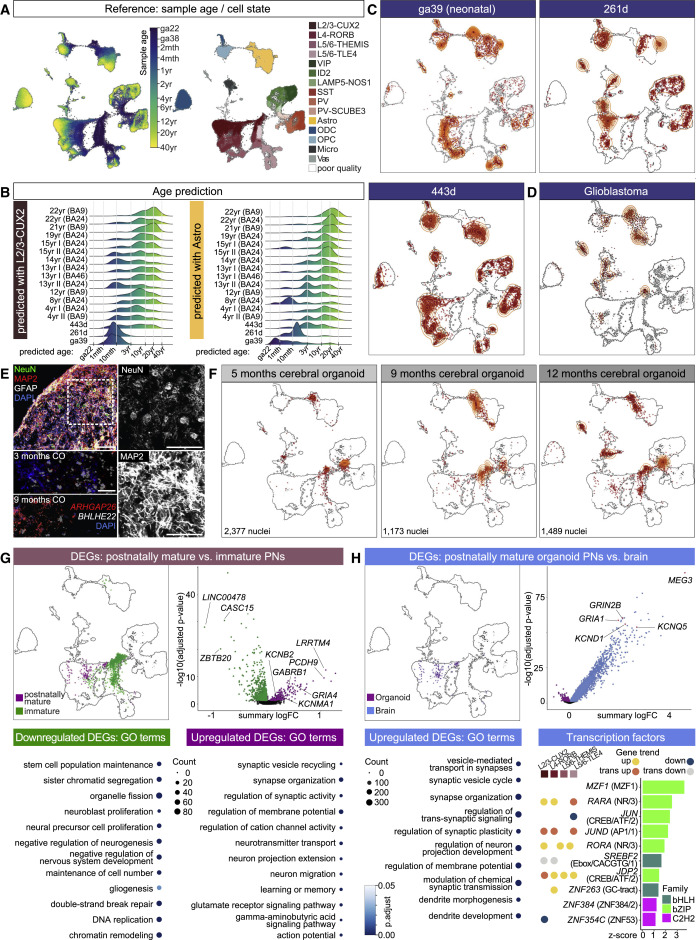
(A) UMAP plot overlaid with sample nuclei age (left) and cell type labels (right).
(B) Distributions of age prediction for query astrocyte and L2/3 PN nuclei from control samples (Velmeshev et al., 2019) and our PFC samples (ga39, and 261 and 443 days).
(C) Projection onto reference of nuclei from snRNA-seq of ga39, and 261- and 443-day samples. Density of points indicated by orange contour lines (as also in D and F).
(D) Projection of glioblastoma snRNA-seq nuclei.
(E) Microscopic images of human cerebral organoids cultured for 9 months, showing astrocytes (GFAP+, white), neuronal nuclei (NeuN+, green), and neuronal dendrites (MAP2+, red) on top left, and detailed views on right. RNAscope in 3- and 9-month-old organoids, detecting BHLHE22 (gray) and ARHGAP26 (red). DAPI counterstain (blue, nuclei). Scale bars, 100 μm.
(F) Projection onto reference of nuclei from snRNA-seq of human cerebral organoids cultured for 5, 9, or 12 months.
(G) Projection of all organoid snRNA-seq indicating location of PNs reaching postnatal maturity versus those that do not (top left). Volcano plot: differentially expressed gene (DEG) analysis between postnatally mature (purple) and immature (green) PNs. Enriched GO terms for upregulated and downregulated DEGs (bottom). See also Table S6C.
(H) Projection of all organoid snRNA-seq indicating location of postnatally mature PNs versus matched nearest neighbors in snRNA-seq data of normal PFC cells (top left). Volcano plot: DEG analysis between postnatally mature PNs in normal brain (blue) and organoids (purple). Enriched GO terms for upregulated DEGs in brain PNs (bottom left). Ranking of TFs upregulated in brain PNs by z score of network connectivity with other upregulated non-TF genes. Left side of plot indicates if TF is a devDEG of an indicated general gene trend. TF family specified in parentheses.
Discussion
本論文では、単一細胞解像度でのヒト PFC 発生全体にわたる遺伝子発現とクロマチン アクセシビリティ ダイナミクスの完全な特徴付けを提供し、重要な発生イベントの分子調査を可能にする。以前はニューロ イメージングと顕微鏡研究を使用してのみ説明されたものもあった(Sydnor et al., 2021)。 大量の脳組織における遺伝子発現の過去の研究では、出生前から出生後の移行での主要な発現変化が示されたが、それらが細胞型特異的な転写調節の違いまたは細胞組成の変化を反映しているかどうかを判断することはできなかった。著者らのアトラスは、個々の脳細胞タイプが、この初期段階に特有の、胎児から出生後の環境への移行に対する実質的かつ特異的な転写変化に反応することを明らかにしている。各神経細胞サブタイプが成人のような転写状態に達するタイミングを特徴付けると、細胞タイプ間の成熟タイミングの驚くべき多様性が明らかになり、サブタイプ固有の機能を発達中の脳活動の出現にリンクするための将来の取り組みに役立つ.重要な遺伝子の分子動力学を、それらが関連する機能的マイルストーンの既知のタイミングに関連付けることにより、脳の発達の分子プロセスを探索するためのこれらのマップの価値を実証した。
著者らの分析は、出生後の皮質の発達と成熟の詳細な特徴付けを提供し、ニューロンサブタイプとその発達の複雑さを明らかにした。 抑制性ニューロンの出現、ダイナミクス、および特異性をチャート化し、これまで理解が不十分なニューロンのサブタイプを検出し、またこれまで知られていなかった発達の起源を解決することにより、これらの発見は、人間の皮質の 抑制性ニューロンの成熟と構成に関する知識を大幅に拡張します。
この発達マップは、原因となる細胞の種類、調節不全の発達ウィンドウ、複数の障害の調節因子など、脳関連障害の理解を深めるための強力なリソースを提供する。筆者らのリファレンスシステムおよび安定した統合技術により、細胞型固有の成熟加速の調査が可能になった。脳の発達と障害のモデル化にますます使用される脳オルガノイドにこのアプローチを適用すると (Sidhaye and Knoblich, 2021; Tian et al., 2020)、現在の状態では、これらは生後発症障害のモデル化には適していない可能性があることが示唆された。脳オルガノイドで調節不全になっている神経細胞の成熟プロセスを調節する 転写調節因子の予測は、ニューロンの成熟を進める上で極めて重要な調節経路を示している。全体として、このリファレンスは、健康と病気における脳細胞の状態とダイナミクスの理解における重要な進歩を構成する。
〇この研究の限界
私たちの研究は妊娠から成人期にまで及びますが、バイオバンクのサンプルが不足しているため、特に妊娠第三期では、完全な時間的範囲をカバーし、サンプル間の変動性を制御することが困難になり、細胞型の変化の解釈が制限されている。性差は 前頭前皮質の成熟に役割を果たしますが、男性は通常、女性よりも実行機能を発達させるのが遅いが、サンプルの入手可能性が限られているため、これを説明できなかった。我々は、速度に基づく軌道法の適用が、速度の頑健性が検証されていない暗黙の理論から外れていることを認識している。We acknowledge that our application of velocity-based trajectory methods is outside the implied theory, where the robustness of velocity is untested.
〇コアラのおしりを徹底解剖!―神経分布から筋を特定・前世紀以来の解剖記述不一致を解消―
研究者のコメント
「「コアラ」と言われれば、たいていの人はその姿を脳裏に思い浮かべることができるのではないでしょうか?しかし、その皮の下に一体どんな筋肉がどのように存在しているのか。コアラの解剖学がここ100年ほど、ほとんど更新されていないことは、ほとんどの方がご存知ないはずです(だからこそ100年近くも放置されていました)。最新の機器やツールが次々に発表され技術革新の著しい世の中ですが、生物を知るための基本はその形を丁寧に観察・記述することだと我々は考えています。」(東島沙弥佳)
