
Developmental dynamics of the postsynaptic proteome to understand synaptic maturation and dysmaturation (シナプス後部のプロテオームの発生動態から、シナプスの成熟と成熟不全を理解する)
Takeshi Kaizuka, Takehiro Suzuki, Noriyuki Kishi, Manfred W Kilimann, Takehiko Ueyama, Masahiko Watanabe, Hideyuki Okano, Naoshi Dohmae, Toru Takumi
doi: https://doi.org/10.1101/2022.05.05.490828
Laboratory for Mental Biology, RIKEN Brain Science Institute, Wako, Saitama, 351-0198, Japan
bioRxiv: bioRxivは、2013年に開始された生物学のプレプリントリポジトリである。プレプリントであるので、bioRχivが提供する論文は査読されていない。正式な表記はbioRχivで、χはエックスではなくギリシャ文字のχである。コールド・スプリング・ハーバー研究所 が運営している。(Wikipedia)
Abstract
The postsynaptic density (PSD) is a protein condensate composed of ~1,000 proteins beneath the postsynaptic membrane of excitatory synapses. The number, shape, and plasticity of synapses are altered during development. However, the dynamics of synaptic protein composition across development have not been fully understood. Here we show alterations of PSD protein composition in mouse and primate brains during development. Proteins involved in synapse regulation are enriched in the differentially expressed (288 decreased and 267 increased) proteins on mouse PSD after a 2-week-old. We find that the changes in PSD protein abundance in mouse brains correlate with gene expression levels in postnatal mice and perinatal primates. This alteration of PSD composition is likely to be defective in the brains of mouse models or patients with autism spectrum disorder (ASD). Finally, we demonstrate that the brain of the common marmoset (Callithrix jacchus) changes PSD composition after the juvenile period. The alteration of PSD composition after 2-month-old is distinct from that observed in mice. Our results provide a comprehensive architecture of the remodeling of PSD composition across development, which may explain the molecular basics of synapse maturation and the pathology of psychiatric disorders, such as ASD.
シナプス後肥厚(postsynaptic density)は、興奮性シナプスのシナプス後膜の下にある約1,000個のタンパク質からなるタンパク質凝集体である。シナプスの数、形、可塑性は、発生過程で変化する。しかし、発生過程におけるシナプスのタンパク質組成のダイナミクスは十分に理解されていない。この研究で筆者らは、マウスと霊長類の脳におけるPSDタンパク質の組成が、発生過程で変化することを明らかにした。2週齢以降のマウスPSDでは、シナプスの制御に関わるタンパク質が豊富に発現していた(288個が減少、267個が増加)。マウス脳におけるPSDタンパク質量の変化は、生後間もないマウスや周産期の霊長類における遺伝子発現量と相関していることを見出した。このPSD組成の変化は、自閉症モデルマウスや自閉症スペクトラム障害(ASD)患者の脳で欠陥がある可能性が高い。最後に、我々はコモンマーモセット(Callithrix jacchus)の脳が幼年期以降にPSD組成を変化させることを実証している。生後2ヶ月以降のPSD組成の変化は、マウスで観察されたものとは異なるものである。この結果は、シナプス成熟の分子的基盤やASDなどの精神疾患の病態を説明できる可能性がある。
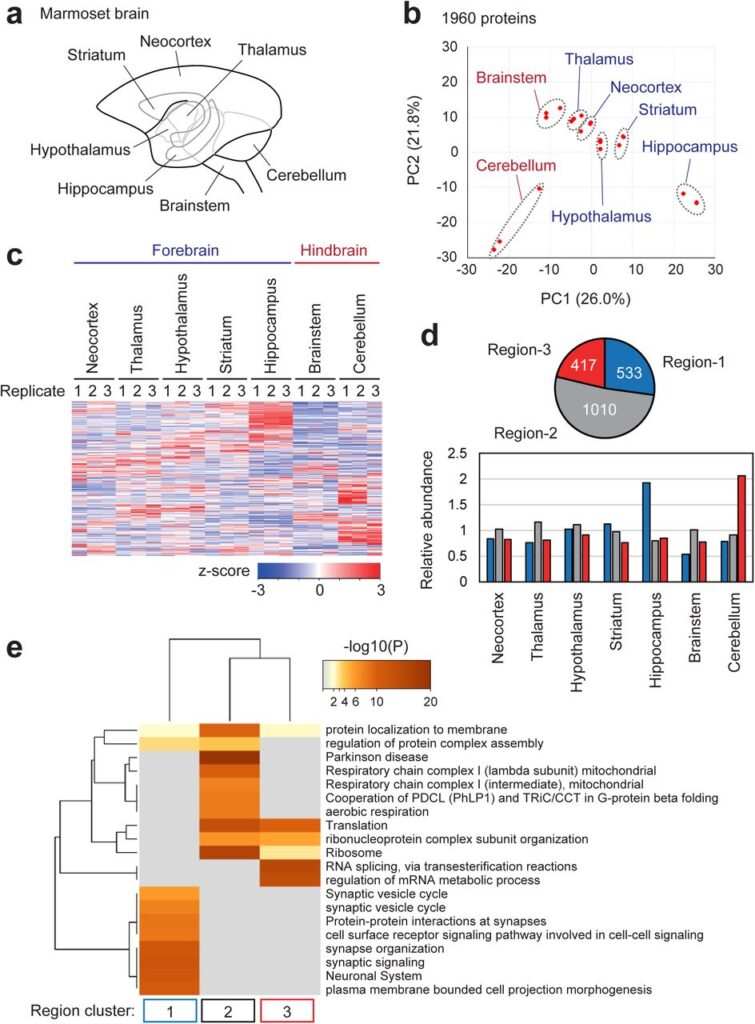
図6. マーモセットの脳領域におけるPSDプロテオーム組成の特徴
(a)マーモセットの7つの脳領域。 (bとc)成体(24ヶ月齢)のマーモセットの個々の脳領域から調製したPSDサンプルをLC-MS/MSに供し、ラベルフリー定量を行った。1,960個のタンパク質の相対存在量を用いてPCAを行った(b)。各タンパク質の相対存在量をヒートマップで示した(c)。(d)タンパク質の平均存在量に基づいたk-meansクラスタリングを用いて、PSD上のタンパク質のクラスターを同定した。(上) 円グラフは同定された各クラスタに含まれるタンパク質の数を示す。(下)各クラスタ内のタンパク質の発現プロファイル(相対存在量の平均)。(e)Metascapeによって同定された各クラスタに統計的に濃縮されたGene Ontology用語とパスウェイ用語。上位20用語は階層的にクラスタ化されたヒートマップとして表示される。ヒートマップのセルはP値で色分けされており、グレーのセルは対応するタンパク質リストでその用語が濃縮されていないことを示している。
Discussion
本研究では、生後マウスとマーモセットの脳において、シナプスの成熟に伴ってPSDの構成が変化することを明らかにした。包括的なバイオインフォマティクス解析により、このPSDリモデリングの上流メカニズムと下流イベントの可能性が明らかになった。特に、生後発達における霊長類の脳におけるPSD組成の変化については、本研究が初めてである。今回得られたプロテオームデータセットは、生後発達における霊長類の脳におけるシナプスの変化、特にシナプスの刈り込みの分子メカニズムの理解に役立つだろう。これまでの報告におけるシナプス数の観察を考慮すると、シナプスの刈り込みは、マウスの脳と比較して、出生後の霊長類の脳でより顕著に起こっている可能性がある。生後発達の過程で存在量が著しく変化するマーモセットPSDのタンパク質には、霊長類の脳におけるシナプス刈り込みを制御する重要なタンパク質が含まれている可能性がある。
しかし、マーモセットPSDのプロテオームデータセットの限界に注意する必要がある。第一に、我々は各年齢につき1匹のマーモセットしか使用していない。ここで述べたPSD組成の発達による変化には個体差が含まれる可能性がある。第二に、3段階法で得られた粗製PSD画分を使用したため、本物のPSD構成成分ではない汚染タンパク質が含まれていた。第三に、我々は2ヶ月未満のマーモセットを分析していない。これらの問題は、これらのデータセットの解釈において考慮されるべきである。
PSD上のタンパク質をコードする遺伝子の上流に特異的な転写制御因子が同定されたことで、その制御メカニズムが説明できるかもしれない。ChIP-seqデータを参照すると、BRD4は「A1を減少させる」遺伝子に濃縮されているが、「A1を増加させる」遺伝子にはあまり濃縮されていないことが示された(図4d)。BRD4は、神経細胞の発生と機能に関与する転写因子である82。一方、転写抑制因子RESTは「増加A1」遺伝子にのみ濃縮されている(図4d)。出生前の時期(https://hbatlas.org/)におけるREST発現のダウンレギュレーションが、「増加A1」遺伝子のアップレギュレーションとその後のPSD組成の成熟に関与している可能性がある。
また、PSDの構成とASDの間に潜在的な関係があることもわかった。ASDモデルマウスのプロテオームデータとASD患者の脳のトランスクリプトームデータの解析から、ASD患者の脳ではPSDの組成が「未熟」であることが示唆された(図5)。3週齢における野生型マウスと15q重複マウスのPSD組成の差は比較的小さいことがわかったが、異なるステージで観察されるシナプス表現型の違いを考慮すると、より重大な欠陥が他の発達段階で検出される可能性がある73。PSD組成の発達的変化は、シナプスの成熟に関連する複数のシグナル伝達経路に影響を与える可能性があるため(図2d-f)、ASD患者やモデル動物では、これらのシグナルもシナプス表現型の原因に関与している可能性がある。例えば、Fmr1 KOマウス(FXSのモデル)83ではrhoファミリーGTPaseシグナル伝達の亢進が観察され、シナプスのシグナル伝達が未熟であることが示唆されている。
ASD患者において、PSD上のタンパク質をコードする遺伝子の発現が変化するメカニズムは何か?一つの原因として、ASDの発症機序と考えられている神経細胞の興奮と抑制のバランス(E/Iバランス)の異常が考えられる69,84。E/Iバランスの異常は、遺伝子発現パターンの変化を引き起こす可能性がある。神経細胞の過剰興奮は遺伝子発現パターンの未熟化を引き起こし、ASD、SCZ、AD85を含む様々な精神神経疾患に関与していることが報告されている。Muranoらは、未熟性に関連する遺伝子をhiI(hyper-excitation-induced immaturity-related)遺伝子とhiM(hyper-excitation-induced maturity-related)遺伝子と呼んでいる。我々は、「減少A1」の117遺伝子のうち17遺伝子がマウスhiI遺伝子によってコードされており、「増加A1」の164遺伝子のうち36遺伝子がマウスhiM遺伝子によってコードされていることを見いだした。重複する遺伝子(減少A1-hiI遺伝子と増加A1-hiM遺伝子)には、17のタンパク質をコードする遺伝子が含まれており、それを補足表2にまとめた。Kalrn、Rapgef2、Lgi1、Grm1、Camk2a、Camkk2、Itpr1を含むこれらの17遺伝子は「増加A1」とhiM遺伝子に属し、Arf6とMapk8は「減少A1」とhiI遺伝子に属する(補足表1、2)85。このことは、過興奮がPSDタンパク質組成の未熟さの一因となり、未熟な特性を持つシナプスをもたらす可能性があることを示唆している。このことは、ASD患者や他の精神神経疾患患者において、興奮過多が誘発するシナプスの未成熟を説明できるかもしれない。
ASD患者における遺伝子発現の変化のもう一つの可能なメカニズムは、遺伝子の上流制御因子の破壊である(図4e、Extended Data Fig.) 例えば、「減少A1」遺伝子のプロモーター配列に結合するBRD4がASDに関与している可能性がある。Fmr1 KOマウスでは、BRD4タンパク質の発現が上昇している。BRD4を阻害すると、転写プロファイルが回復し、Fmr1 KOマウスにおける過剰な樹状突起スパイン形成と異常な社会的行動が回復する86。BRD4を介した「減少」A1遺伝子のアップレギュレーションは、PSD構成の未熟化を引き起こし、ひいてはシナプス異常や行動異常を引き起こす可能性がある。一方、「増加」A1遺伝子の周囲に結合部位が濃縮されているEGR2は、神経発達障害レット症候群の原因遺伝子であるMECP2の共同調節因子である(Extended Data Fig.) もしそうであれば、これらのタンパク質は、PSDタンパク質組成の再変性を通じてシナプス表現型を改善するASDの治療ターゲットとして考えられる。
