Article Open Access Cell Research volume 32, pages157–175 (2022)
Published: 17 November 2021
An App knock-in rat model for Alzheimer’s disease exhibiting Aβ and tau pathologies, neuronal death and cognitive impairments (Aβおよびタウの病状、神経細胞死および認知障害を示すアルツハイマー病のAppノックインラットモデル)
Keliang Pang, Richeng Jiang, Wei Zhang, Zhengyi Yang, Lin-Lin Li, Makoto Shimozawa, Simone Tambaro, Johanna Mayer, Baogui Zhang, Man Li, Jiesi Wang, Hang Liu, Ailing Yang, Xi Chen, Jiazheng Liu, Bengt Winblad, Hua Han, Tianzi Jiang, Weiwen Wang, Per Nilsson, Wei Guo & Bai Lu
- School of Pharmaceutical Sciences, IDG/McGovern Institute for Brain Research, Tsinghua University-Peking University Joint Center for Life Sciences, Tsinghua University, Beijing, China
- R&D Center for the Diagnosis and Treatment of Major Brain Diseases, Research Institute of Tsinghua University in Shenzhen, Shenzhen, Guangdong, China
- Beijing Tiantan Hospital, Advanced Innovation Center for Human Brain Protection, Capital Medical University, Beijing, China
Abstract
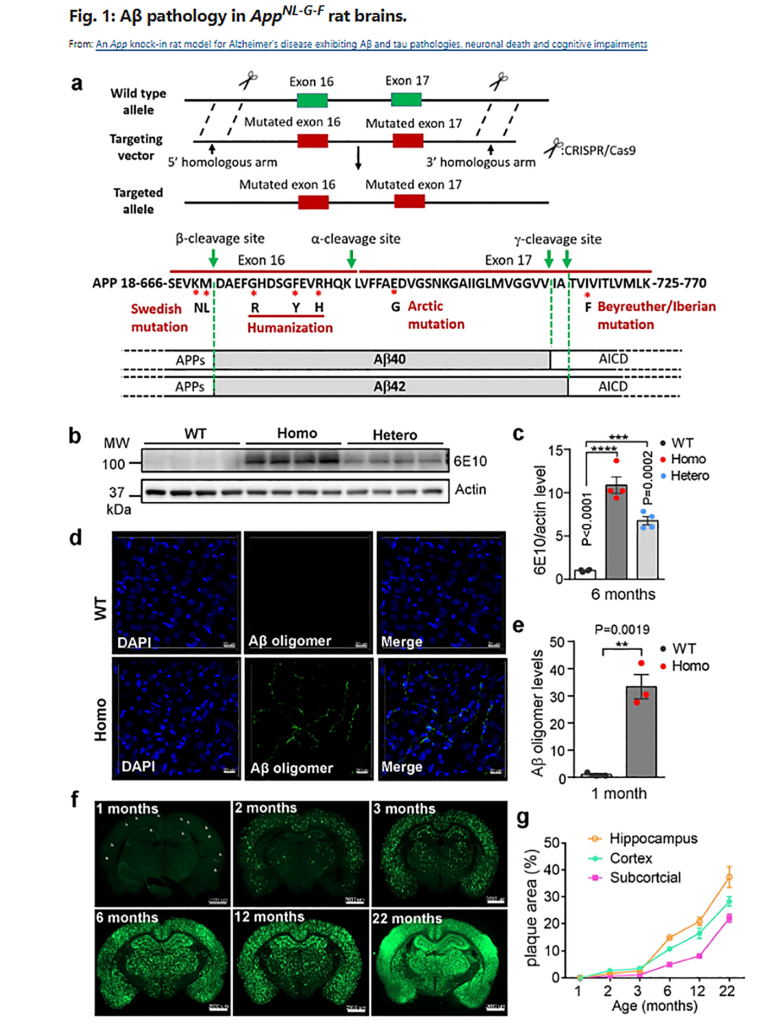
A major obstacle in Alzheimer’s disease (AD) research is the lack of predictive and translatable animal models that reflect disease progression and drug efficacy. Transgenic mice overexpressing amyloid precursor protein (App) gene manifest non-physiological and ectopic expression of APP and its fragments in the brain, which is not observed in AD patients. The App knock-in mice circumvented some of these problems, but they do not exhibit tau pathology and neuronal death. We have generated a rat model, with three familiar App mutations and humanized Aβ sequence knocked into the rat App gene. Without altering the levels of full-length APP and other APP fragments, this model exhibits pathologies and disease progression resembling those in human patients: deposit of Aβ plaques in relevant brain regions, microglia activation and gliosis, progressive synaptic degeneration and AD-relevant cognitive deficits. Interestingly, we have observed tau pathology, neuronal apoptosis and necroptosis and brain atrophy, phenotypes rarely seen in other APP models. This App knock-in rat model may serve as a useful tool for AD research, identifying new drug targets and biomarkers, and testing therapeutics.
アルツハイマー病(AD)研究の主な障害は、病気の進行と薬効を反映する予測可能で翻訳可能な動物モデルがないことである。アミロイド前駆体タンパク質(App)遺伝子を過剰発現するトランスジェニックマウスは、脳内でAPPとその断片の非生理学的および異所性発現を示すが、これはAD患者では観察されない。 Appノックインマウスはこれらの問題のいくつかを回避したが、タウの病理や神経細胞死を示さない。 3つの主要なApp変異とヒト化Aβ配列をラットApp遺伝子にノックインし、ラットモデルを生成しました。全長APPおよび他のAPPフラグメントのレベルを変更することなく、このモデルは、ヒト患者と同様の病状および疾患進行を示す。すなわち関連する脳領域へのAβプラークの沈着、ミクログリアの活性化および神経膠症、進行性シナプス変性およびAD関連の認知障害である。さらに興味深いことに、本モデルでは、タウの病理、ニューロンのアポトーシス、ネクロトーシス、脳の萎縮を観察された。このAppノックインラットモデルは、AD研究、新薬の標的とバイオマーカーの特定、治療法のテストに役立つツールとなる可能性がある。
概要
〇本論文では、新しいアルツハイマー病 ( AD ) モデル動物 ( ラット ) の開発が報告されています。
このADモデルラット ( APP<NL-G-F>ラット ) は、同様の遺伝子改変操作によって作成され、現在広く用いられているADモデルマウス ( APP<NL-G-F>マウス ) と比較して、よりヒトAD患者に近い病理を示すとのことです。
〇具体的には、ヒトAD患者に見られるがAPP<NL-G-F>マウスには見られない「微小管タンパク質タウの過剰リン酸化」「神経細胞死」という二つの特徴を、APP<NL-G-F>ラットは再現できたと書かれています。
〇このことから筆者らは、今後のAD研究において、APP<NL-G-F>ラットはAPP<NL-G-F>マウスに取って代わる存在であると結論付けています。
〇また、今後の展望として、オミクス技術を用いた網羅的解析について言及しています。
APP<NL-G-F>ラットと、ヒトAD患者 ( あるいはAPP<NL-G-F>マウス ) のトランスクリプトーム・プロテオーム・メタボローム動態を比較することは、マウスモデル主流の現在のAD研究に予想外の知見を提供するかもしれません。
*体育専門学群のKさんが話題提供してくれました。