The EMBO Journal (2022)e108899
Manatsu Morikawa, Nivedita U Jerath, Tadayuki Ogawa, Momo Morikawa, Yosuke Tanaka, Michael E Shy,
Stephan Zuchner, Nobutaka Hirokawa
1Department of Cell Biology and Anatomy, Graduate School of Medicine, The University of Tokyo, Tokyo, Japan
2Department of Neurology, Carver College of Medicine, University of Iowa, Iowa City, IA, USA
3Neuromuscular Division, AdventHealth Orlando, Winter Park, FL, USA
4Research Center for Advanced Medical Science, Dokkyo Medical University, Mibu, Japan
5Department of Anatomy and Neuroscience, Faculty of Medicine, University of Tsukuba, Tsukuba, Japan
6Department of Human Genetics and Hussman Institute for Human Genomics, Miller School of Medicine, University of Miami, Miami, FL, USA
Abstract
The mechanochemical coupling of ATPase hydrolysis and conformational dynamics in kinesin motors facilitates intramolecular interaction cycles between the kinesin motor and neck domains, which are essential for microtubule-based motility. Here, we characterized a charge-inverting KIF1A-E239K mutant that we identified in a family with axonal-type Charcot-Marie-Tooth disease and also in 24 cases in human neuropathies including spastic paraplegia and hereditary sensory and autonomic neuropathy. We show that Glu239 in the β7 strand is a key residue of the motor domain that regulates the motor-neck interaction. Expression of the KIF1A-E239K mutation has decreased ability to complement Kif1a+/– neurons, and significantly decreases ATPase activity and microtubule gliding velocity. X-ray crystallography shows that this mutation causes an excess positive charge on β7, which may electrostatically interact with a negative charge on the neck. Quantitative mass spectrometric analysis supports that the mutation hyper-stabilizes the motor-neck interaction at the late ATP hydrolysis stage. Thus, the negative charge of Glu239 dynamically regulates the kinesin motor-neck interaction, promoting release of the neck from the motor domain upon ATP hydrolysis.
キネシンモーター*におけるATPase加水分解とコンフォメーションダイナミクスのメカノケミカルカップリングは、微小管ベースの運動に不可欠なキネシンモーターとネックドメイン間の分子内相互作用サイクルを促進する。本研究で、著者らは軸索型シャルコー・マリー・トゥース病の家族で、また痙性対麻痺や遺伝性感覚性自律神経障害を含むヒト神経障害の24例で同定した、電荷反転KIF1A-E239K変異体の特徴を明らかにした。著者らは、β7鎖のGlu239がモーターネック相互作用を調節するモータードメインの重要な残基であることを示した。 KIF1A-E239K変異の発現は、Kif1a +/-ニューロンを補完する能力を低下させ、ATPase活性と微小管滑走速度を大幅に低下させます。 X線結晶学は、この突然変異がβ7に過剰な正電荷を引き起こし、それが首の負電荷と静電的に相互作用する可能性があることを示している。定量的質量分析は、変異がATP加水分解後期のモーターネック相互作用を相互作用を過剰に安定化させることが確認された。したがって、Glu239の負電荷は、キネシンのモーターとネックの相互作用を動的に制御し、ATP加水分解時にモータードメインからのネックの解放を促進することが明らかになった。
*キネシンとは、真核生物の細胞質中に含まれるモータータンパク質の一種。酵母からラット、ヒトを含め広く存在するタンパク質の一群で、この中では最初に発見された conventional kinesin (遺伝子名kinesin-1)の研究がもっとも盛んに行われている。キネシンは主にATPを加水分解しながら微小管に沿って運動する性質を持ち、細胞分裂や神経軸索輸送などの細胞内物質輸送に重要な役割を果たしている。(Wikipedia)
Synopsis (概略)
KIF1A-mediated axonal transport is driven by interaction cycles between the kinesin’s motor and neck domains. Characterization of a KIF1A mutant identified in a family with Charcot-Marie-Tooth disease reveals that dynamic dissociation of the motor-neck interaction via the β7 domain is essential for neuronal function.
・A familial charge-inverting KIF1A-E239K variant is associated with axonal-type Charcot-Marie-Tooth disease and other cases of human neuropathies.
・KIF1A-E239K exhibits impaired ability to complement Kif1a+/– neurons.
・Mutant KIF1A shows significantly reduced velocity and ATPase activity.
・Excess positive charge on the β7 strand caused by E239K mutation electrostatically interacts with a negative charge on the neck.
・E239K mutation hyper-stabilizes motor-neck interaction in a late ATP hydrolysis state, leading to a delay in the ATPase cycle.
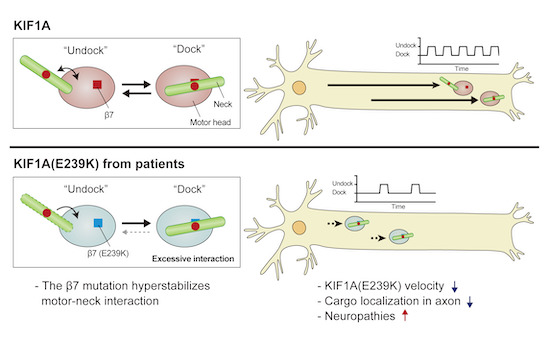
KIF1Aを介した軸索輸送は、キネシンのモータードメインとネックドメインの相互作用サイクルによって駆動されている。シャルコー・マリー・トゥース病の家族に存在するKIF1A変異体の解析から、β7ドメインを介したモーター-ネック相互作用の動的な解離が神経細胞の機能に必須であることが明らかになった。
・家族性電荷逆転型KIF1A-E239K変異体は、軸索型シャルコー・マリー・トゥース病やその他のヒト神経疾患の症例と関連があることが明らかになった。
・KIF1A-E239KはKif1a+/-神経細胞に対する補体形成能に障害を示す。
・変異型KIF1Aは、速度とATPase活性が著しく低下している。
・E239K変異によるβ7鎖上の過剰な正電荷がネック上の負電荷と静電的に相互作用している。
・E239K変異はATP加水分解が遅れた状態でモーターとネックの相互作用を過安定化させ、ATPaseサイクルの遅延をもたらす。
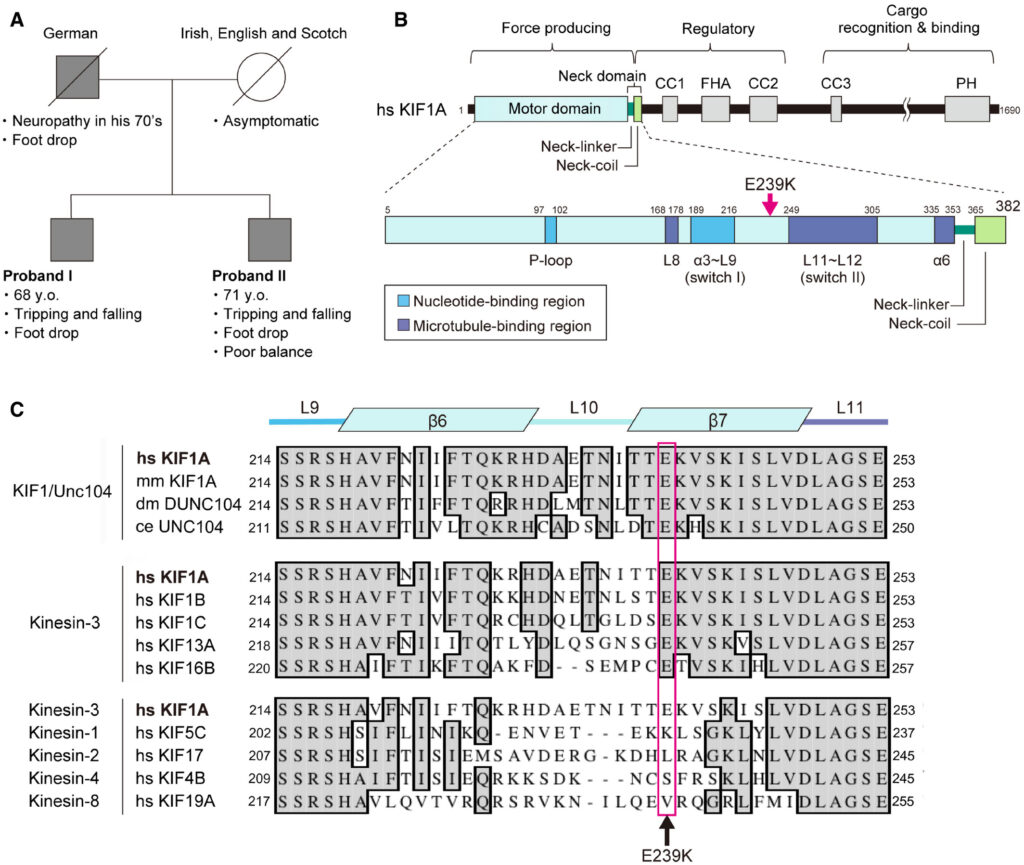
Figure 1. A neuropathy-related mutation identified in the KIF1A gene
- Family pedigree of CMT2 patients. The probands I and II were genetically confirmed to carry the p.E239K variant in KIF1A. Their father also had foot drop symptoms and was clinically diagnosed with neuropathy in his 70s, while their mother was asymptomatic.
- Domain architecture of human KIF1A showing the position of the E239K mutation. KIF1A is composed of a motor domain, neck-linker, and neck-coil in the N-terminal force producing region, a regulatory domain in the middle, and a cargo recognition and binding domain in the C-terminal region.
- Multiple sequence alignment showing amino acids 214–253 of human KIF1A. E239 is located at β7 and is highly conserved in kinesin-3 members throughout evolution. hs, Homo sapiens; mm, Mus musculus; dm, Drosophila melanogaster; ce, Caenorhabditis elegans.
Discussion
本研究では、KIF1Aの神経因性E239K変異体が、モーターと首の相互作用を過安定化し、その結果、運動速度が低下することを新たに明らかにした。これらのデータは、モーターとネックの相互作用の解離段階もキネシンのモーターサイクルにとって重要であるという説得力のある証拠から、なぜモーターと首の相互作用が機械的な力生成のためにモーター速度に「コスト」をかけるのかについて初めて答えるものである。このように、神経病理学的なキネシン変異の原子レベルでの特徴づけは、キネシンのメカノカップリングサイクルに関するメカニズム的な洞察をもたらすものであった。また、β7-ネック結合の適切な解離動態の生理的関連性を初めて明らかにし、キネシン関連神経疾患の多角的理解に深く寄与するものと考えられる。

“Journal Club (February 21, 2022)” への2件のフィードバック