本日は、新医学専攻の高田拓弥が以下の論文を紹介しました。自宅からZOOMを用いての参加です。研究活動を早期に再開できるのを期待しています。
- Nature Communications
- Published:
Lupus autoantibodies act as positive allosteric modulators at GluN2A-containing NMDA receptors and impair spatial memory
ループス自己抗体はGluN2A含有NMDA受容体でポジティブアロステリックモジュレーターとして機能し、空間記憶を損なう lupus、ループス:ラテン語で狼の意味
- Kelvin Chan,
- Jacquelyn Nestor,
- Tomás S. Huerta,
- Noele Certain,
- Gabrielle Moody,
- Czeslawa Kowal,
- Patricio T. Huerta,
- Bruce T. Volpe,
- Betty Diamond &
- Lonnie P. Wollmuth
Nature Communications volume 11, Article number: 1403 (2020) Cite this article
Abstract
Patients with Systemic lupus erythematosus (SLE) experience various peripheral and central nervous system manifestations including spatial memory impairment. A subset of autoantibodies (DNRAbs) cross-react with the GluN2A and GluN2B subunits of the NMDA receptor (NMDAR). We find that these DNRAbs act as positive allosteric modulators on NMDARs with GluN2A-containing NMDARs, even those containing a single GluN2A subunit, exhibiting a much greater sensitivity to DNRAbs than those with exclusively GluN2B. Accordingly, GluN2A-specific antagonists provide greater protection from DNRAb-mediated neuronal cell death than GluN2B antagonists. Using transgenic mice to perturb expression of either GluN2A or GluN2B in vivo, we find that DNRAb-mediated disruption of spatial memory characterized by early neuronal cell death and subsequent microglia-dependent pathologies requires GluN2A-containing NMDARs. Our results indicate that GluN2A-specific antagonists or negative allosteric modulators are strong candidates to treat SLE patients with nervous system dysfunction.
全身性エリテマトーデス(SLE)患者は、空間記憶障害を含む様々な末梢神経系および中枢神経系の症状を経験する。自己抗体のサブセット(DNRAbs)は、NMDA受容体(NMDAR)のGluN2AおよびGluN2Bサブユニットと交差反応する。我々は、これらのDNRAbsがNMDARの陽性アロステリックモジュレーターとして作用し、GluN2Aを含むNMDARは、たとえ単一のGluN2Aサブユニットを含むNMDARであっても、GluN2Bのみを含むNMDARよりもDNRAbsに対してはるかに高い感受性を示すことを見出した。従って、GluN2A特異的アンタゴニストは、GluN2Bアンタゴニストよりも、DNRAbが介在する神経細胞死からより大きな保護を提供する。トランスジェニックマウスを用いてin vivoでGluN2AまたはGluN2Bの発現を変化させたところ、DNRAbを介した空間記憶の障害は、早期の神経細胞死とそれに続くミクログリア依存性の病態を特徴とし、GluN2Aを含むNMDARが必要であることがわかった。この結果は、GluN2A特異的アンタゴニストあるいは陰性アロステリックモジュレーターが、神経系機能障害を有するSLE患者を治療する有力な候補となることを示している。
https://www.nature.com/articles/s41467-020-15224-w
全身性エリテマトーデス:https://www.nanbyou.or.jp/entry/53
Discussion
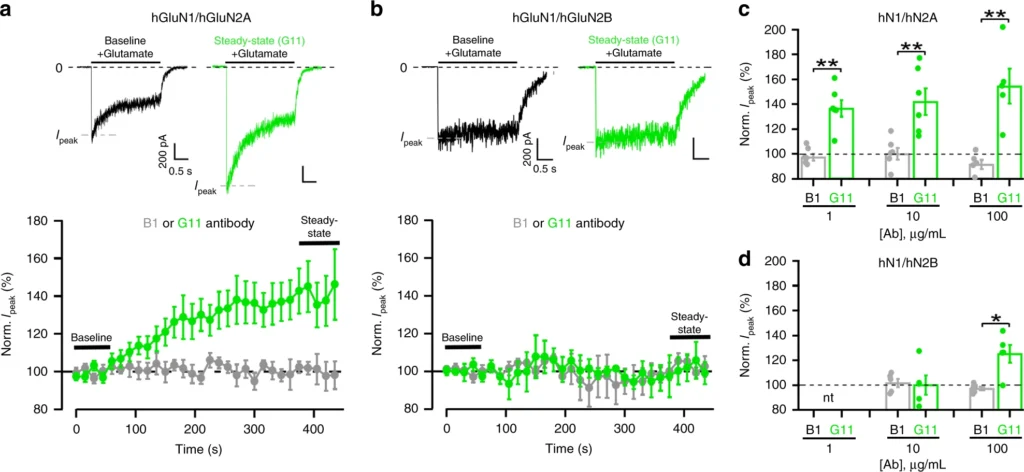
筆者らの実験は、GluN2A NMDARサブユニットがループス自己抗体に関連する様々な神経病理に必要であることを示している。我々は、DNRAbがNMDARの陽性アロステリックモジュレーター(PAM)として作用し、GluN2AサブユニットがGluN2Bサブユニットよりもはるかに高い感受性を示すことを見出した(図1および2)。DNRAbへの曝露は、2つの異なるフェーズで現れる:第一に、急性曝露によるシナプス障害と細胞死、第二に、抗体が検出されなくなった後も起こるミクログリアの活性化による樹状突起の複雑性の喪失である10,19。おそらく、DNRAbsに対するGluN2Aの感受性が高いため、急性暴露中の細胞死が促進されるのであろう。SLE患者2,43に見られるような認知・記憶障害を含む慢性期もGluN2Aに依存しているが、急性期に遭遇した興奮毒性の残存的な結果なのか、あるいはミクログリア依存性の刈り込みをニューロンが受けやすいNMDARの持続的な変化なのかは不明である。
我々が試験したヒトDNRAbであるG11は、DWEYSモチーフを介してNMDAR上のPAMとして作用する(図3b-d)。DNRAbはSLE患者の約30-40%に存在し、これらのDNRAbはDWEYSモチーフを含むペプチドに結合することで同定される9,10,14,44。したがって、PAM作用はすべてのDNRAbsに共通する特徴であると考えられる。この考えと一致して、DWEYSモチーフに結合する精神神経症状を呈するSLE患者の髄液からのポリクローナル抗体は、NMDARの機能亢進を誘導する12,33。とはいえ、DNRAbsのPAM作用の大きさだけでなく、さらなる機能的作用の可能性にもクローン間差がある可能性があり、より多くのSLE患者のDNRAbsを研究する必要がある。
神経系におけるDNRAbsの濃度は、おそらくSLEの病態生理学的経過中に変化する。低濃度では、DNRAbsはもっぱらGluN2Aを含むレセプターに作用するが、高濃度では、DNRAbsはGluN2B二量体レセプターにも作用する(図1)。これまでの研究で、GluN2B特異的阻害剤であるイフェンプロジルが神経保護作用を示すことが示されている10。しかし、これは海馬シナプスの大部分を占めるGluN1/GluN2A/GluN2B NMDARがイフェンプロジルによって阻害されることを反映している可能性が高い26,27。実際、野生型GluN2Aの1コピーでDNRAbsに対する高い感受性が得られることがわかり(図3a)、これはアロステリック調節におけるGluN2Aの優位性と一致する結果である45,46。
DWEYSモチーフはアミノ末端ドメイン(ATD)のクラムシェルヒンジ領域に位置している(図3b-d)。疾患におけるNMDARの機能低下や亢進を標的とするために、GluN2A選択的PAMや負のアロステリックモジュレーター(NAM)が開発されている47,48。ほとんどのGluN2A選択的PAMやNAMがリガンド結合ドメイン(LBD)を標的とするのに対し、ATDはLBDと相互作用してそのアロステリック作用を媒介する49,50,51,52。GluN2A/GluN2B NMDARでは、GluN2AのATDはGluN2BのATDよりもLBDと広範囲に相互作用している45,46。さらに、DWEYSモチーフは他のATDアロステリックモジュレーターの結合部位に近接している。実際、NAMであるZn2+に対する感受性は、SLE抗体によって調節される可能性がある33。Zn2+は、DWEYSモチーフに近接した、あるいはDWEYSモチーフにあるATDクラムシェルのいくつかの残基によって調整される30,31,53,54。GluN2AとGluN2Bの間のZn2+感受性の違いを考えると、GluN2Aを介して観察されるDNRAb誘発増強作用とSLE病態は、緊張性Zn2+の緩和によって影響を受けるのかもしれない31,55,56。とはいえ、正のアロステリック調節をもたらすDNRAbsの作用機序や、GluN2AとGluN2B間の感受性の違いは、依然として不明であるが、潜在的な治療的介入を行うためには、その定義が重要である。
筆者らの研究は、DNRAbsがNMDARゲーティングとは別のメカニズムでサブユニット特異的作用を発揮する可能性を否定するものではない。例えば、抗NMDAR脳炎の病態には受容体ゲーティングはほとんど関与しておらず、むしろ細胞生物学の変化が関与している。自己抗体はNMDARの内在化と慢性的なNMDARの機能低下57,58を引き起こし、NMDARとEphrinB2受容体のようなシナプスタンパク質との相互作用を置換し59,60、あるいはサブユニット選択性を持つシナプスにおけるNMDARのナノスケール組織を破壊する61。DNRAbsはまた、GluN2AとGluN2Bに関連する異なる細胞内経路に関与する可能性がある。興味深いことに、GluN2Aシグナル伝達は転写因子CREBの活性化を通して細胞の生存に関連しており、DNRAbsによる増強という文脈では、GluN2Aを介した増強のメカニズムはやや不可解なままである62。しかしながら、GluN2Aの過剰活性化が興奮毒性に寄与することを示唆する証拠が増えつつある62,63,64。GluN2AはSLE神経病理学の急性期と慢性期の両方に寄与している。GluN2A NAMの使用は、SLEの精神神経症状を治療する鍵となるかもしれないが、どのNMDAR阻害剤も好ましくない副作用を引き起こす可能性がある20,65,66。明確な病態生理学的段階におけるDNRAb-NMDAR相互作用のメカニズムの詳細を明らかにすることは、SLE患者の神経精神症状を急性症状が起こる前に予防し、SLEの慢性期に治療するための治療戦略をよりよく開発し、調整するのに役立つであろう。
●新医学専攻コース(研究室実習)(医学類HPより抜粋)
さらに5年次後半から6年次前半までのおよそ半年間は、希望する研究室にてフルタイムで研究を行う新医学専攻コースを選択できます。また、これを選択した学生の中から、毎年2名に限り研究医養成コースに入ることができます。研究医養成コースに入ると月額5万円程の奨学金が支給され、また卒業後は直ちに大学院博士課程に進学し、早期に博士の学者として大学を始めとする教育研究機関で活躍することが期待されます。
*当研究室では、新医学専攻コースで研究室に参加する学生を募集中です。よろしくお願いします。
