がん悪液質(Cancer cachexia)は、進行がんにしばしば合併する全身性の代謝異常を伴う複雑な症候群であり、単なる栄養不良とは異なり、骨格筋量の著しい減少を中心とする進行性の筋萎縮を特徴とします。これは脂肪組織の減少、全身性炎症、代謝の異常、食欲不振などを伴い、栄養療法だけでは回復が難しいという点で重篤な臨床的意義をもちます。国際的には、体重が6か月以内に5%以上減少した場合、または2%以上の減少かつBMIが20未満、あるいは筋肉量の減少(サルコペニア)を伴う場合にがん悪液質と診断されます。
その病態は、がん細胞から分泌されるサイトカイン(TNF-α、IL-1、IL-6など)や腫瘍由来の因子(プロテオリシス誘導因子や脂質動員因子)、さらに宿主の免疫反応による慢性的な炎症により形成されます。これらは骨格筋タンパク質の異化を促進するユビキチン–プロテアソーム系の活性化を引き起こし、筋萎縮を招くだけでなく、脂肪組織のリポリシス促進、インスリン抵抗性、視床下部を介した食欲抑制など、多方面にわたる代謝の異常を誘導します。その結果、患者は非可逆的な体重減少、食欲不振、著しい倦怠感、筋力低下、免疫機能の低下などを呈し、日常生活動作(ADL)の著しい低下を招くほか、がん治療の効果や耐用性にも深刻な影響を及ぼします。
診断は体重の経時的変化や筋肉量、BMI、血液中のCRPやアルブミン、栄養評価スコアなどの指標によって行われ、画像診断ではCTスキャンによる筋断面積の定量が用いられることもあります。治療には多職種による統合的なアプローチが必要であり、まず栄養療法として高カロリー・高タンパクの食事や経口栄養補助食品の投与が行われますが、これだけでは不十分であることが多いため、薬物療法が併用されます。薬剤には食欲増進作用を持つメゲストロール酢酸エステル、グレリン受容体作動薬のオルモテグレリン(日本のみ承認)、ステロイド薬、炎症性サイトカインを抑制するサリドマイドなどがあり、それぞれの作用と副作用を考慮しながら使用されます。また、レジスタンス運動や有酸素運動などの運動療法も筋力維持のために有用とされ、リハビリテーションによる機能回復が図られます。加えて、疼痛緩和や精神的支援を含むサポーティブケアも重要です。
がん悪液質は、がん患者の30%以上の死因に関与するとも言われており、その存在は予後を大きく左右します。抗がん治療に対する反応性の低下や毒性の増加、入院期間の延長などを引き起こすため、早期の認識と介入が極めて重要です。治療戦略の中心には、疾患の進行を遅らせ、QOL(生活の質)を改善し、最終的には患者の生存期間を延ばすことが据えられています。がん悪液質に対する理解とケアは、がん治療の一環として不可欠な領域となっています。
Science 11 Apr 2025 Vol 388, Issue 6743
A neuroimmune circuit mediates cancer cachexia-associated apathy (神経免疫回路ががん悪液質に関連する無気力を媒介する)
Xiaoyue Aelita Zhu 1 2, Sarah Starosta # 1, Miriam Ferrer # 3, Junxiao Hou 1 2, Quentin Chevy 1, Federica Lucantonio 4, Rodrigo Muñoz-Castañeda 3, Fengrui Zhang 5, Kaikai Zang 1, Xiang Zhao 3, Francesca R Fiocchi 5, Mason Bergstrom 1, Aubrey A Siebels 3, Thomas Upin 1, Michael Wulf 1, Sarah Evans 1, Alexxai V Kravitz 6, Pavel Osten 3, Tobias Janowitz 3, Marco Pignatelli 4, Adam Kepecs 1 5
Department of Neuroscience, Washington University School of Medicine, St. Louis, MO, USA.
Editor’s summary
Cachexia, or wasting syndrome, arises during advanced stages of many chronic diseases, including cancer, and is often associated with loss of motivation and apathy. It is known that inflammation is a critical factor in cancer cachexia. However, the link between tumor-induced inflammation and the underlying brain mechanisms that produce motivational deficits remains elusive. Using a well-established mouse model of cancer cachexia, Zhu et al. uncovered a brainstem-to-basal ganglia circuit that suppresses dopamine signaling (see the Perspective by Dalley and Lynall). Neurons in the area postrema sense the inflammatory cytokine interleukin-6 and relay this signal to the parabrachial nucleus. The parabrachial nucleus drives inhibitory neurons in the substantia nigra pars reticulata, which then suppress dopamine neurons in the ventral tegmental area. This sequence reduces dopamine levels in the nucleus accumbens, ultimately increasing effort sensitivity and lowering motivation. —Peter Stern
悪液質、すなわち消耗症候群は、がんを含む多くの慢性疾患の進行期に生じ、しばしば意欲の喪失や無気力と関連している。炎症ががん悪液質の重要な要因であることは知られている。しかし、腫瘍が誘発する炎症と、意欲の欠如を生み出す脳の根本的なメカニズムとの関連性は依然として不明である。Zhu et al. は、がん性悪液質の確立されたマウスモデルを使用し、ドーパミン信号を抑制する脳幹から大脳基底核の回路を発見した(Dalley および Lynall による展望を参照)。延髄の神経細胞は炎症性サイトカインであるインターロイキン-6を感知し、その信号をパラブレム核に伝達する。パラブレム核は黒質網様体の抑制性ニューロンを刺激し、黒質網様体は腹側被蓋野のドーパミンニューロンを抑制する。この一連の流れにより、側坐核のドーパミンレベルが低下し、最終的に努力感受性が高まり、意欲が低下する。
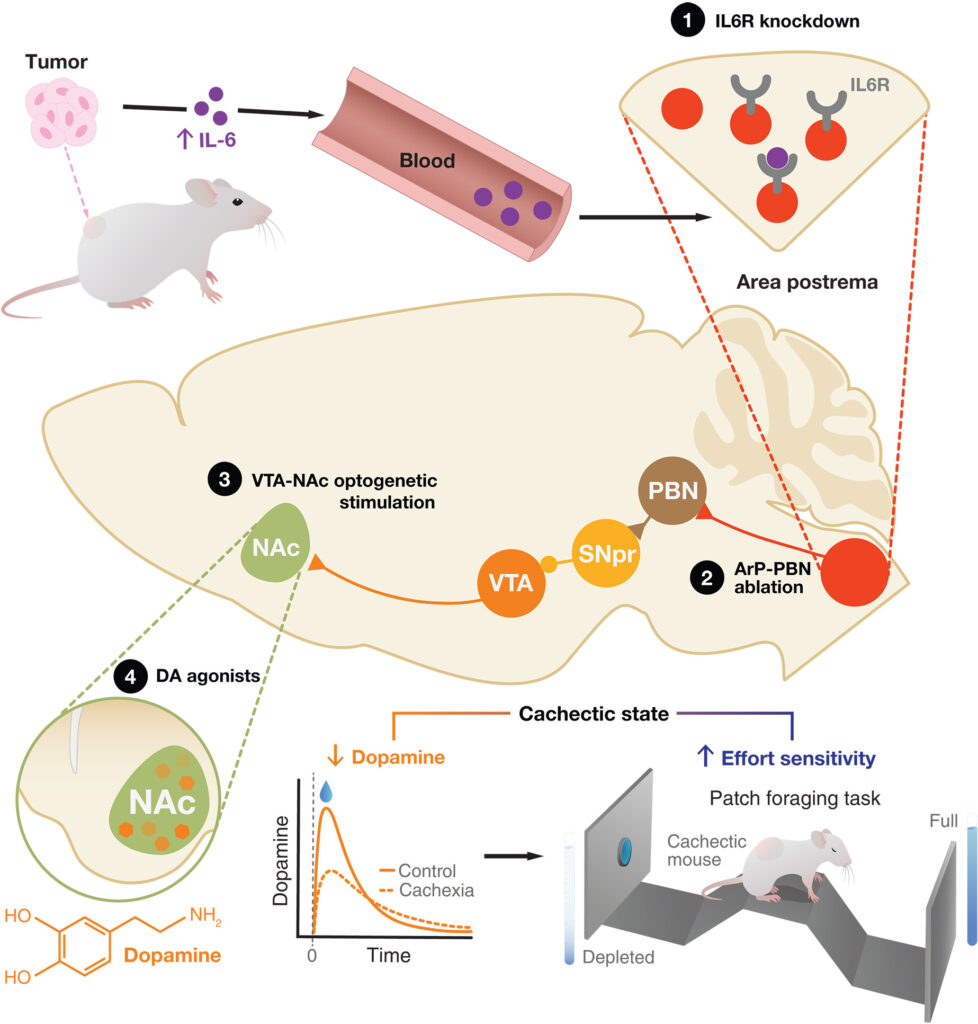
最後野(ArP)は、がん性悪液質におけるIL-6レベルの上昇を検知し、側坐核(NAc)における中脳辺縁系ドーパミンの減少につながる。この減少により努力への感受性が高まり、悪液質マウスに無気力のような行動が生じる。特定の回路ノード(黒丸)を機能増強または機能減弱操作によって標的とすることで、これらの行動を回復させることができた。DA:ドーパミン、PBN:パラブレム核、SNpr:黒質網様体、VTA:腹側被蓋野。
Abstract:
がん悪液質は炎症性疾患に伴う深刻な消耗性症候群であり、極度の疲労、無気力、抑うつを伴う。マウスモデルにより、IL-6を感知する脳幹から大脳基底核への神経回路が、動機づけの低下を媒介することが示された。抗IL-6抗体処理や神経回路の操作によって、この無気力様症状は改善された。
Background:
悪液質は体重減少、筋肉や脂肪の喪失、エネルギーバランスの崩壊を特徴とし、多くのがん患者に見られるが、その神経精神症状の生物学的基盤は不明だった。
Methods:
C26腫瘍細胞を皮下移植したマウスモデルを用い、行動試験(オペラントタスク、探索、報酬感受性、絶望試験)、サイトカイン測定、脳活動の全脳マッピング、神経回路の光遺伝学・薬理学的操作を実施した。
Results:
本研究では、がん悪液質(cachexia)モデルマウスを用いて、無気力様行動が特定の神経免疫回路によって媒介されることを示した。以下のような詳細な結果が得られている。
- 行動的変化: 悪液質マウスは体重減少(脂肪量87%減、筋肉量43%減)、摂食量低下を示し、努力感受性の高い行動タスク(プログレッシブレシオ、パッチフォレージング)においてのみ著しい動機づけの低下(breakpointの減少、水報酬の減少、試行回数の減少、port切り替えの減少)を示した。一方、快感の欠如(sucrose preference)、絶望(強制水泳、尾懸垂試験)、一般的な活動性(open field)には大きな変化が見られず、無気力は単なる虚弱やうつ病様症状ではないことが示唆された。
- 神経炎症: 血漿および脳内のサイトカイン44種を網羅的に解析したところ、IL-6の濃度が悪液質進行と並行して上昇し、血液脳関門の透過性増加により脳内への移行が確認された。また、広範なミクログリア活性化(Iba1染色)も観察された。
- 神経回路マッピング: 全脳c-Fosマッピングにより、悪液質ではparabrachial nucleus(PBle)、area postrema(ArP)、nucleus tractus solitarius(NTS)の活動上昇と、VTA(ventral tegmental area)活動の抑制、ならびにnucleus accumbens medial shell(mNAc-sh)におけるホットスポットの活動亢進が同定された。
- ドーパミン動態: 光ファイバーフォトメトリーを用いた生体内ドーパミン測定により、NAcにおける報酬誘導性ドーパミン放出が悪液質の進行とともに低下し、動機づけの減少と相関した。
- 機能的介入:
- IL-6ブロック:抗IL-6抗体投与により、ドーパミン放出と動機づけの回復が観察された(cachexia後期の投与でも効果あり)。
- 回路ノード操作:ArPにおけるIL-6受容体(IL6R)ノックダウン、ArP→PBN投射ニューロンのアブレーション、PBN→VTA間のシナプス比制御によっても動機づけは改善した。
- ドーパミン増強:VTA→NAcドーパミン投射への光刺激、および局所へのD1/D2ドーパミンアゴニスト投与により、努力関連行動が回復した。ただし、これらの介入は体重減少や生存期間には影響を与えなかった。
- 回路メカニズム: ArPで感知されたIL-6信号がPBNに伝達され、PBNからの入力によりsubstantia nigra pars reticulata(SNpr)のGABA作動性ニューロンが活性化、それがVTAのドーパミンニューロンを抑制することが示された。結果として、NAcでのドーパミン低下と無気力様行動が生じた。
議論:
本研究は、がん悪液質に伴う無気力の行動症状が、末梢性炎症(特にIL-6)によって駆動される特異的な神経回路により媒介されていることを初めて明らかにした。以下の点が議論されている。
- 適応と病理の二面性: このArP→PBN→SNpr→VTA→NAc回路は、急性炎症時にはエネルギー節約のために動機づけを抑制するという生理的適応と考えられるが、がんのような慢性状態では逆に害となり、病的な無気力に至る。
- 無気力の独立性: 無気力(apathy)はうつ病、快楽消失、運動能力低下とは独立した症状であることが、努力感受性に基づいた行動評価により明らかとなった。
- IL-6の中心的役割: IL-6は末梢から脳に移行し、ArPのIL6Rを介して神経回路を活性化する。既承認の抗IL-6治療薬(関節リウマチ等に使用)がこの症状に再利用可能なことが示唆された。
- 局所介入の有効性: 局所的な神経回路介入(光遺伝学、薬理学的刺激)は行動回復に有効だが、代謝的改善や寿命延長には至らなかったことから、行動的症状と代謝的症状の乖離が示された。
- 臨床への意義: IL-6が上昇する他の炎症性疾患(自己免疫疾患、うつ病など)にも同様の回路が関与する可能性があり、努力感受性に基づく動機づけの定量評価はヒトへの応用も可能とされている。
- 今後の展望: 血液脳関門の障害、ミクログリアの関与、他の炎症性因子(例:GDF-15、prostaglandinなど)の影響も考慮することで、より包括的な炎症-行動連関の理解が進むと考えられる。
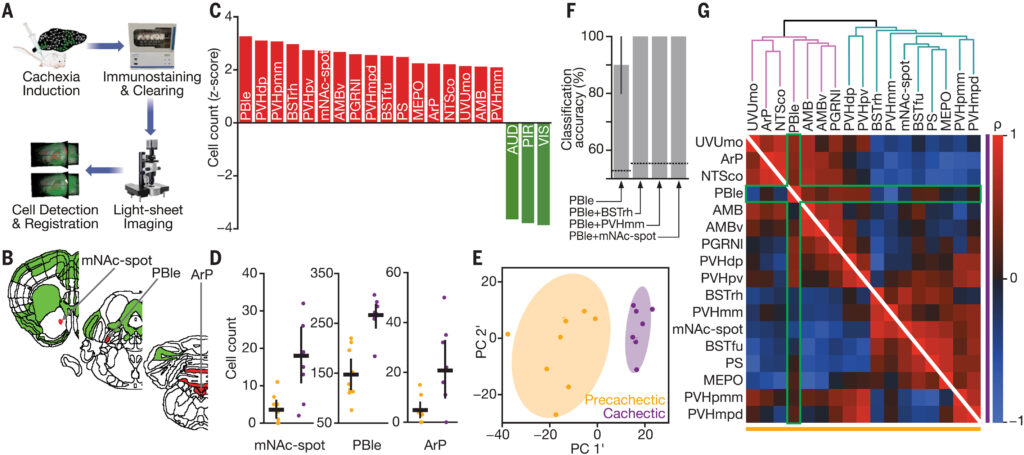
Figure 3a:
全脳c-Fosスクリーニングのワークフロー。即時早期遺伝子であるc-Fosを用いた細胞レベルでの脳活動マッピングを行うために、免疫染色、組織クリアリング、ライトシート顕微鏡、全自動細胞検出、脳部位とのアトラス登録が行われた。
Figure 3b:
c-Fosによって有意に活性化された領域(赤)と抑制された領域(緑)のセクション画像。mNAc-shホットスポット、PBle(parabrachial nucleus外側部)、ArP(area postrema)が灰色の矢印で強調されている。
Figure 3c:
有意に活性化された領域(赤)および上位3つの有意に抑制された領域(緑)におけるc-Fos陽性細胞数のzスコアを示す。
Figure 3d:
precachectic群(黄)とcachectic群(紫)でのmNAcホットスポット、PBle、ArPのc-Fos陽性細胞の生データ(カウント数)を、平均値(横棒)と標準偏差(縦棒)で示す。
Figure 3e:
全807領域のc-Fos陽性細胞カウントを主成分分析(PCA)で可視化し、precachectic群(黄)とcachectic群(紫)で明確に分類できることを示す。楕円は各グループの95%信頼区間を表す。
Figure 3f:
ステップワイズロジスティック回帰によって、活性化された領域のc-Fosカウントを用いてcachecticかprecachecticかを分類した際の分類精度。1つの領域(左)または2つの領域(右)を使ったときの平均精度を破線で示しており、PBle単独でも分類に有効であること、他の部位(例:BSTrh, PVHmm, mNAc)と組み合わせることで分類精度が100%に達することを示す。
Figure 3g:
precachectic群(左下)およびcachectic群(右上)における、活性化された領域間の相関(r)の三角相関行列。領域はcachectic群での階層クラスタリングに基づいて並べられており、PBleとの相関は緑枠で強調されている。上部にはクラスタリングデンドログラムも示され、特にhindbrain(桃)とpallidum-hypothalamus(シアン)のクラスター形成が認められる。
総合的解釈:
図3は、cachexiaによる神経活動のネットワーク変化を脳全体のc-Fos発現を通じて可視化したものであり、特にPBle(parabrachial nucleus外側部)とArP(area postrema)、mNAc-sh(nucleus accumbens medial shell)における活動亢進が無気力症状に関与する主要ノードであることを示している。また、これらの活動変化がcachexiaの行動的症状と整合すること、PBleの活動が他のネットワーク構造の中心的役割を担っていることが示唆される。
