本日のラボセミナーでは医学類M3のTさんが、下記の論文を紹介してくれました。プレゼンテーションファイルがわかりやすくまとめられていて、落ち着いた論文紹介でした。〇〇実習の際にも落ち着いてしっかりと作業してくださいました。その様子を今でもありありと思いだすことができるほど、鮮烈な才能をお持ちだと思います。今後のご活躍が楽しみです。臨床実習などでお休みの方がいらっしゃったのでセミナーは少し寂しい感じがしました。
続けて生物学類2年生SさんがAREの報告会に参加した印象をまとめてくれました。7か月間の頑張りを丁寧に説明してくれました。セミナー後に話したところ、レポートの締め切りがヤバいとのことでした(いつもヤバそうです)。武井教授から、Sさんに成人のお祝いが贈られました。おめでとうございます💐
本日は盛りだくさんで、さらに生物学類のHさんが研究進捗報告をしてくれました。もうすぐ卒業研究発表会ですので、頑張ってください!スタッフTとSは、生物学類人間生物コースを対象とした「人間生物学II」講義をしました。3限連続で解剖の講義お疲れ様でした。もう少し早い時期に生物学類の学生の方と時間を共有したいのですが、カリキュラム上どうしても3年生の冬になってしまいます。講義室がコロコロ変更になって受講生には申し訳ない感じでした。
J Neuroinflammation. 2024 Jan 18;21(1):25. doi: 10.1186/s12974-024-03018-6.
Repeated cold stress, an animal model for fibromyalgia, elicits proprioceptor-induced chronic pain with microglial activation in mice (繰り返しの寒冷ストレスは線維筋痛症の動物モデルとして、固有感覚受容器誘発性の慢性疼痛とミクログリア活性化を引き起こす)
Koji Wakatsuki 1, Sumiko Kiryu-Seo 2, Masaya Yasui 1 3, Hiroki Yokota 4, Haruku Kida 1, Hiroyuki Konishi 1, Hiroshi Kiyama 5
https://www.med.nagoya-u.ac.jp/Anatomy2/index.htm
Abstract
Background: Fibromyalgia is characterized by chronic pain, fatigue, and other somatic symptoms. We have recently revealed that proprioceptor hyperactivation induces chronic pain in a rat model of myalgic encephalomyelitis. The present study explores whether similar proprioceptor-induced pain is elicited in a mouse model of fibromyalgia.
Methods: Repeated cold stress (RCS) was used as a fibromyalgia model. Pain behavior was examined using the von Frey test, and neuronal activation was examined immunohistochemically as activating transcription factor (ATF)3 expression. The Atf3:BAC transgenic mouse, in which mitochondria in hyperactivated neurons are specifically labeled by green fluorescent protein, was used to trace the activated neuronal circuit. PLX3397 (pexidartinib) was used for microglial suppression.
Results: RCS elicited long-lasting pain in mice. ATF3, a marker of cellular hyperactivity and injury, was expressed in the lumbar dorsal root ganglion (DRG) 2 days after RCS initiation; the majority of ATF3-expressing DRG neurons were tropomyosin receptor kinase C- and/or vesicular glutamate transporter 1-positive proprioceptors. Microglial activation and increased numbers of microglia were observed in the medial part of the nucleus proprius 5 days after RCS initiation, and in the dorsal region of the ventral horn 7 days after RCS. In the ventral horn, only a subset of motor neurons was positive for ATF3; these neurons were surrounded by activated microglia. A retrograde tracer study revealed that ATF3-positive motor neurons projected to the intrinsic muscles of the foot (IMF). Using Atf3:BAC transgenic mice, we traced hyperactivated neuronal circuits along the reflex arc. Green fluorescent protein labeling was observed in proprioceptive DRG neurons and their processes originating from the IMF, as well as in motor neurons projecting to the IMF. Microglial activation was observed along this reflex arc, and PLX3397-induced microglial ablation significantly suppressed pain behavior.
Conclusion: Proprioceptor hyperactivation leads to local microglial activation along the reflex arc; this prolonged microglial activation may be responsible for chronic pain in the present model. Proprioceptor-induced microglial activation might be the common cause of chronic pain in both the fibromyalgia and myalgic encephalomyelitis models, although the experimental models are different.
Keywords: Chronic fatigue syndrome; Fibromyalgia; Intermittent cold stress; Microglia; Myalgic encephalomyelitis; Neuronal inflammation; Pain.
Abstract
本研究では、繰り返しの寒冷ストレス(RCS)を線維筋痛症のマウスモデルとして使用し、固有感覚受容器の過剰活性化による慢性疼痛のメカニズムを調査した。RCSを受けたマウスでは、長期にわたる痛みが確認され、腰部脊髄後根神経節(DRG)におけるATF3(活性化転写因子3)の発現が増加した。さらに、ミクログリアの活性化が脊髄の特定部位で観察され、PLX3397によるミクログリアの除去が痛みを軽減したことから、ミクログリア活性が慢性疼痛の一因であることが示唆された。
Background
線維筋痛症(FM)は慢性疼痛、疲労、睡眠障害を特徴とする疾患であり、その発症メカニズムは十分に解明されていない。過去の研究では、慢性疲労症候群(CFS)/筋痛性脳脊髄炎(ME)の動物モデルにおいて、固有感覚受容器の過剰活性化がミクログリアの活性化を引き起こし、慢性疼痛を発生させることが示されている。本研究では、同様のメカニズムが線維筋痛症モデルでも関与するかを検討した。
Methods
- モデル作成: RCSを用いたマウス線維筋痛症モデルを作成し、7日間にわたり30分ごとに7°Cと22°Cの温度変化を繰り返し与えた。
- 疼痛行動評価: 電子von Freyテストを用いて足底の機械的刺激閾値(PWT)を測定した。
- 組織解析: 免疫組織化学的手法により、ATF3およびミクログリアマーカー(Iba1)の発現を評価。
- 神経回路解析: ATF3:BACトランスジェニックマウスを使用し、固有感覚回路の活性化をGFP標識ミトコンドリアにより可視化した。
- ミクログリア抑制: PLX3397(pexidartinib)を投与し、ミクログリアの除去が疼痛行動に与える影響を検討している。
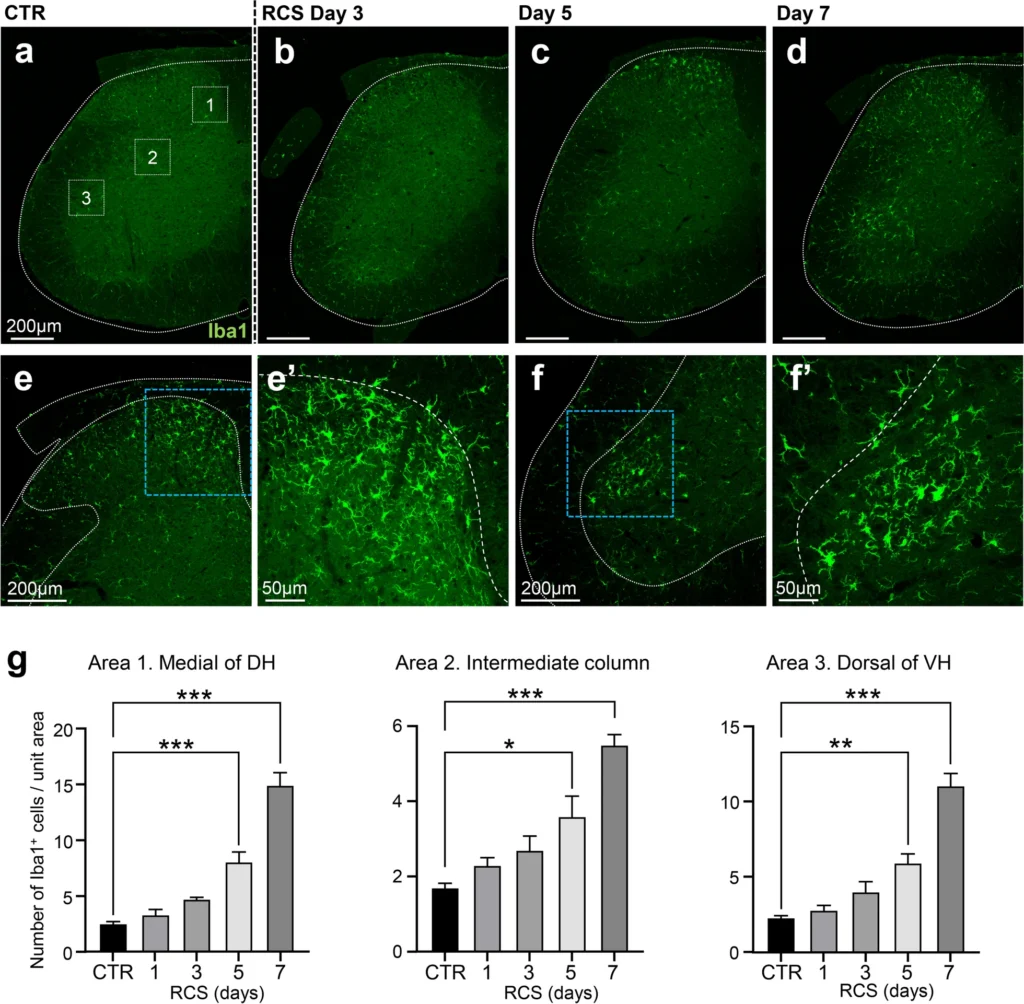
Results
- RCSによる疼痛の持続: PWTが低下し、RCS終了後17日間持続した。
- ミクログリアの活性化: RCS 5日目から脊髄後角の内側部と腹角背側部で顕著なミクログリアの増殖・活性化が観察された。
- ATF3の発現:
- DRGでは、RCS 1日目からATF3発現が増加し、7日目にはDRGニューロンの21.5%が陽性に。
- 脊髄腹角の特定の運動ニューロンでもATF3が発現し、活性化したミクログリアに囲まれていた。
- 固有感覚回路の活性化:
- GFP標識ミトコンドリアを用いた解析で、IMF(足内在筋)由来の固有感覚ニューロンおよび対応する運動ニューロンが活性化していた。
- 筋紡錘や神経筋接合部にもGFP陽性繊維が観察された。
- ミクログリア抑制による疼痛軽減: PLX3397投与によりミクログリアの活性化が抑制され、PWTが有意に回復。
Discussion
- 本研究では、線維筋痛症モデルにおいて、固有感覚受容器の過剰活性化が脊髄反射弧を介してミクログリアの活性化を誘導し、慢性疼痛を引き起こすことが示された。
- 慢性疲労症候群(CFS/ME)モデルと同様のメカニズムが関与する可能性があり、機械的刺激の繰り返しがミクログリア活性化の引き金となると考えられる。
- 本研究の結果は、線維筋痛症やCFS/MEにおける新たな治療標的として、ミクログリア制御の重要性を示唆している。
本研究は、線維筋痛症モデルにおいて固有感覚受容器の過剰活性化が慢性疼痛を引き起こすことを初めて示し、ATF3:BACトランスジェニックマウスを用いた神経回路の可視化により、その詳細なメカニズムを解明した。さらに、PLX3397によるミクログリア抑制が疼痛軽減に寄与することを実証し、線維筋痛症におけるミクログリアの役割を明確にした。また、慢性疲労症候群(CFS/ME)のモデルと共通する「固有感覚受容器の過剰活性化 → ミクログリア活性化 → 慢性疼痛」の経路を発見し、両疾患に共通する治療ターゲットの可能性を示した。一方で、本研究はオスのマウスのみを対象としており、性差による影響の可能性が考慮されていない点や、疼痛の原因が固有感覚受容器の過剰活性化以外の要因(例: 精神的ストレス)による影響を完全には排除できない点が限界として挙げられる。しかし、本研究の成果は、線維筋痛症およびCFS/MEに対する新たな治療戦略としてミクログリア制御の重要性を示唆し、PLX3397や類似の薬剤を用いた疼痛管理の開発に貢献するとともに、他の機能性身体症候群(FSS)における疼痛メカニズムの解明にも寄与する可能性がある。





