Prog Neurobiol. 2024 Mar:234:102586. doi: 10.1016/j.pneurobio.2024.102586. Epub 2024 Feb 16.
A cytoskeleton symphony: Actin and microtubules in microglia dynamics and aging (細胞骨格の交響曲: ミクログリア動態と老化におけるアクチンと微小管)
Renato Socodato 1, João B Relvas 2
1Institute of Research and Innovation in Health (i3S) and Institute for Molecular and Cell Biology (IBMC), University of Porto, Porto, Portugal. Electronic address: renato.socodato@ibmc.up.pt.
2Institute of Research and Innovation in Health (i3S) and Institute for Molecular and Cell Biology (IBMC), University of Porto, Porto, Portugal; Department of Biomedicine, Faculty of Medicine of the University of Porto (FMUP), Porto, Portugal.
ハイライト
- アクチンと微小管が協調的に作用して、ミクログリアの細胞骨格の挙動を形作る。
- アクチンと微小管のダイナミクスがミクログリアの恒常性維持機能を支える。
- サイクリン依存性キナーゼ1が微小管のダイナミクスとミクログリアの反応性を橋渡しする。
- アクチンの重合が、多様な機能状態におけるミクログリアの運動性を調整する。
- アクチン-微小管ネットワークの崩壊は、老化したミクログリアの特徴である。
Abstract
Microglia dynamically reorganize their cytoskeleton to perform essential functions such as phagocytosis of toxic protein aggregates, surveillance of the brain parenchyma, and regulation of synaptic plasticity during neuronal activity bursts. Recent studies have shed light on the critical role of the microtubule cytoskeleton in microglial reactivity and function, revealing key regulators like cyclin-dependent kinase 1 and centrosomal nucleation in the remodeling of microtubules in activated microglia. Concurrently, the role of the actin cytoskeleton is also pivotal, particularly in the context of small GTPases like RhoA, Rac1, and Cdc42 and actin-binding molecules such as profilin-1 and cofilin. This article delves into the intricate molecular landscape of actin and microtubules, exploring their synergistic roles in driving microglial cytoskeletal dynamics. We propose a more integrated view of actin and microtubule cooperation, which is fundamental to understanding the functional coherence of the microglial cytoskeleton and its pivotal role in propelling brain homeostasis. Furthermore, we discuss how alterations in microglial cytoskeleton dynamics during aging and in disease states could have far-reaching implications for brain function. By unraveling the complexities of microglia cytoskeletal dynamics, we can deepen our understanding of microglial functional states and their implications in health and disease, offering insights into potential therapeutic interventions for neurologic disorders.
ミクログリアは、有害なタンパク質凝集体の貪食、脳実質の監視、神経細胞の活動が活発な時期におけるシナプス可塑性の制御など、重要な機能を果たすために、その細胞骨格を動的に再編成する。最近の研究により、ミクログリアの反応性と機能における微小管細胞骨格の重要な役割が明らかになり、活性化ミクログリアにおける微小管の再構築において、サイクリン依存性キナーゼ1や中心体核形成などの主要な制御因子が関与していることが明らかになった。同時に、アクチン細胞骨格の役割も極めて重要であり、特にRhoA、Rac1、Cdc42などの低分子量GTP結合タンパク質やプロフィリン-1、コフィリンなどのアクチン結合分子との関連において重要である。本稿では、アクチンと微小管の複雑な分子構造を掘り下げ、ミクログリア細胞骨格のダイナミクスを推進する両者の相乗的役割について探求する。アクチンと微小管の協調作用について、より統合的な見解を提案する。これは、ミクログリア細胞骨格の機能的整合性と、脳の恒常性維持におけるその重要な役割を理解する上で基本となるものである。さらに、加齢や疾患状態におけるミクログリア細胞骨格のダイナミクス変化が、脳機能にどのような広範な影響を及ぼす可能性があるかについても考察する。ミクログリア細胞骨格のダイナミクスの複雑性を解明することで、ミクログリアの機能状態と健康および疾患におけるその影響についての理解を深めることができ、神経疾患に対する潜在的な治療介入への洞察が得られる。
Abstract
マイクログリアは細胞骨格を動的に再構築し、毒性タンパク質の凝集体の貪食、脳実質の監視、神経活動時のシナプス可塑性の調節などの重要な機能を果たします。本研究はアクチンと微小管の協調作用に焦点を当て、これらの要素がどのようにしてマイクログリアの動態を形成し、脳の恒常性を維持するかを詳細に解析します。また、老化や病理状態における変化の影響についても考察し、神経障害の治療法に向けた洞察を提供します。
Background
従来、アクチンと微小管は独立した要素として研究されてきましたが、近年の研究ではこれらの相互作用が明らかになりつつあります。アクチンは局所的な機能、微小管は長期的な細胞変化に関連しているとされてきましたが、最新の知見では両者の協調的な役割が示されています。
Methods
本研究は、細胞および分子神経科学の最新技術を用いて、マイクログリア細胞骨格の構造と動態の詳細な解析を行いました。特に、アクチンと微小管の動態を制御する分子メカニズムを明らかにするための実験が実施されました。
Results
- アクチンは主に細胞の局所的な機能、例えば貪食や脳環境の監視に関与しています。
- 微小管は、細胞の形態変化やシナプス可塑性の維持など、長期的な機能をサポートします。
- 老化に伴い、アクチンと微小管の動態が変化し、マイクログリアの監視能力や炎症反応に影響を与えます。
Discussion
アクチンと微小管の相互作用は、ミクログリアの機能状態の移行において重要な役割を果たします。また、これらの変化が老化や神経疾患に与える影響を理解することは、治療法の開発において有望なターゲットとなります。本研究は、アクチンと微小管の協調的な役割に焦点を当て、これらがどのようにしてマイクログリアの機能と老化に影響を与えるかを包括的に示しました。本研究の多くの知見はin vitro実験に基づいており、生体内での確認が必要です。また、分子間の詳細な相互作用の理解にはさらなる研究が求められます。神経疾患治療に向けた新規治療法の開発や、老化に伴う脳機能低下を抑制するためのターゲットとして、アクチンと微小管の制御が注目されます。
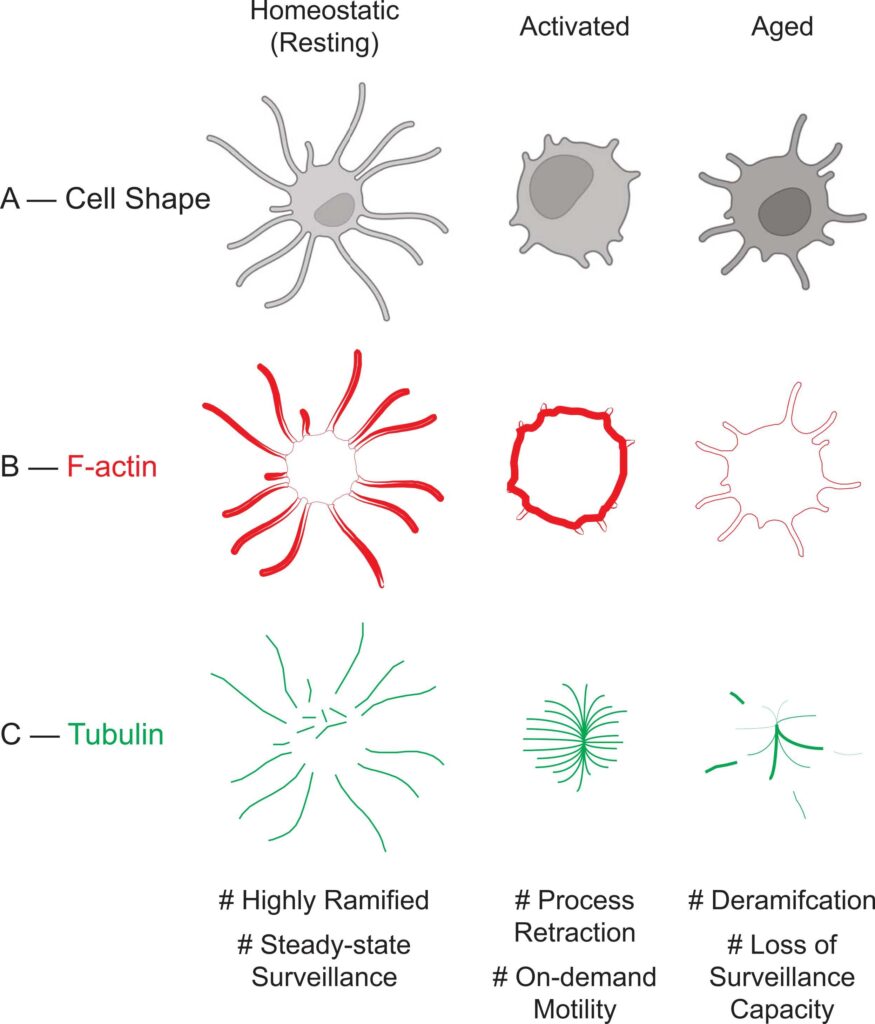
図1: マイクログリアの機能状態と細胞骨格成分との相関
図1は、マイクログリアの3つの機能状態(休止状態(Homeostatic)、活性化状態(Activated)、老化状態(Aged))における細胞形態と細胞骨格成分(F-アクチンと微小管)の分布と構造の変化を示しています。
Figure 1A: Cell Shape(細胞形態)
- 休止状態:
- 細胞は高度に分岐した**樹状形態(ramified structure)**を持ち、環境監視を効率的に行う安定した状態を示す。
- この状態は、周囲のシナプスや脳実質のモニタリングに適している。
- 活性化状態:
- 細胞突起が明らかに縮小し、細胞全体がコンパクトで動的な形態に移行。
- 外部刺激への迅速な応答のために構造的変化が生じていることを示唆。
- 老化状態:
- 分岐が減少し、樹状構造が単純化。この形態変化は、老化による監視能力の低下や機能障害を反映している。
Figure 1B: F-Actin(アクチンフィラメント)
- 休止状態:
- F-アクチンは主に細胞突起に局在し、監視活動をサポート。
- この局在は、フィロポディア(感覚突起)やラメロポディア(細胞膜隆起)の形成を促進し、環境感知を最適化する。
- 活性化状態:
- F-アクチンが細胞体全体に再分布し、特に**膜隆起(membrane ruffles)**に多く見られる。
- この分布変化は、貪食や局所的な細胞移動能力を高めることに寄与。
- 老化状態:
- プロフィリン1の発現低下によりF-アクチン含量が減少。
- この変化は、老化に伴うマイクログリアの動態や炎症応答の低下を反映している。
Figure 1C: Tubulin(微小管)
- 休止状態:
- 微小管は主にゴルジ体の周辺で非中心性構造として核形成され、安定した形態を維持。
- 細胞の構造維持や物質輸送をサポートするため、特定の分布をとる。
- 活性化状態:
- 微小管は中心性構造へと再構成され、中心体近傍で放射状に配置される。
- これは、LPS-IFNγやIL-4などの刺激に応答して生じる変化であり、サイトカイン分泌を含む細胞内プロセスを効率化する。
- 老化状態:
- 微小管の安定性が変化し、**後翻訳修飾(アセチル化や脱チロシン化)**の変化や微小管関連タンパク質(MAP)の発現低下が観察される。
- この変化は、シナプス剪定能力の低下や炎症反応の効率低下に関連する可能性が高い。
全体的な解釈:
- 図1は、マイクログリアの細胞骨格(F-アクチンと微小管)が各機能状態(休止、活性化、老化)においてどのように再構成され、機能的な変化を引き起こすかを視覚的に示しています。
- 休止状態では環境監視を最適化する形態が維持され、活性化状態では迅速な応答のための再構成が見られます。一方、老化状態ではこれらの能力が低下し、神経保護的役割が損なわれることが強調されています。

2025年01月13日掲載